浸提方法对药用卤化丁基橡胶塞体外细胞毒性评价的影响
邝辉 曹苹 王晓炜 深圳市药品检验所 (深圳 518057)
卤化丁基橡胶塞因其具有优良的化学惰性以及气密性而广泛用于药品包装。卤化丁基橡胶塞与内装药物的相容性自始就是各生产企业关注的重点,同时其生物安全性也逐渐引起人们的注意。体外细胞毒性实验是生物安全性评价的重要组成部分,是评价直接或间接接触人体组织和细胞的医疗器械和药品包装材料的通用方法[1]。目前我国药品包装材料相关标准推荐的方法有:相对增殖度法、琼脂扩散法、直接接触法、浸提法[2]。浸提液实验是目前用于检测药品包装材料细胞毒性的比较广泛的一种方法,选择不同的浸提方法可能对实验结果有着直接的影响。本实验遵循药品包装材料的生物学评价相关标准,经不同的浸提方法制备相应的浸提液,以MTT 比色法[3]作为主要检测手段评价卤化丁基橡胶塞浸提液对细胞的毒性,重点考察不同的浸提方法对各企业生产的卤化丁基橡胶塞细胞毒性评价的影响。
1 材料与方法
1.1 主要试剂与仪器
小鼠成纤维细胞L929(中国典型培养物保藏中心,CCTCC),CO2细胞培养箱(Thermo Forma),倒置相差显微镜(Lecia),Multiskan Spectrum酶标仪(Labsystems),Milli-Q纯水系统,恒温恒湿培养箱(Binder),针式过滤器(Pall),胎牛血清(Gibco),MEM培养液(Sigma),胰蛋白酶(Gibco),噻唑蓝(MTT,Sigma),DMSO(Amresco),11批药用卤化丁基橡胶塞,高密度聚乙烯(北京第一制药厂)。
1.2 实验方法
1.2.1 浸提液的制备
浸提方法一[2]:将供试品用肥皂水清洗除去油污,再用纯化水冲洗干净,滤纸吸干后切成0.5cm×2.0cm条状,放入玻璃器皿内,121˚C高压蒸汽灭菌30min。灭菌后在无菌操作下按0.2g/mL比例加浸提液进行浸提24h。
浸提方法二[1]:将供试品用肥皂水清洗除去油污,再用纯化水冲洗干净,121˚C高压蒸汽灭菌30min。灭菌后在无菌操作下按0.2g/mL比例加浸提液进行浸提24h。
1.2.2 实验设计与分组
依据上述的浸提方式分为:A液,将供试品剪成条状进行浸提;B液,保持供试品完整状态进行浸提。浸提介质均为10%胎牛血清的MEM;每组均设实验组(卤化丁基橡胶塞)A液,每组均设实验组(卤化丁基橡胶塞)B液,阴性对照(高密度聚乙烯),阳性对照(含5%DMSO 的相应浸提介质)和空白对照,各组设6平行孔。
1.2.3 L929细胞悬液制备
取传代数次,对数期生长的L929成纤维细胞,待0.25%胰酶消化后,加入10%胎牛血清的MEM中止消化,用吸管把细胞从瓶壁上吹打下来,制备成细胞悬液,细胞计数板计数后调整细胞浓度为1×104个/ml备用。
1.2.4 MTT 比色法
将已制备的细胞悬液(1×104/ml)接种于96 孔培养板中,置5%二氧化碳培养箱中37˚C培养24h,待细胞贴壁后,弃去原培养液,各组中实验组,阴性对照组和空白对照组分别加入相应浸提液,阳性对照组加入含5%DMSO MEM。培养箱中继续培养72h后,镜下观察其形态。随后每孔加入20ul的MTT 溶液(5mg/ml)继续培养4h后弃去原液,加入150ul DMSO,振荡10min,在酶标仪570nm波长下测定其吸光度(OD)。
1.2.5 观察与检测指标
根据以下公式计算其他实验组细胞的相对增殖率(RGR), 空白对照组细胞增殖活性为100%。

细胞相对增殖率与细胞毒性分级的关系见表1[4]:
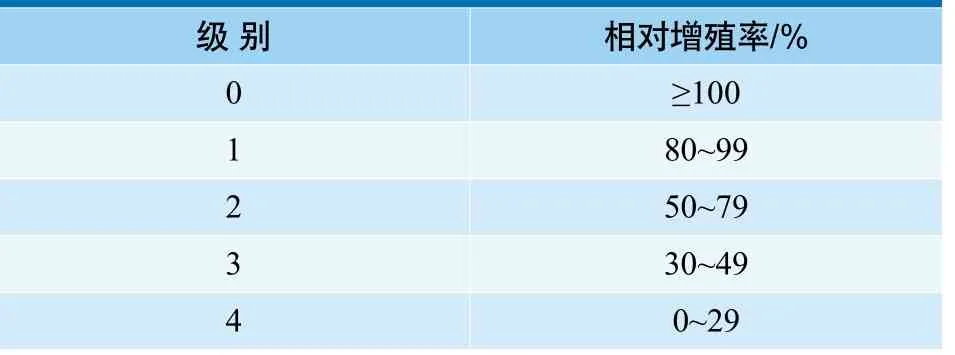
表1 细胞毒性反应分级
1.3 统计方法
采用SPSS11.0 统计软件包对数据进行分析,结果以 表示,两组数据的比较选择Student-t检验。P<0.05差异有统计学意义。
2 结果
加样后24、48、72h镜下观察孔内细胞,可见各处理组中的空白组和阴性对照组细胞形态呈长条梭形或不规则多边形,细胞贴壁良好,无空泡,胞浆内可见离散颗粒,细胞数量增加正常。阳性对照组细胞多数呈圆形,胞核固缩或崩解,无折光性,数量无明显增加。
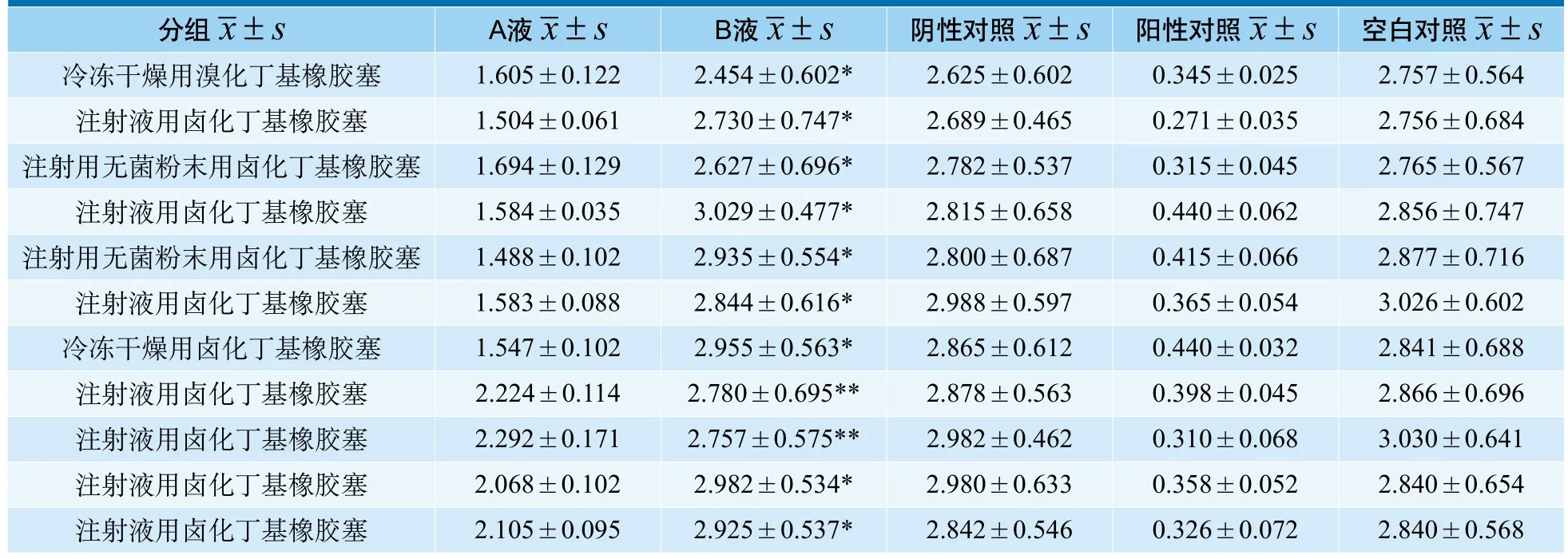
表2 各组加样后72h的OD 值(n=6)
MTT比色法测定于加样后72h的OD值见表2。阳性对照与空白对照的OD值之间差异有统计学意义(P<0.001),阴性对照与空白对照的OD值之间差异无统计学意义(P>0.05),说明本实验体系适用于该试验样品细胞毒性的判定。
在共计11批次的卤化丁基橡胶塞体外细胞毒性实验中,两组来自同一家生产企业同一型号不同生产批次的卤化丁基橡胶塞A液和B液无显著性差异(P>0.05),其他各组A液和B液之间OD值均有显著性差异(P < 0.05),说明不同的浸提方法对于体外细胞毒性MTT法结果有着直接的影响。
3 讨论
目前卤化丁基橡胶塞广泛地用于药品包装材料,为保证其使用的安全性,选择合适的方法进行生物学评价是必要的步骤。体外细胞毒性实验是目前国内外生物学评价标准中重要的一环,国家药品包装容器(材料)方法标准中有推荐的体外细胞毒性的方法,本文作者选择GB/T 14233.2-2005推荐的MTT比色法来评价,因其作为有效检测细胞线粒体损伤的快速方法,具有与细胞增殖相关性好,对样品的适应性强,观测指标客观等优势,因而广泛用于多聚物的细胞毒性初筛[4]。
浸提是一个复杂的过程,受时间、温度、表面积与体积比、浸提介质以及材料的相平衡的影响[5]。在药包材的生物学评价的具体实践中,浸提方式的选择对评价结果的影响程度以及评价结果是否存在差异等问题目前还没有相关文献报道。为探索上述因素对评价结果的影响,本实验选用了表面积与体积比的不同即是否将测试样品剪成小条作为考察对象,同时固定影响浸提的其他条件,实验数据表明,不同的浸提方法对于卤化丁基橡胶塞可溶出物质的种类和数量有着决定的影响。根据表2结果分析,我们可以知道,通过不同的浸提方法制备的浸提液,11批中的9批样品体外细胞毒性实验出现了有统计学意义的差异。分析造成这一结果的原因: 1)切割胶塞后,按YBB00012003制备浸提液,使得细胞毒性OD值普遍下降,原因可能有a.切割后非暴露面暴露,浸提表面积增加;b.原有胶塞失去完整的外形,这两个原因都可能导致样品可溶出有毒物质加快增多。2)切割卤化丁基橡胶塞后,也有两批次的胶塞的结果没有统计学的差异,说明不同生产企业的卤化丁基橡胶塞产品在体外细胞毒性实验上还是有差异,可能是其生产工艺中各种添加剂或其他化学物质使然。我们认为:破坏原有样品的正常形态即改变表面积与体积比,对于评价卤化丁基橡胶塞的体外细胞毒性实验是有影响的。
[1]GB/T 16886.5-2003 医疗器械生物学评价第5部分:体外细胞毒性试验.
[2]国家食品药品监督管理局国家药品包装容器(材料)方法标准(试行)YBB00012003细胞毒性检查法.
[3]GB/T 14233.2-2005《医用输液、输血、注射器具检验方法 第2部分:生物学试验方法》.
[4]Sgouras, D, Duncan, R.Methods for evaluation of biocompatibility of soluble synthetic polymers which have potential for medical use.1.Use of the tetrazoliumbased colorimetric assay (MTT) as a preliminary screen for evaluation of in vitro cytotoxicity.Mater.Med,1990,1(61-68).
[5]GB/T 16886.12-2005医疗器械生物学评价 第12部分:样品制备与参照样品.

