消毒剂诱导大肠杆菌质控菌耐药与抗菌药物耐药相关性试验
张 静,吴开菊,马保瑞,吴俊伟
(西南大学动物医学系,重庆 荣昌 402460)
1 材料与方法
1.1 药品 恩诺沙星,含量为99.8%,批号:1002272;磺胺二甲氧嘧啶钠,含量为98.4%,批号:20100304;土霉素,含量为87.4%,批号:20100410;庆大霉素,含量为624.6IU/mg,批号:10012031;硫酸粘菌素,含量为98%,批号:0809051;苯扎溴铵,含量为0.85%~0.95%,批号:091101。均由重庆方通动物药业有限公司提供。
1.2 菌株 大肠杆菌ATCC25922,购自中国兽医药品监察所。
1.3 培养基及试剂 营养肉汤培养基,北京陆桥技术有限责任公司,批号:100121;麦糠凯琼脂培养基,北京陆桥技术有限责任公司,批号:100310;氢氧化钠,成都东金化学试剂有限公司,批号:20100305。
1.4 体外抑菌试验 根据5种抗菌药物的理化性质,用适宜的溶剂溶解后,配成5120μg/mL的标准储备液,过滤除菌后,分装于灭菌的离心管中,于-20℃保存备用。苯扎溴铵用无菌水配成0.1%储备液,过滤除菌后于-20℃保存备用。
操作方法:以恩诺沙星为例,采用试管二倍稀释法进行,将培养过夜的菌液用肉汤做10倍稀释,恩诺沙星溶液做10倍稀释。取灭菌试管排列在试管架上,经紫外线照射后,在每只试管内加入2mL营养肉汤,在第一支试管内加入2mL恩诺沙星溶液,用移液器吹吸混匀后,吸出2mL至第2支试管,依次做倍比稀释,至第7管混匀后弃去2mL,此时,恩诺沙星的浓度依次为256、128、64、32、16、8、4μg/mL。
每组设阳性对照(菌液对照)、阴性对照(药液对照)、空白对照(肉汤对照)3个对照,用微量移液器取100μL稀释后的菌液,依次加入倍比稀释的含药试管以及菌液对照管中,使最终接种菌量为5×105CFU/mL。每种药物做双样品测定,以无菌生长的最低浓度为最低抑菌浓度。若第一次试验未能测出相应的MIC,则适当扩大药物稀释浓度。
1.5 亚抑菌浓度苯扎溴铵诱导大肠杆菌质控菌耐药 根据苯扎溴铵的 MIC,配制1/2×MIC、1×MIC、2×MIC、4×MIC、8×MIC、16×MIC、32×MIC、64×MIC、128×MIC含药麦糠凯琼脂培养基,在含1/2×MIC药物浓度的麦康凯培养基接种适量培养物(约105CFU),37℃培养24h,挑选生长良好的菌落,接种于1×MIC诱导剂的培养基37℃培养24h,以此类推,逐渐提高培养基中诱导剂的浓度直到诱导前MIC的128倍[1]。诱导耐药的大肠杆菌质控菌为ATCC25922YD。
1.6 受试药品对诱导耐药后的大肠杆菌质控菌的最小抑菌浓度测定 同样采用试管二倍稀释法,以无菌生长的最低浓度为最低抑菌浓度。
2 结果与分析
2.1 体外抑菌试验 0.1%苯扎溴铵作体外抑菌试验,测得MIC为0.125μg/mL,而恩诺沙星、庆大霉素、硫酸粘菌素、磺胺二甲氧嘧啶钠和土霉素的MIC分别为2μg/mL、1μg/mL 、32μg/mL、0.25 μg/mL和1μg/mL。
2.2 亚抑菌浓度苯扎溴铵诱导大肠杆菌质控菌耐药 采用平板划线培养,以1/2×MIC苯扎溴铵浓度为起始点开始诱导,成功诱导到128×MIC。获得了对苯扎溴铵高度耐药的大肠杆菌诱导菌株ATCC25922YD。
2.3 诱导后的大肠杆菌体外抑菌试验 结果见表1。
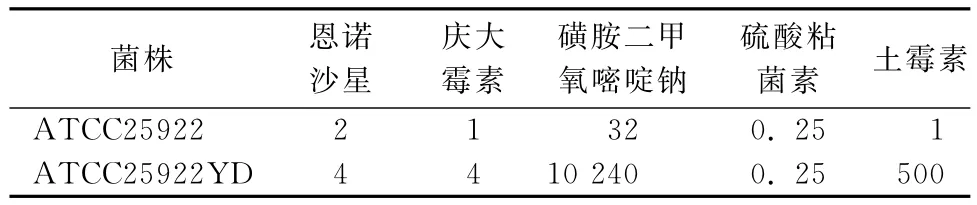
表1 诱导前后5种抗菌药物对大肠杆菌质控菌ATCC25922的 MIC (μg/mL)
由表1可以看出,经亚抑菌浓度苯扎溴铵诱导耐药的大肠杆菌ATCC25922磺胺二甲氧嘧啶钠、土霉素产生高水平耐药,其中土霉素的MIC扩大了500倍;而对恩诺沙星及庆大霉素的MIC变化维持在2~4倍;对硫酸粘菌素的MIC没有影响。
3 讨论
3.1 亚抑菌浓度的消毒剂能诱导细菌产生耐药亚抑菌浓度的抗菌药物可以诱导细菌耐药[2],在低浓度消毒剂持续作用下,细菌的自身耐受性会发生变化,从而产生生理适应性耐药。班海群[3]报道,当细菌长期处于低浓度消毒剂作用下,会增加细菌的基因突变率,引起消毒剂靶位改变、外排泵系统上调或下调、膜孔蛋白丢失等。以上因素均会使细菌对亚抑菌浓度下的消毒剂产生耐药性。
3.2 消毒剂诱导菌株对抗菌药物产生耐药 早在1993年Levy等[4]报道,在含2~5mg/L四环素或5~10mg/L氯霉素平板上连续划线培养,可以得到同时对四环素、氯霉素、青霉素、利福平等多种抗生素的多重耐药菌株,但由消毒剂诱导的对抗菌药物的多重耐药菌未见报道。细菌对抗菌药物和消毒剂的耐药机制有相似之处,许多介导细菌消毒剂耐药的机制同样可介导细菌对抗菌药物产生耐药,如主动外排泵表达亢进、膜通透性改变、渗透性改变等。由表1可以看到,对苯扎溴铵高度耐药的大肠杆菌ATCC25922YD,对抗菌药物同样产生了不同水平的耐药。
3.3 外排泵介导的细菌耐药机制 细菌的外排系统是一种非特异性耐药机制,它是由药物主动外排泵来完成的。药物外排泵是一类位于细胞膜上的具有特殊结构的膜转运蛋白,当细胞内的药物浓度聚集达到一定数值时,药物外排泵相关mRNA的表达量增加,使细胞膜上外排泵的数量增加,使药物泵出菌体,从而加强细菌在药物选择压力下的生存能力,产生耐药。细菌主动外排泵系统一般由3部分组成:外膜通道蛋白、融合蛋白和胞质膜外排蛋白。大肠杆菌是发现外排泵最多的一种细菌,一般认为AcrAB-Tolc是最主要的外排泵,且此外排泵底物广泛,可以外排吖啶橙、结晶紫、溴乙啶、镰孢菌酸、四环素、氯霉素、新霉素、红霉素、夫西地酸、SDS、萘啶酸、氯比西林、氟喹诺酮类、β-内酰胺类、利福平、吐温X-100等多种制剂[5]。本试验结果显示,经诱导的大肠杆菌对氟喹诺酮类药物及磺胺类药物均产生了耐药,这可能是可以外排消毒剂的大肠杆菌外排泵AcrAB-Tolc高水平表达,而此外排泵底物广泛,同时又可以外排一些抗菌药物所致。而四环素类抗菌药土霉素产生了高水平耐药,但对氟喹诺酮类药物恩诺沙星的最小抑菌浓度变化只有2倍,这可能与四环素类药物存在另外的外排系统Tet有关[5]。经诱导的大肠杆菌对硫酸粘菌素并未产生耐药,硫酸粘菌素的作用机制[6]不同于其他抗菌药物,硫酸粘菌素首先吸附在细菌细胞膜,结合细胞膜中脂蛋白的游离磷酸盐,引起细胞膜的结构改变或破损,导致细菌死亡。所以经亚抑菌浓度的消毒剂诱导而得的大肠杆菌ATCC25922YD并未对其产生耐药。
3.4 消毒剂与抗菌药物滥用与细菌耐药的相关性消毒剂广泛应用在医院、养殖场以及食品加工厂等场所,日趋多样的应用空间以及缺乏科学的使用常识,会使细菌通过诱导耐药的方式对消毒剂产生耐药性,继而引发对抗菌药物的耐药。反之,由于消毒剂与抗菌药物存在某些共同作用靶点与耐药机制,长期滥用抗生素很可能也会造成对消毒剂的耐药性。提示在细菌耐药性严重的今天,医院和养殖场等场所长期不科学使用消毒剂将对解决细菌耐药带来新的困难,应引起高度重视。
[1]张海旺,邓旭明,张煜,等.大肠杆菌耐药株的体外诱导及其acrA和 marA基因分析 [J].中国预防兽医学报,2005,27(6):553-557.
[2]Michea-Hamzehpour M,Kahr A,Pechere J C.In vitro stepwise selection of resistance to quinolo-nes,β-lactams and amikacin in nosocomial Gramnegative bacilli[J].Infection,1994(Suppl 2):105.
[3]班海群,李新武,张流波.消毒剂的使用对细菌耐药的潜在影响[J].中国消毒学杂志,2008,25(3):308-312.
[4]Cohen S P,Hachler H,Levy S B.Genetic and functional analysis of the multiple antibiotic resistance (mar)locus inescherichia coli[J].J Bacteriol,1993,175(5):1484-1492.
[5]Paulsen I T,Skurray R A,Tametal R.The SMRfamily:a novel family of multidrug efflux protein in volved with the efflux of lipophilidrugs[J].MolMicrobiol,1999,19:1175.
[6]王志祥,王成章,李晓峰,等.不同组合剂量黄霉素和硫酸抗敌素对肉仔鸡饲喂效果的影响[J].饲料工业,2000,21(6):42-43.

