滑菇子实体多糖纯化工艺的初步研究
李德海,孙常雁,刘利
(1.东北林业大学 林学院,哈尔滨 150040;2.国家乳业工程技术研究中心)
滑菇(Pholiota nameko)别名为滑子蘑、珍珠菇、真珠菇、光帽黄伞、光帽鳞伞,属于真菌门、无隔担子菌纲、伞菌目、丝膜菌科、鳞伞属[1],我国台湾地区称为“珍珠菇”。滑菇子实体味美营养,是一种低热量、低脂肪的保健食品。研究表明,滑菇子实体多糖含量丰富,而且具有多种生理活性,能够提高机体免疫力和耐力[2],增进智力,改善视力,可预防葡萄球菌、大肠杆菌、肺炎杆菌、结核杆菌的感染,此外对肿瘤具有较强的抑制作用,能够达到91%的抑制率[3-5]。因此本试验研究了滑菇多糖粗提物的初步纯化工艺,为滑菇多糖进一步研究提供理论基础。
1 材料与方法
1.1 实验材料
滑子蘑为市售干品;D101型大孔树脂;AB-8型大孔树脂;ADS-5型大孔树脂;葡萄糖;浓硫酸;苯酚;95%乙醇;无水乙醇;石油醚 ;乙醚;三氯甲烷;过氧化氢;盐酸;氯化钠;正丁醇。
1.2 实验仪器
高速万能粉碎机;振动筛;电热恒温鼓风干燥箱;电子天平;恒流泵;电脑自动部分收集器;水域恒温摇床;电热恒温水浴锅;可见光分光光度计;离心机;架盘药物天平;冰箱;分析天平;旋转蒸发器。
1.3 实验方法
1.3.1 多糖的测定:苯酚-硫酸比色法
1.3.1.1 葡萄糖标准曲线的制作:准确称取标准葡萄糖4mg于100mL容量瓶中,加水至刻度,分别吸取0、0.4、0.8、1.2、1.6、2.0、2.4mL加蒸馏水至2.5mL,然后加入6%苯酚1.00mL及浓硫酸5.00mL,静置l0min,摇匀,室温放置30min后于490nm处测定溶液的吸光值。以多糖微克数为横坐标,溶液吸光值为纵坐标,制作标准曲线[6-7]。
y=0.0073x+0.0119(R2=0.9977)
1.3.1.2 样品含量测定:将滑菇多糖提取液稀释一定倍数后,移取适量,用苯酚-硫酸比色法按上述步骤操作,测定溶液吸光值,以标准曲线计算多糖含量。
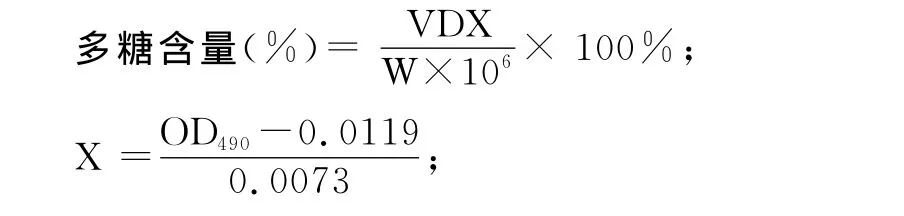
其中:X- 滑菇多糖质量浓度(μg/mL);
D-滑菇多糖样品液稀释倍数;
V-滑菇多糖样品液体积(mL);
W-滑菇粗多糖干重(g)。
1.3.2 大孔树脂对滑菇多糖纯化工艺的研究
准确称取大孔树脂10.0g,经过预处理后置于100 mL三角瓶中。向三角瓶中加入滑菇多糖样品液,在恒温振荡器中振荡吸附一定时间,取样品液测定多糖含量,计算吸附率。
将上述吸附滑菇多糖的大孔树脂滤出,水洗,置于100mL三角瓶中,再加入洗脱剂。在恒温振荡器中振荡进行解析一定时间,取洗脱液测定多糖含量,计算解吸率。
将预处理后的大孔树脂上柱,平衡过夜,取粗多糖溶液上柱,吸脱剂洗脱,采用自动收集器收集洗脱液,采用苯酚-硫酸法检测多糖含量,确定最佳洗脱流速。
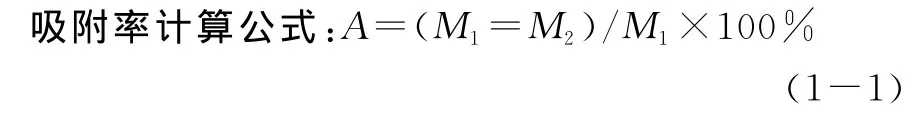
式中:A—吸附率(%);
M1—吸附前样品液中多糖含量(mg);
M2—吸附后样品液中多糖含量(mg)。
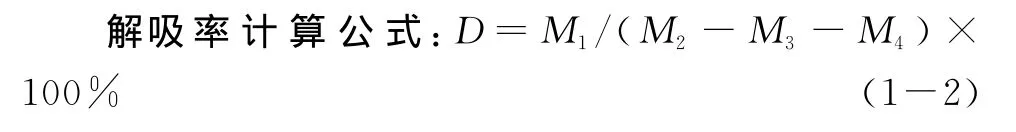
式中:D—解析率(%);
M1—解析液中多糖含量(mg);
M2—吸附前样品液中多糖含量(mg);M3—吸附后样品液多糖含量(mg);M4—水洗液中多糖含量(mg)。
2 结果与分析
2.1 滑菇子实体粗提物的多糖含量
在对滑菇多糖进行热水浸提的过程中,用苯酚-硫酸法对滑菇多糖的含量进行了跟踪检测。
对滑菇子实体粉末进行热水浸提,乙醇沉淀,烘干后,计算得率为7.21%,粗多糖中多糖含量为59.07%。
2.2 滑菇多糖纯化工艺的研究
2.2.1 树脂对滑菇多糖纯化效果的影响
不同树脂(ADS-5,AB-8,D101)对滑菇多糖纯化效果的试验结果如图1所示。
由图1的吸附曲线可知AB-8对滑菇多糖的吸附率最高可达85.42%,另两种树脂吸附能力相对较小。由解吸曲线可知AB-8,ADS-5对色素的解吸能力相当且分别为70.46%,71.28%,但是比较来讲我们选择相对较好的AB-8树脂,它对滑菇多糖有最好的解吸和吸附效果。

图1 不同树脂对滑菇多糖的吸附与解吸情况
2.2.2 洗脱剂对滑菇多糖纯化效果的影响
洗脱剂对滑菇多糖纯化效果的试验结果如图2所示。

图2 不同种类洗脱液对多糖的解吸情况
由图2可以看出:乙醇的解吸率明显高于NaCl溶液与蒸馏水,效果显著,所以选择乙醇作为多糖的洗脱剂。
2.2.3 pH对滑菇多糖纯化效果的影响
样品液pH对滑菇多糖纯化效果的试验结果如图3所示。
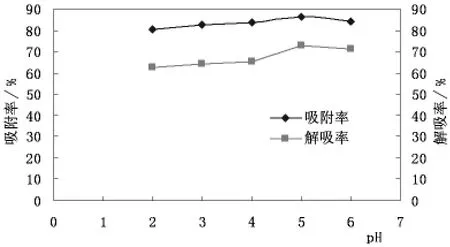
图3 不同pH值滑菇多糖溶液的吸附与解吸情况
由图3可知,当pH值从2变到时6,AB-8树脂对多糖的吸附能力有上升趋势,在pH为5时吸附率下降,在pH为5时有最大吸附率;解吸能力则先升高后降低,在pH为4的时候有小波动,但从总体趋势看在pH为5时的解吸率相对较高。因此纯化多糖时选择提取液的pH值为5,在此条件下树脂对滑菇多糖有最好的解吸与吸附效果。
2.2.4 解吸时间对滑菇多糖纯化效果的影响
解吸时间对滑菇多糖纯化效果的试验结果如图4所示。
由图4可知,当吸附时间从1h增加到3h时吸附率不断升高再到3h时则吸附率不再变化,当解吸时间由1h到4h时解吸率不断升高再到4h则吸附率不再发生变化,综上可知树脂最佳吸附时间为3h,最佳解吸时间为4h。
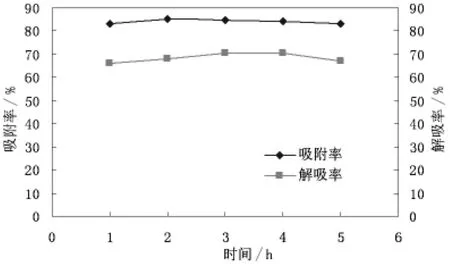
图4 不同时间对滑菇多糖溶液的吸附与解吸情况
2.2.5 样品浓度对滑菇多糖纯化效果的影响
样品浓度对滑菇多糖纯化效果的试验结果如图5所示。
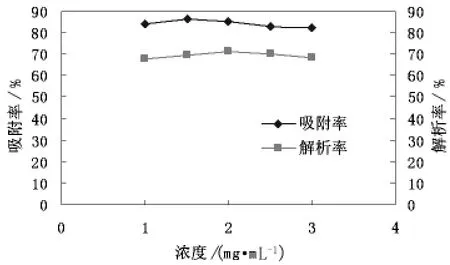
图5 不同浓度的多糖溶液的吸附与解吸情况
由图5可知,随多糖浓度不断升高吸附率变化较小,但是在1.5mg/mL时有较大的吸附率,而解析率则先升高后降低,综合两种情况选择最优条件为1.5mg/mL时有最好的解吸率与吸附率。
2.2.6 洗脱液浓度对滑菇多糖纯化效果的影响
乙醇浓度对滑菇多糖纯化效果的试验结果如图6所示。
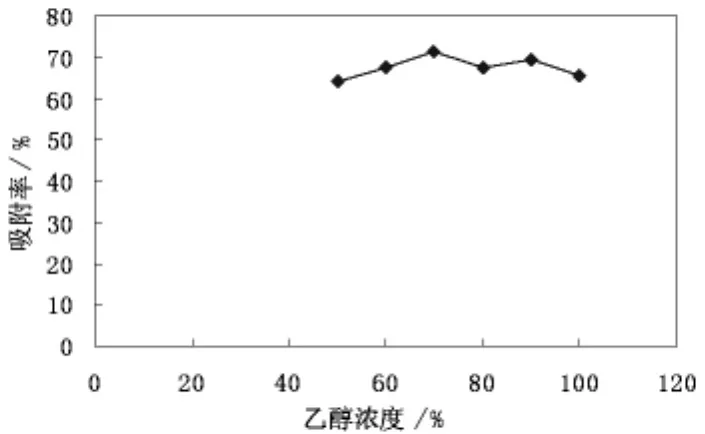
图6 不同浓度的洗脱液对多糖的解吸情况
由图6可以看出:乙醇的浓度由50%至70%时随着乙醇浓度的增加,洗脱的效果越来越好,当乙醇的浓度高于70%时解吸效果呈下降趋势,在90%时有轻微波动但是不影响整体趋势,所以确定最佳洗脱液浓度为乙醇浓度70%。
2.2.7 洗脱液流速对滑菇多糖纯化效果的影响
洗脱液流速对滑菇多糖纯化效果的试验结果如图6所示。
从图7可以看出,随流速的增加,树脂对多糖的解吸性能呈下降趋势,说明流速增加不利于树脂对多糖的解吸,若流速过快,洗脱剂不能与被吸附的多糖充分作用而将其从树脂上洗脱出来,但流速过低,将导致整个生产周期的延长,从上图分析后也可得出结论,每个流速对应的吸收峰应该是越窄越好。故本试验选择2mL/min作为洗脱流速,在此条件下试验的效果最好。
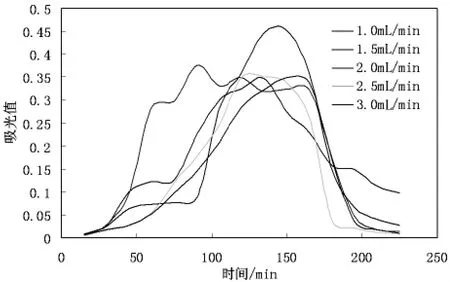
图7 洗脱液流速对滑菇多糖解吸情况的影响
4 结论
4.1 本文比较了3种大孔树脂对滑菇多糖的吸附和解吸效果,从中筛选出适合滑菇多糖分离纯化的树脂,并对其吸附和解吸条件进行了研究。对树脂筛选的试验结果为:AB-8大孔树脂对滑菇子实体多糖分离纯化的效果最好。
4.2 AB-8型树脂对滑菇多糖纯化工艺的结果为:吸附时间为3h、pH值5.0、料液浓度1.5mg/mL,洗脱剂为70%乙醇溶液,解吸时间为4h,洗脱速率为2mL/min,在此工艺下纯化效果最好,即吸附率为86.67%,解吸率为71.38%。
4.3 最后得到滑姑多糖纯品中多糖含量为78.64%,远高于粗多糖中的多糖含量59.07%,由此可知,大孔树脂是一种较为简单方便的纯化滑菇多糖的方法。
[1]白永莉,张玲勤.高海拔地区滑菇栽培技术初探[J].食用菌,2000(6):35-37.
[2]张彬,薛立群.多糖对动物免疫调控作用及其机理.家畜生态学报,2008(1).
[3]张竞,潘琢,赵宝华.真菌多糖抗肿瘤作用的研究进展[J].生命科学仪器,2009(4):28-31.
[4]崔英俊,李庆章.滑菇多糖对衰老模型鼠不同时期免疫功能的影响[J].东北农业大学学报,2004(2):129-134.
[5]陈磐,陈绍瑗,冯懿挺,等.植物活性多糖抗癌活性的研究[J].中国药物与临床,2004,4(8):606-608.
[6]李德海,孙常雁,孙洁莉,等.微波辅助法提取滑菇多糖的工艺研究[J].食品工业科技,2008(4).
[7]王黎明,夏文水.蒽酮-硫酸法测定茶多糖含量研究[J].食品学报,2005,26(7).

