半枝莲水提取物调节肿瘤 VEGF/DC实验研究
宋增芳,廖月霞,肖炜明,吴克艳,胡 荣,朱海航,赵 梁,卜 平
(扬州大学医学院,江苏扬州,225001)
半枝莲是一种常见的抗肿瘤中药,其毒副作用小且有祛邪固本的功效,半枝莲的水提取物和醇提取物均有明显的抗肺癌、消化系统癌、乳腺癌、绒膜上皮癌的活性[1-2]。作者的前期实验研究证明半枝莲提取物剂量依赖性地抑制肿瘤的生长,同时在一定程度上提高了机体的免疫力。但关于半枝莲水煎剂及半枝莲水提取物的体内抗肿瘤及免疫调节的作用机制尚未明确。作者就半枝莲水提取物的体内抗肿瘤及其对免疫的双向调节作用进行了初步研究,现将结果报告如下。
1 材 料
1.1 药品和试剂
半枝莲(生):产地江苏,生产批号901008116,生产许可证号:皖 Y20050032,生产日期:2009年 9月 3日,购于北京同仁堂(亳州)饮片有限责任公司);95%乙醇(扬州市金山化工有限公司);石油醚(分析纯)(国药集团化学试剂有限公司);参一胶囊(人参皂甙 Rg3)(吉林省亚泰制药股份有限公司);VEGF兔抗多克隆抗体(武汉博士德生物工程有限公司生产);S100兔抗多克隆抗体(武汉博士德生物工程有限公司生产);即用型 SABC免疫组化试剂盒 -兔 IgG(武汉博士德生物工程有限公司生产);DAB显色试剂盒(武汉博士德生物工程有限公司生产)。
1.2 实验动物及瘤株
BALB/C小鼠 90只,清洁级,体质量 18~22 g,雄性,由扬州大学医学院动物房提供。S180腹水小鼠:购于江苏省肿瘤医院。
1.3 仪器
SENCOR203型旋转蒸发器、SENCO W201B型恒温水浴锅上海申生科技有限公司产品。电热干燥箱 202-2型,东台电器厂。电子天平DT500,常熟市百灵天平仪器有限公司。电子天平 MP200A,上海市第二天平仪器厂。
2 方 法
2.1 半枝莲提取物的制备
本实验所用的半枝莲提取物包括半枝莲水提取物和半枝莲水煎剂两种。
半枝莲水提取物:将半枝莲全草 6 kg晾干、粉碎,以石油醚在 60℃水浴条件下回流提取 2次,每次 2 h[3]后放入通风橱中将石油醚挥发干净。用水提取,温度 90℃,时间 3 h,固液比 1:12,提取 3次[4]。合并滤液,将其用离心机以 4 000 r/min离心 18 min,浓缩上清液[5]。向浓缩液中缓慢加入 3倍体积的 95%乙醇,静置过夜,可见絮状沉淀析出。4 000 r/min离心 20 min左右,收集沉淀,在70℃烘箱干燥即得到未脱蛋白粗多糖,得率约为 1.29%。
半枝莲水煎剂的制备:称取半枝莲 200 g,加相当于药材量的 5~7倍的水浸泡 1~2 h,煮沸30 min,过滤,药渣加水继续煎煮 30 min,过滤,合并滤液,于水浴上浓缩成每毫升相当于原生药材 1 g的半枝莲水煎剂[6]。
2.2 半枝莲水提取物对 S180荷瘤小鼠瘤重的影响
2.2.1 建立小鼠模型:将 BALB/C小鼠随机分为8组,每组 10只。无菌条件下抽取接种 7d的生长良好的 S180荷瘤小鼠腹水(台盼蓝染色显示活癌细胞数 >95%),用无菌生理盐水(体积比)1:4稀释,在小鼠右前腋部皮下接种,每只 0.2 mL,于 30 min内接种完成。
2.2.2 给药:于小鼠接种 24 h后开始给药,每日1次,共 7 d。Ⅰ组为模型对照组,给予 0.9%生理盐水,0.1 mL/10 g,灌胃;Ⅱ组参一胶囊(人参皂甙 Rg3)组,剂量为 5.2 mg/kg,0.1 mL/10 g,灌胃;Ⅲ组为空白组(未接种肿瘤),给予 0.9%生理盐水,0.1 mL/10 g灌胃;Ⅳ组为半枝莲水煎剂高剂量组,半枝莲水煎剂的浓度为 0.8 g/L,按0.2 mL/10 g灌胃;Ⅴ组半枝莲水煎剂中剂量组,按 0.1 mL/10 g灌胃;Ⅵ组为半枝莲水煎剂低剂量组,按 0.05 mL/10 g灌胃;Ⅶ组为半枝莲粗水提取物高剂量组,200 mg/(kg·d),配置浓度为0.2 g/10 mL,按 0.1 mL/10 g灌胃;Ⅷ组为半枝莲水提取物中剂量组,100 mg/(kg·d),配置浓度为 0.1 mL/10 g,按 0.1 mL/10 g灌胃;Ⅸ组为半枝莲水提取物低剂量组,50 mg/(kg·d),配置浓度为 0.05 g/10 mL,按 0.1 mL/10 g灌胃。将 90只雄性小鼠常规饲养,自由饮水进食,实验室温度 22~25℃,相对湿度 60%~70%,并保持良好的光照和通风条件,每天固定时间段记录小鼠的体重及活动情况[7-8]。给药 7 d后停药,停药后次日处死小鼠,处死小鼠的前夜予以禁食,但不禁水。
2.2.3 测抑瘤率:停药次日处死,称取小鼠瘤重[9]。
2.3 半枝莲水提取物对 S180荷瘤小鼠胸腺、脾脏、肝脏的影响
实验动物模型制造方法同 2.2,给药剂量及途径也相同。末次给药后 24 h处死,分别称取体重、胸腺、脾脏及肝脏的重量,按公式计算胸腺指数和脾指数[10]。
胸腺指数(mg/g)=胸腺重/体重
脾指数(mg/g)=脾重 /体重
肝指数(mg/g)=肝重 /体重
2.4 半枝莲提取物对 S180移植瘤小鼠瘤体中VEGF及 DC的影响
实验动物模型制造方法及给药剂量与途径按2.2进行。给药 7 d后停药,停药后次日处死小鼠,摘取肿瘤组织,固定、包埋、切片后用免疫组化法测定肿瘤组织中 VEGF及 DC的表达情况使用JEDA801D形态学图像系统软件进行分析。免疫组化染色评分按 Rahman[11]等的方法进行。
3 结 果
3.1 半枝莲水提取物对 S180小鼠表现出不同的抑瘤作用
对 S180小鼠瘤重的影响(表 1),半枝莲提取物对 S180小鼠表现出不同的抑瘤作用。与模型组比较高、中剂量组表现出良好的抑瘤效果,有显著性差异(P<0.01),低剂量有差异(P<0.05),与阳性对照比较,中剂量组与参一胶囊组比,抑瘤率有明显升高。

表 1 药物对 S180移植瘤小鼠瘤重的影响
3.2 半枝莲水提取物对 S180荷瘤小鼠肝指数、脾指数、胸腺指数的影响
半枝莲提取物对 S180荷瘤小鼠肝指数、脾指数、胸腺指数的影响如表 2所示,与模型组比较半枝莲提取物中、低剂量组胸腺指数都有显著提高,而高剂量组明显受到抑制,且差异显著(P<0.05或 <0.01)。各用药组脾指数均较模型组有所提高,其中半枝莲提取物高、中剂量组脾脏指数均较模型组显著提高(P<0.05或 <0.01),半枝莲水煎剂中剂量组脾指数较参一胶囊阳性对照组有显著提高(P<0.05)。各用药组肝指数均较模型组有所提高,其中半枝莲提取物高、中剂量组肝脏指数均较模型组有显著提高(P<0.05或 <0.01),各用药组肝指数与参一胶囊组相比较无差异。
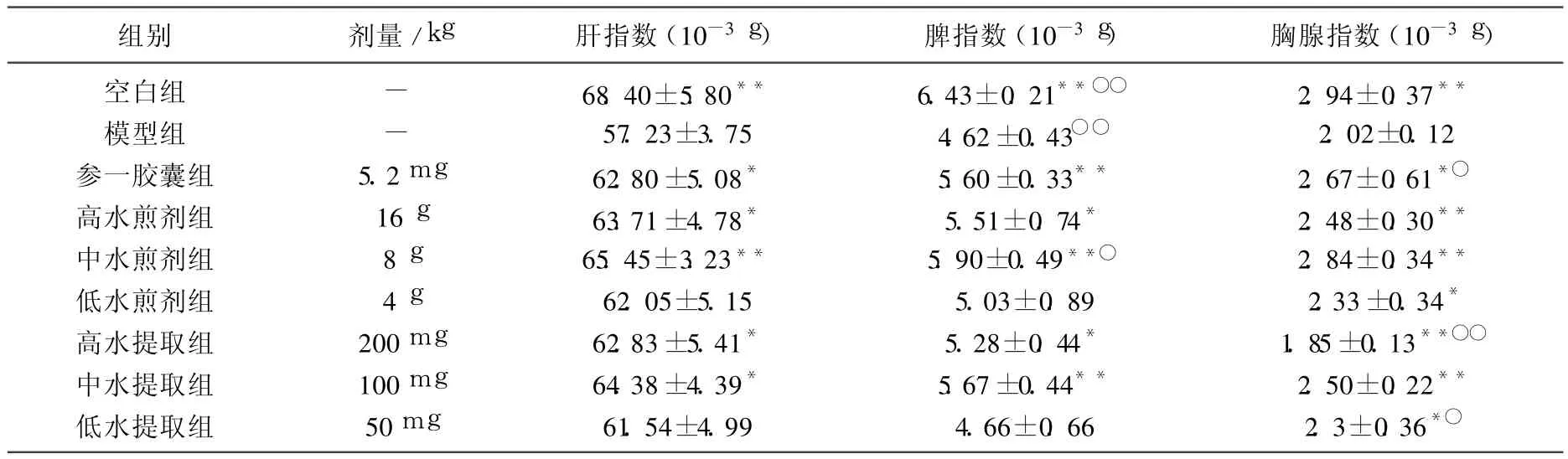
表 2 半枝莲提取物对 S180荷瘤小鼠肝指数、脾脏指数、胸腺指数的响
3.3 半枝莲水提取物对 S180移植瘤小鼠瘤体中VEGF及 DC的影响
VEGF阳性反应细胞的胞浆被染成棕黄色,背景呈浅黄色或不着色。每张切片随机选取 5个视野(放大倍数为 200),进行免疫组化染色评分。免疫组化染色评分标准是:根据着色细胞的比例(染色范围)及染色强度评分,染色范围(阳性细胞比率)分为 0~4级,阴性为 0分;阳性细胞0~25%为 1分;阳性细胞 26% ~50%为 2分;阳性细胞 51% ~75%为 3分;阳性染色 76% ~100%为 4分。染色强度划分为 0~3级;阴性为0分;弱阳性为 1分;中等强度为 2分;强阳性为 3分,两者得分相加为最后评分。模型组阳性率最高,以半枝莲水煎剂中剂量组的阳性率最低。
S100蛋白位于细胞的胞浆及胞核中,S100阳性细胞的胞浆染成棕黄色,胞核也可见着色,我们将细胞形态可辨且不规则,胞浆胞核均染色的细胞才计数为 S100阳性的树突状细胞。每张切片随机选取 5个视野(放大倍数为 400),观察并计数树突细胞,计算每个高倍视野的树突状细胞平均数。模型组未见有阳性细胞浸润,以半枝莲水煎剂中剂量组的阳性率最高。
实验结果显示(表 3),半枝莲水提取物给药剂量不同,VEGF在小鼠 S180肉瘤组织内表达有区别,半枝莲各用药组 VEGF表达评分均较模型组有所下降,半枝莲水煎剂三个剂量组及半枝莲水提取物中、低剂量组均具有显著的统计学意义(P<0.01);并且半枝莲水煎剂高、中剂量及半枝莲水提取中剂量组对小鼠 S180肉瘤组织内VEGF表达的抑制程度较阳性药物人参皂甙 Rg3更为强大。半枝莲水提取高剂量组与模型组比较无差异。
模型组未见有 S100阳性树突状细胞细胞的浸润,而各用药组则见不同程度的浸润,其中以半枝莲水提取物高、中剂量组的浸润密度最为突出,具有显著的统计学意义(P<0.01)。
由表 3中数据可以看出,各用药组 VEGF表达的评分越低,树突状细胞的浸润密度则相对越高。故而将各组的 VEGF表达与树突状细胞浸润密度进行相关性分析,结果显示(图 1):VEGF表达与DC浸润密度之间呈显著性负相关(r=-0.595,P<0.01)。
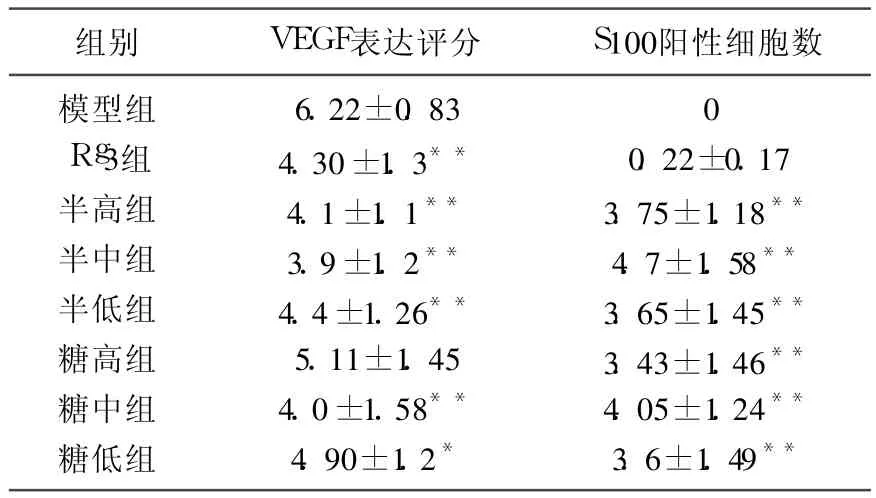
表 3 VEGF和 S100在小鼠瘤体中表达情况
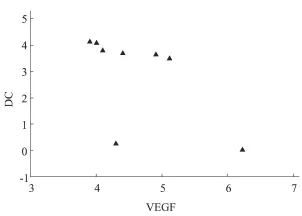
图1 VEGF表达与 DC浸润密度的相关性分析
4 讨 论
研究表明,VEGF一方面能促进肿瘤的血管生成,另一方面 VEGF是 DC生成和成熟的重要负调控因子,VEGF能抑制DC的分化及 imDC的功能性成熟,VEGF抑制 mDC行使功能,从而抑制机体的抗肿瘤免疫应答,使肿瘤细胞逃避机体的免疫监视[12]。而 DC能够介导 VEGF生成。两者相互影响,形成恶性循环,导致肿瘤进展、恶化、转移。可力[13]通过实验证明半枝莲多糖可上调H-22小鼠血清中 IL-2、IL-12、TNF-a的表达、下调 VEGF的表达。作者认为半枝莲提取物或许通过在体内下调 VEGF及上调 DC的双向调节,进而增强机体的抗肿瘤免疫。
中药作为免疫调节和促进剂,在提高机体免疫功能、抗肿瘤方面起着越来越重要的作用,在肿瘤临床治疗上有着广阔的应用。随着现代肿瘤免疫学的发展,已经认识到 DC的数量及功能正常与否是机体抗肿瘤免疫应答的重要条件,因此 DC可能是中药影响免疫功能的关键所在。DC可以合成和分泌 S100蛋白,目前许多文献报道 S100蛋白标记了包括成熟的以及不成熟的所有树突状细胞[14]。S100阳性树突状细胞在抗肿瘤免疫中被认为是先趋向于被机体视为异物的肿瘤周围[15],再逐渐移入肿瘤细胞之间,通过它的树突与肿瘤细胞密切接触后获得抗原,再移行到局部淋巴结,将肿瘤抗原呈递给 T细胞,发挥 T细胞的细胞毒作用而杀伤破坏肿瘤细胞,形成免疫监视。通过肿瘤组织内 S100的表达情况可以了解树突状细胞的浸润情况,从而间接了解肿瘤的免疫微环境状况。
在实验中,作者发现还随着半枝莲水提取物给药浓度的变化,VEGF在小鼠 S180肉瘤组织内的表达越强,DC的浸润密度却越小,而且 VEGF表达与 S100阳性 DC浸润密度之间呈显著性负相关,VEGF表达的评分越高,树突状细胞的浸润密度则相对越低。学者们通过大量实验推断,肿瘤分泌的 VEGF通过抑制 HPC中 NF-κB活化,进而降低核内 h10组蛋白基因的表达,从而影响HPC分化成为成熟 DC。Mimura等[16]通过体外诱导实验发现,VEGF剂量依赖性地抑制 mDC激活同种异体 T细胞的能力。而且 VEGF诱导的mDC功能障碍主要由 VEGFR2所介导。Webster等发现 DC能激发淋巴结内皮细胞增殖和血管生长,同时伴随淋巴结内 VEGF水平升高,Lu等[17]在没有淋巴细胞的小鼠体内也发现存在这种现象。张义[18]通过实验表明在肝细胞肝癌组织中VEGF表达和 DC浸润程度呈负相关,VEGF表达增加可抑制 DC在肝癌组织中浸润;肿瘤直径越大 VEGF表达越高;DC浸润程度与肿瘤直径负相关。郑海燕等[19]采用免疫组化 SP法检测 20例胃炎组织及 50例胃癌组织中的 DC和 VEGF。结果表明胃癌组织中 DC与 VEGF的表达呈负相关,胃癌组织中 DC数减少、VEGF表达增多,二者相互作用,促进胃癌的发生及转移。因此,作者推测 VEGF是通过抑制 DC的分化及功能性成熟,从而导致 DC数量的减少。
本组实验结果表明,半枝莲水提取物具有显著的抗肿瘤作用,并能够提高荷瘤小鼠免疫器官的重量,其抗肿瘤机理可能是通过增强机体的免疫力达到抗肿瘤的效果。半枝莲提取物能显著抑制肿瘤组织中 VEGF的表达,抑制其介导的肿瘤血管生成而达到良好的抑瘤效果;各用药组瘤组织中的 DC的表达都有一定程度上的提高,且 DC的表达与 VEGF呈负相关。VEGF是 DC的负调控因子,所以试验中 DC表达水平的提高是半枝莲提取物的直接作用还是间接作用尚不明确,需要进一步深入的研究。
[1] 王 刚,董 枚.半枝莲醇提物抗肿瘤活性的研究[J].现代中西医结合杂志,2004,13(9):1141.
[2] Lee T K,Lee D K,Kim DI.Inhibitory effects of Scutellaria barbataD.Don on human uterine leiomyomal smooth muscle cell proliferation through cell cycle analysis[J].International Immunopharmacology,2004,4(3):447.
[3] 赵桂梅.灵芝孢子粉水溶性多糖 GLP-2和 GLP-3的结构研究[D].长春:东北师范大学,2005.
[4] 马维坤.半枝莲多糖的分离纯化及其活性初步研究[D].镇江:江苏大学,2007.
[5] 王 亮,姜 波,王喜春,范圣第.桃仁中多糖的提取工艺研究[J].时珍国医国药,2009,2(20):271.
[6] 李 洁,孙 静.中药半枝莲对肝癌 H(22)荷瘤小鼠抑瘤作用的研究[J].时珍国医国药,2009,5(20):1233.
[7] 徐叔云.药理实验方法学[M].第 3版.北京:人民卫生出版社,2002:1757.
[8] 叶明霞.S180肉瘤,艾氏腹水瘤肿瘤移植模型建立的研究[J].中国实验动物学杂志,2002,12(1):14.
[9] 李建军,雷林生,余传林,等.灵芝多糖抗肿瘤作用的免疫学相关性研究[J].中药材,2007,30(1):71.
[10] 严奉伟,王 辰,严赞开,等.菜籽多糖对S180小鼠肉瘤及其免疫能力的影响[J].食品科学,2007,28(4):309.
[11] Rahman A,Dhar D K,Yamagnchi E,et al.Coexpression of inducible nitric oxide synthase and cox-2 in hepatocellular carcinoma and surrounding liver,possible involvement of cox-2 in the angiogenesis of hepatitis C viruspositive case[J].Clin Can Res,2001,7(5):1325.
[12] Xie Y,Fan J,Chen J,Huang F P,Cao B,Tam PK,Ren Y.A novel function for dendritic cell:clearance of VEGF via VEGF receptor-1[J].Biochem Biophys Res Commun,2009,380(2):243.
[13] 可力.半枝莲多糖联合 CTX对 H(22)小鼠血清相关细胞因子的影响[D].哈尔滨:黑龙江中医药大学,2009.
[14] Donato R.S100:a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles[J].Int JBiochem Cell Biol,2001,33(7):637.
[15] Bronckart Y,Decaestecker C,Nagy N,et al.Evelopment and progression of malignancy in human colon tissues are correlated with expression of specific Ca(2+)binding S100 proteins[J].Histol Histopathol,2001,16(3):707.
[16] Mimura K,Kono K,Takahashi A,et al.Vascularendothelialgrowth factor inhibits the function of human mature dendritic cellsmediated by VEGF receptor-2[J].Cancer Immunol Immunother,2007,56(6):761.
[17] Webster B,Ekland E H,Agle L M,et al.Regulation of lymph node vascular growth by dendritic cells[J].JExpMed,2006,203(8):1903.
[18] 张 义.肝癌组织中 VEGF表达和 DC浸润的关系及对肝癌术后复发转移的影响[D].南宁:广西医科大学,2007.
[19] 郑海燕,王兴芬,辛 琪,张 娜,杜华欣.胃癌组织中树突状细胞和VEGF的表达变化及意义[J].山东医药,2009,49(26):65.

