硫化铜矿物电子结构的第一性原理研究
陈建华,王进明,龙贤灏,郭进
(1. 广西大学 资源与冶金学院,广西 南宁,530004;2. 中南大学 资源加工与生物工程学院,湖南 长沙,410083;3. 广西大学 物理科学与工程技术学院,广西 南宁,530004)
铜及铜合金由于其优异的物理和力学性能被广泛应用于电子、机械、国防等领域,对国民经济和科技发展起着重要的作用[1]。硫化铜矿物是提取铜的主要矿物资源,它占铜矿资源的80%,因此,硫化铜矿物的理论与试验研究受到广泛关注[2-5]。硫化铜矿物主要有黄铜矿、辉铜矿、铜蓝和斑铜矿,其中与黄药作用最强的为辉铜矿,其次为铜蓝,然后为斑铜矿,最弱的为黄铜矿。由于一种硫化铜矿石中常常含有几种不同的硫化铜矿物,而各种硫化铜矿物浮选所需的药剂种类、用量、pH等浮选条件也各不相同[6]。另外,不同硫化铜矿物氧化的难易度也存在差异,其中辉铜矿最容易氧化,当铜矿石中含有辉铜矿时,氧化会造成矿浆中含有大量铜离子,因此,给铜锌、铜硫分离造成极大的困难[7]。矿物的浮选行为取决于矿物的性质,而矿物的性质取决于矿物的电子结构。不同的硫化铜矿物具有不同的化学组成、晶体结构和电化学性质,如辉铜矿含铜最高,达到79.86%,而黄铜矿含铜最低,仅有34.56%;另外,常见的黄铜矿属于四方晶系,辉铜矿属于六方晶系,而铜蓝具有复杂的层状构造;从导电性方面来讲,黄铜矿属于半导体,而辉铜矿和铜蓝则为导体。因此,研究硫化铜矿物的电子结构对于从本质上认清不同硫化铜矿物可浮选性的差异具有重要的意义。基于密度泛函理论的第一性原理是研究固体电子结构的有力工具。目前,国内外学者采用第一性原理对黄铜矿[8]、闪锌矿[9]、方铅矿[10]和黄铁矿[11]进行计算,获得了比较准确的矿物电子结构和微观信息。人们对4种硫化铜矿物的实际矿物浮选已进行不少研究[12-14],但是,对硫化铜矿物电子结构进行系统研究的还未见报道。本文作者采用密度泛函理论的第一性原理研究黄铜矿、辉铜矿、铜蓝和斑铜矿4种硫化铜矿物的费米能级、能带结构、态密度,并采用前线轨道理论讨论这4种硫化铜矿物和氧气分子作用的机理,以便为进一步认清硫化铜矿物可浮性的差异及硫化铜矿物新药剂开发提供理论参考。
1 计算方法和模型
4种硫化铜矿物都有多种变体,这里以自然界常见变体为研究对象。黄铜矿四方晶系变体空间群为I2d,晶格常数a=b=5.289×10-9m,c=10.423×10-9m,α=β=γ=90°;铜蓝六方晶系变体空间群为 P63/mmc,晶格常数 a=b=3.796×10-9m,c=16.360×10-9m,α=β=90°,γ=120°;辉铜矿六方晶系空间群为 P63/mmc,晶格常数 a=b=3.961×10-9m,c=6.722×10-9m,α=β=90°,γ=120×10-9m;斑铜矿空间群为 F43m,晶格常数 a=b=c=10.710×10-9m,α=β=γ=90°。采用软件Material Studio4.2中的CASTEP和Dmol3模块[15]进行计算。为了实验晶格常数和禁带宽度接近实验值,进行了交换关联函数和平面波截断能测试。计算所选取的其他参数均采用平面波截断能和所选取的函数所对应的默认值,结果如表1所示。
由表1可知,对黄铜矿采用广义梯度近似(GGA)下的RPBE梯度修正函数,当平面波截断能为280 eV时,晶格常数与实验值最接近,优化后晶格常数a和b的误差仅为1.996 6%,c的误差为1.000 7%;辉铜矿采用局域近似(LDA)下的CA-PZ梯度修正函数,当平面波截断能为 250 eV时,晶格常数与实验值最接近,优化后晶格常数a和b的误差仅为2.297 0%,c的误差为0.152 0%;铜蓝采用广义梯度近似(GGA)下的WC梯度修正函数,当平面波截断能为270 eV时,晶格常数与实验值最接近,优化后晶格常数a和b的误差仅为0.479 5%,c的误差为0.020 0%;斑铜矿采用广义梯度近似(GGA)下的PW91梯度修正函数,当平面波截断能为 280 eV时,晶格常数与实验值最接近,优化后晶格常数a和b的误差仅为0.186 7%,c的误差为0.152 0%。以上参数优化结果与实验值较符合,表明计算所采用的方法及选取的参数是可靠的。
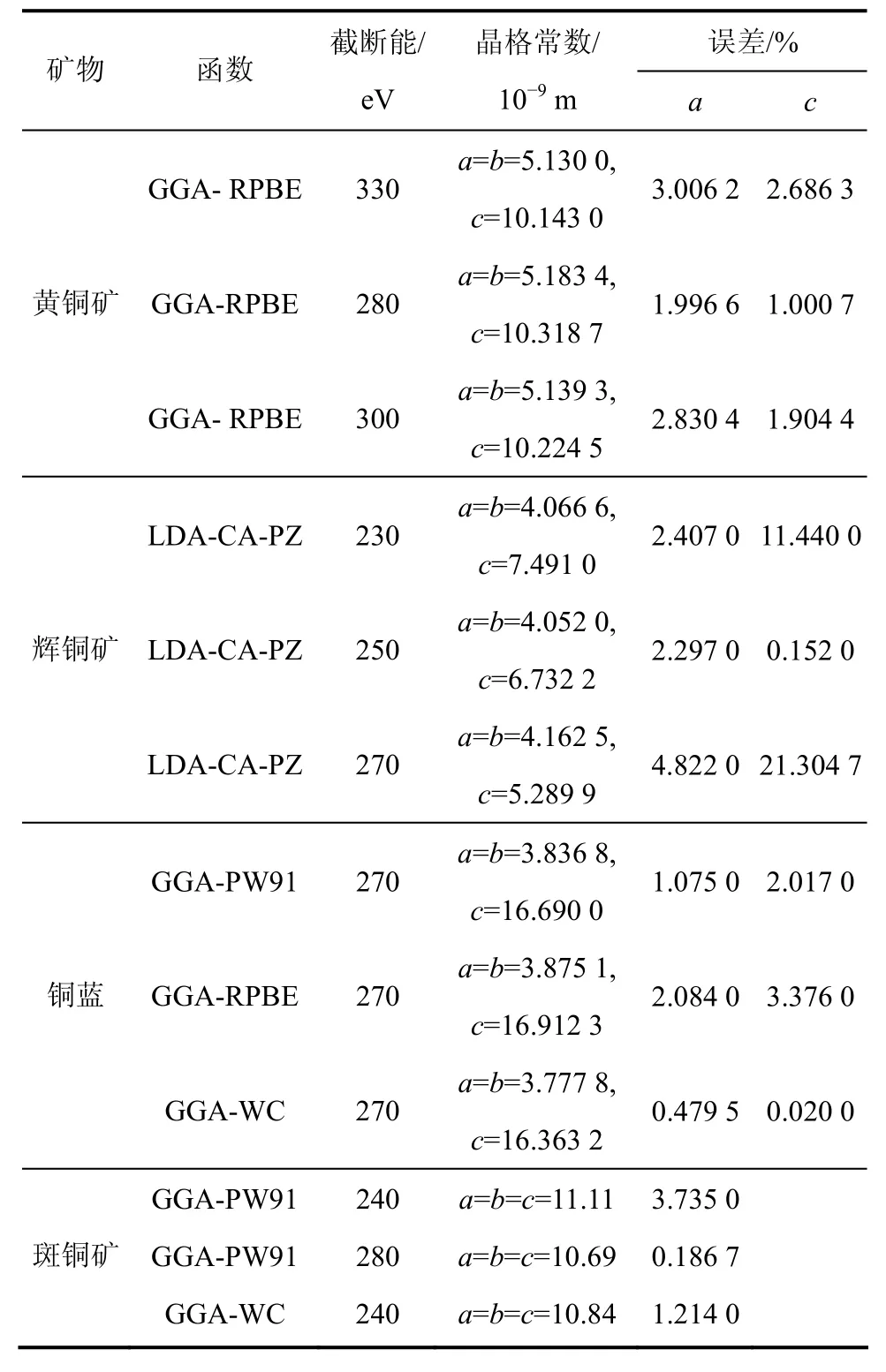
表1 4种硫化铜矿物优化结果Table 1 Optimization results of four copper sulfide minerals
2 计算结果与分析
2.1 费米能级分析
费米能级(Ef)也称为费米能量,若将半导体中大量电子的集合体看成一个热力学系统,则由统计理论证明,费米能级Ef就是系统电子的化学势,即
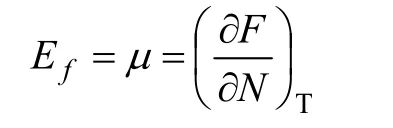
式中:μ为系统的化学势;F为系统的自由能;N为电子总数;T为热力学温度。处于热平衡状态的系统有统一的化学势,所以,处于热平衡状态的电子系统有统一的费米能级,电子从费米能级高的地方向低的地方转移。费米能级是量子态基本上被电子占据或基本上是空的一个标志,通过费米能级的位置能够比较直观地标志电子占据量子态的情况,或者说费米能级标志了电子填充能级的水平。表2所示为采用Dmol3计算出的4种硫化铜矿物及正丁基黄药的费米能级。

表2 硫化铜矿物和黄药的费米能级Table 2 Fermi level of copper sulfides and xanthate eV
根据黄药与矿物之间电子转移关系[16]可知:当黄药费米能级高于硫化矿的费米能级时,黄药向矿物传递电子,被氧化为双黄药;当黄药费米能级低于矿物费米能级时,黄药电子不能向矿物传递,黄药离子和矿物表面阳离子形成金属黄原酸盐。从表2可知:黄药的费米能级高于黄铜矿,因此,黄药电子可以向黄铜矿转移,从而在黄铜矿表面发生氧化,形成双黄药;而其他3种铜矿物的费米能级则比黄药的高,黄药电子不能向辉铜矿、铜蓝和斑铜矿转移,黄药在这3种硫化铜矿物表面主要形成黄原酸盐。这与实际实验结果一致[7,17]。
2.2 能带结构及态密度分析
4种硫化铜矿物的能带结构如图1所示,取费米能级(Ef)作为能量零点。从图1(a)可以看出:理想黄铜矿的价带极大值和导带极小值都是位于高对称G点,因此,黄铜矿是一个直接带隙p型半导体;计算的黄铜矿禁带宽度为0.99 eV,与文献报道值一致[18]。从图1(b)~(d)可以看出:其他3种硫化铜矿物的导带和价带相交,属于导体矿物,具有良好导电性[19-20]。
黄铜矿态密度如图2所示。从图2可以看出:黄铜矿的导带能级由Cu的4s轨道和Fe的4s轨道组成。而价带则由2部分组成,其中-14.5~-12.5 eV的深部价带主要由硫的3s轨道贡献,-6.5~2.4 eV的顶部价带由Cu 3d,Fe 3d和S 3p轨道组成,其中Cu 3d轨道的成分最多。
图3所示为辉铜矿态密度。从辉铜矿晶体结构中可知:辉铜矿晶胞中铜存在2种形态,分别命名为Cu1和Cu2。从图3可以看出:-15.4~-12.9 eV能带主要由硫的3s轨道贡献,-8.7~0 eV能带由Cu1的3d,Cu2的3d和S的3p轨道杂化组成,其中Cu2的3d轨道的成分最多,导带能级由Cu的4s轨道和S的3p轨道组成。
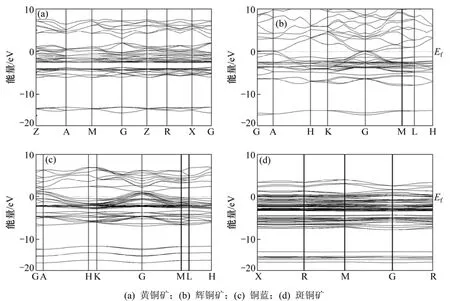
图1 4种铜矿物的能带结构Fig.1 Band structures of four copper sulfides

图2 黄铜矿态密度Fig.2 Density of state of chalcopyrite
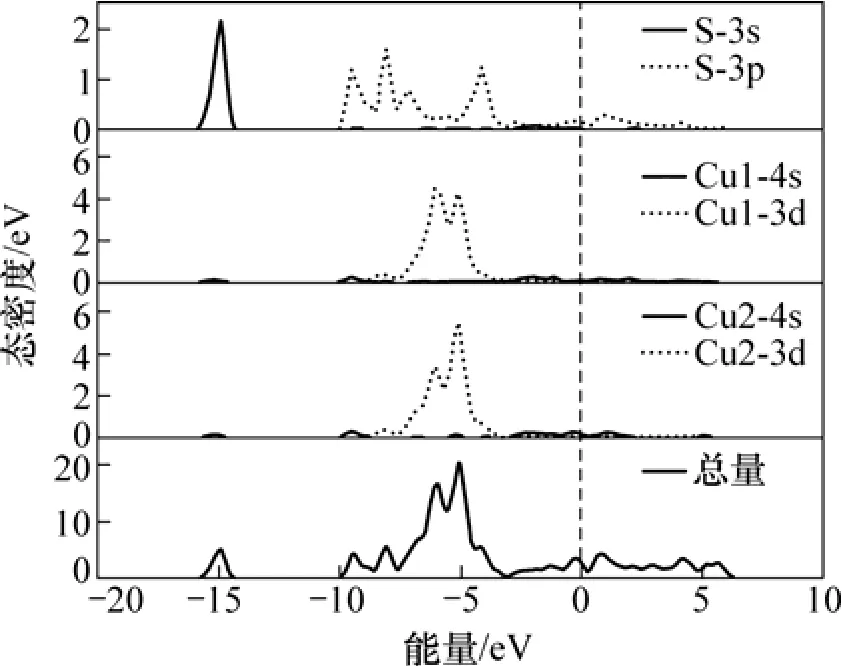
图3 辉铜矿态密度图Fig.3 Density of state of chalcocite
铜蓝属于复杂的层状构造。铜硫离子均有不同价数[21],把不同价态硫命名为S1和S2,不同价态铜命名为Cu1和Cu2。铜蓝的态密度如图4所示。从图4可以看出:深部价带由3组间断的能带组成,其中:从-16.3 eV延伸到-10.7 eV的价带主要由S1和S2的3s轨道贡献;-7.6~1.1 eV能带由Cu的3d和S的3p道贡献,其中Cu的3d轨道的成分最多,2.6~7.4 eV的能带主要由Cu1的4s轨道和S2的3p轨道贡献;在1.1~2.7 eV出现2条能带,它们把导带和价带连接起来,使得铜蓝的导电性大大增强,这2条能带主要由S2的3s和3p轨道贡献,其中S2的3p轨道贡献最大。
斑铜矿态密度图如图5所示。从图5可知:斑铜矿的能带可以分为4部分,其中:-16.7~-11.9 eV的价带,它主要由硫的3s轨道贡献;-8.7~-3.9 eV的价带主要由S的3p轨道贡献;-3.9~1.8 eV的能带主要由Cu的3d和铁的3d轨道贡献,S的3p轨道也有一部分贡献;导带从1.8 eV延伸到4.5 eV。
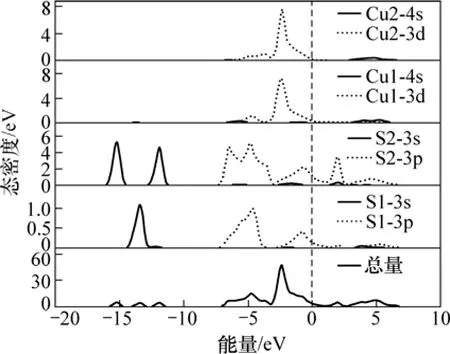
图4 铜蓝态密度图Fig.4 Density of state of covellite
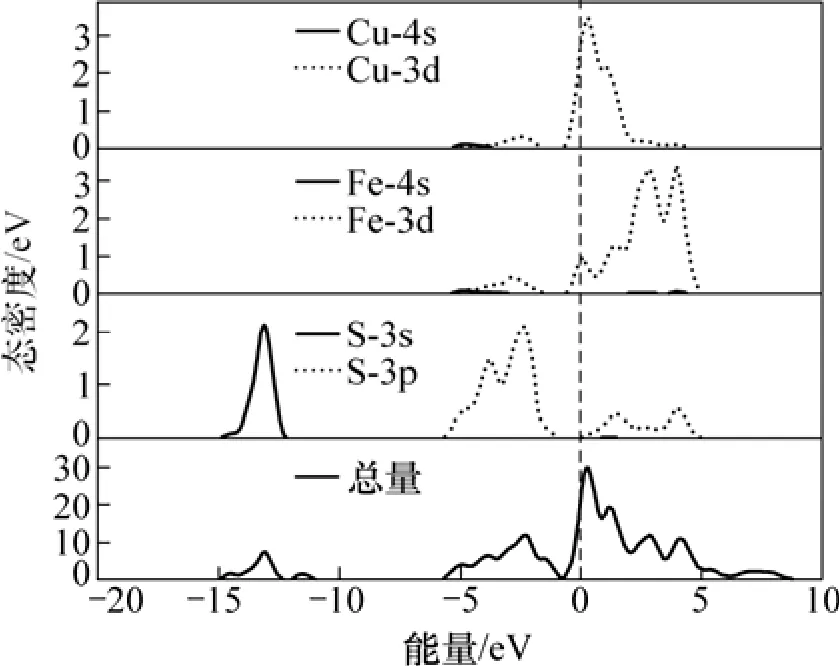
图5 斑铜矿态密度图Fig.5 Density of state of bornite
从能带结构计算结果可知:辉铜矿、铜蓝、斑铜矿为金属,黄铜矿属于窄带半导体,具有与金属相似的性质,研究表明[22]金属费米能级附近电子活跃,重要的物理化学反应总是发生在金属的费米能级附近。从4种硫化铜矿物的态密度图可以看出:黄铜矿费米能级附近态密度由S原子的4p轨道和Fe原子的3d轨道贡献;辉铜矿费米能级附近态密度由 Cu原子的4s和S原子的3p轨道构成,其中Cu原子的4s轨道贡献最大;铜蓝费米能级附近态密度由Cu原子的3d和S原子的3p轨道构成,其中S原子的3p轨道贡献最大;斑铜矿费米能级附近态密度由Cu原子的3d和S原子的3p轨道构成。因此,黄铜矿中Fe和S的活性较强,辉铜矿中Cu原子活性最强,铜蓝中S原子活性最强,斑铜矿中Cu和S活性较强。根据文献[23],黄铜矿、辉铜矿、铜蓝发生氧化反应如下所示:
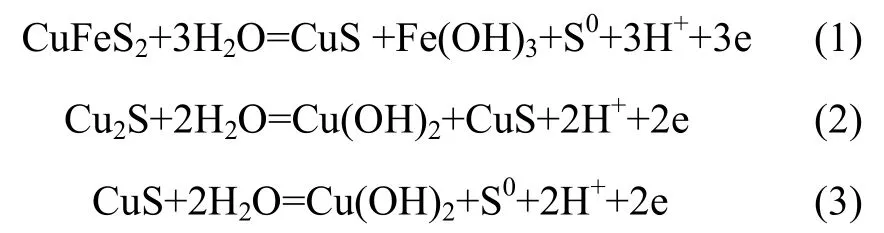
从以上反应可以看出:黄铜矿的氧化反应发生在Fe原子和S原子,辉铜矿的氧化发生在Cu原子,而硫原子则没有参与反应,铜蓝的氧化发生在S原子,这与态密度分析结果一致。
2.3 前线轨道分析
前线轨道理论认为分子的许多性质主要由分子中的前线轨道决定,即最高占据分子轨道(HOMO)和最低空轨道(LUMO)决定。一个反应物的最高占据分子轨道(HOMO)与另一个反应物最低空轨道(LUMO)的能量之间的差值的绝对值(ΔE)越小越利于分子之间发生相互作用。把经过优化好的矿物晶体和氧气分子提交Material Studio4.2下的Dmol3模块,从能量(Energy)方面对Orbitals性质进行计算,从而得到矿物及氧气的前线轨道能量,计算函数选择GGA下的PW91,收敛精度选用 Medium,k-points选为 Gamma,其他参数选择默认值。经过计算矿物及氧气前线轨道能量列于表3。从表3可以看出:硫化铜矿物HOMO轨道与氧气 LUMO轨道作用的能量差值绝对值(ΔE1)都小于硫化铜矿物LUMO轨道与氧气HOMO轨道的能量差值绝对值(ΔE2),说明是硫化铜矿物的HOMO轨道和氧气的LUMO轨道发生作用。由ΔE1可知,辉铜矿与氧的相互作用最强,斑铜矿次之,铜蓝与氧的相互作用最弱,4种硫化铜矿物的氧化从易到难顺序为:辉铜矿、斑铜矿、黄铜矿、铜蓝,这与实践结果一致[6, 23]。
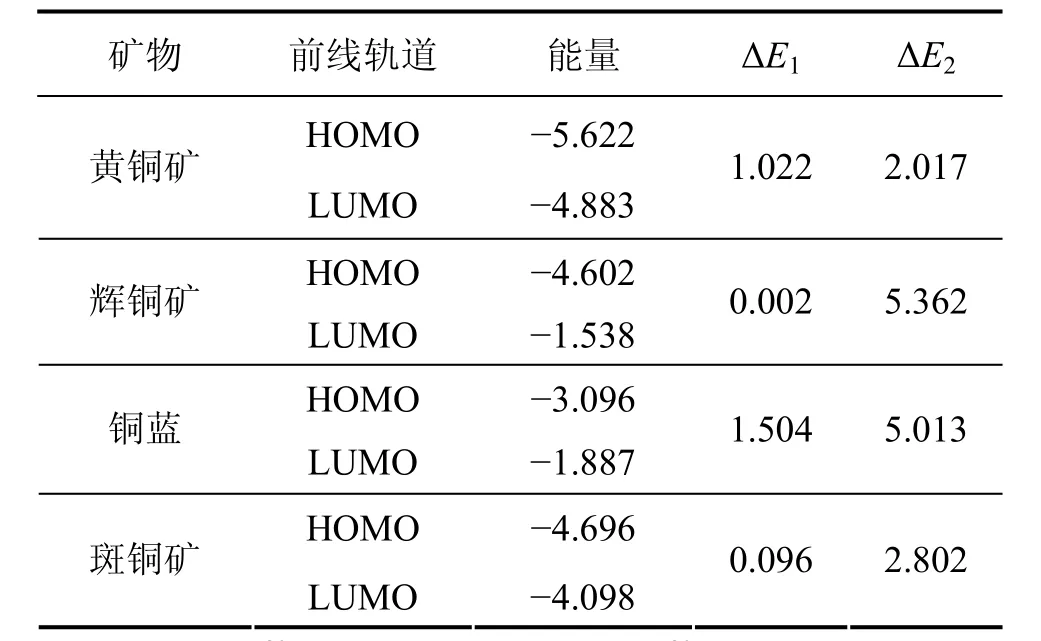
表3 矿物及药剂前线轨道能量Table 3 Frontier orbital energy of mineral eV
3 结论
(1) 黄铜矿为直接带隙 p型半导体,禁带宽度为0.99 eV;辉铜矿、铜蓝、斑铜矿价带和导带相交,具有导电性。
(2) 黄药的费米能级比黄铜矿的高,在黄铜矿表面被氧化为双黄药;黄药的费米能级比辉铜矿、铜蓝、斑铜矿的低,电子不能传递到矿物表面,黄药在辉铜矿、铜蓝、斑铜矿表面生成黄原酸铜。
(3) 黄铜矿费米能级附近主要由Fe原子和S原子贡献组成,Fe原子和S原子具有较高活性;辉铜矿、铜蓝、斑铜费米能级附近主要由Cu原子和S原子组成,这3种矿物Cu原子和S原子的活性较高。
(4) 用前线轨道理论解释了硫化铜被氧化难易的差别。氧化性从易到难的顺序为:辉铜矿,斑铜矿,黄铜矿和铜蓝,为进一步认识硫化铜矿物可浮性的差异及硫化铜矿物新药剂开发提供了理论参考。
[1] 刘平, 赵冬梅, 田保红. 高性能铜合金及其加工技术[M]. 北京: 冶金工业出版社, 2005: 1.LIU Ping, ZHAO Dong-mei, TIAN Bao-hong.High-performance copper alloys and processing techniques[M].Beijing: Metallurgy Industry Press, 2005: 1.
[2] Klauber C. A critical review of the surface chemistry of acidic ferric sulphate dissolution of chalcopyrite with regards to hindered dissolution[J]. International Journal of Mineral Processing, 2008, 86(1/2/3/4): 1-17.
[3] Lakshmi S, Reddy S, Fayazuddin M D, et al. Electron paramagnetic resonance and optical absorption spectral studies on chalcocite[J]. Molecular and Biomolecular Spectroscopy,2007, 68(3): 420-423.
[4] Sowjanya G, Reddy N C G, Lakshmi Reddy S, et al. Electron paramagnetic resonance and optical absorption spectral studies on covellite mineral[J]. Molecular and Biomolecular Spectroscopy, 2008, 71(3): 751-754.
[5] Fuentes G, Vinals J, Herreros O. Hydrothermal purification and enrichment of Chilean copper concentrate: Part1: The behavior of bornite, covellite and pyrite[J].Hydrometallurgy, 2009,95(1/2): 104-112.
[6] 胡熙庚. 有色金属硫化矿选矿[M]. 北京: 冶金工业出版社,1987: 1-6.HU Xi-geng. Non-ferrous metal sulfide ore processing[M].Beijing: Metallurgy Industry Press, 1987: 1-6.
[7] 王淀佐, 邱冠周, 胡岳华. 资源加工学[M]. 北京: 科技出版社, 2005: 212-213.WANG Dian-zuo, QIU Guan-zhou, HU Yue-hua. Resources processing science[M]. Beijing: Science and Technology Press,2005: 212-213.
[8] Edelbro R, Sandstrom Å, Paul J. Full potential calculations on the electron band structures of sphalerite, pyrite and chalcopyrite[J]. Applied Surface Science, 2003, 206(1/2/3/4):300-313.
[9] 陈建华, 陈晔, 曾小钦, 等. 铁杂质对闪锌矿表面电子结构及活化影响的第一性原理研究[J]. 中国有色金属学报, 2009,19(8): 1517-1523.CHNE Jian-hua, CHEN Ye, ZENG Xiao-qin, et al. First principle study of effect of Fe impurity on electronic structure and activation of sphalerite surface[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(8): 1517-1523.
[10] Oertzen G U VON, Jones R T, Gerson A R. Electronic and optical properties of Fe, Zn and Pb sulfides[J]. Journal of Electron Spectroscopy and Related Phenomena,2005(144/145/146/147): 1245-1247.
[11] Reich M, Becker U D O. First-principles calculations of the thermodynamic mixing properties of arsenic incorporation into pyrite and marcasite[J]. Chemical Geology, 2006, 225(3/4):278-290.
[12] Lee K, Archibald D, Mclean J, et al. Flotation of mixed copper oxide and sulfide minerals with xanthate and hydroxamate collectors[J]. Minerals Engineering, 2009, 22(4): 395-401.
[13] Senior G D, Guy P J, Bruckard W J. The selective flotation of enargite from other copper minerals: A single mineral study in relation to beneficiation of the Tampakan deposit in the Philippines[J]. International Journal of Mineral Processing, 2006,81(1): 15-26.
[14] Barkhordari H R, Jorjani E, Eslami A, et al. Occurrence mechanism of silicate and aluminosilicate minerals in Sarcheshmeh copper flotation concentrate[J]. International Journal of Minerals, Metallurgy and Materials, 2009, 16(5):494-499.
[15] Jones R O, Gunnarsson O. The density functional formalism, its application and prospects[J]. Review of Modern Physics, 1989,61(3): 689-746.
[16] 陈建华, 冯其明, 卢毅屏. 电化学调控浮选能带模型及应用(Ⅱ): 黄药与硫化矿物作用的能带模型[J]. 中国有色金属学报, 2000, 10(3): 426-429.CHEN Jian-hua, FENG Qi-ming, LU Yi-ping. Energy band model of electrochemical flotation and its application(Ⅱ):Energy band model of xanthate interacting with sulphide minerals[J]. The Chinese Journal of Nonferrous Metals, 2000,10(3): 426-429.
[17] Roos J R, Celis J P, Sudarsono A S. Electrochemical control of chalcocite and covellite-xanthate flotation[J]. International Journal of Mineral Processing, 1990, 29(1/2): 17-30.
[18] 张麟. 铜录山铜矿浮选基础研究与应用[D]. 长沙: 中南大学资源加工与生物工程学院, 2009: 67-69.ZHANG Lin. Basic researches on flotation of copper minerals of Tonglushan mine and application[D]. Changsha: Central South University. School of Minerals Processing and Bioengineering,2009: 67-69.
[19] Brennet P, Jafferali S, Vanseveren J M, et al. Study of the mechanism of anodic dissolution of Cu2S[J]. Metallurgical and Materials Transactions B, 1974, 5(1): 127-134.
[20] Shemilt J M, Steele B C H, Weston J E. Thermodynamics and mobility of copper in bornite (Cu5FeS4)[J]. Solid State Ionics,1981, 2(2): 73-85.
[21] 潘兆橹. 晶体学及矿物学[M]. 北京: 地质出版社, 1994: 37.PAN Zhao-lu. Crystallography and mineralogy[M]. Beijing:Geology Press, 1994: 37.
[22] 任尚元. 有限晶体中的电子态[M]. 北京: 北京大学出版社,2006: 7.REN Shang-yuan. Electron state of finite crystal[M]. Beijing:Peking University Press, 2006: 7.
[23] 冯其明, 陈荩. 硫化矿浮选电化学[M]. 长沙: 中南工业大学出版社, 1992: 58.FENG Qi-ming, CHEN Jin. Electrochemical sulfide ore flotation[M]. Changsha: Central South University of Technology Press, 1992: 58.

