氧化石墨烯的制备及其对黄药的吸附行为研究
李寿媛,别丽娟,汤佳雷,魏恒彬,李 琳
(山东科技大学化学与环境工程学院,山东 青岛 266590)
我国矿产资源丰富,矿产工业发展迅速,已成为世界有色金属生产和消费大国[1]。伴随着矿产资源的大规模开发,选矿药剂的年消耗量已达到百万吨级。若大量的选矿药剂残留在选矿废水中,随之一同排入天然水系,势必会污染环境,对周围的居民健康、农业和渔业产生不良影响。
黄药是广泛用于浮选锌、铅、镍、铜和其他有色金属以及硫化矿最有效和最广泛的捕收剂之一[2]。选矿废水中的黄药难回收、难处理等特点,使黄药成为矿山废水中主要的有机污染物。黄药的危害主要有三个方面:一是对人的危害,黄药具有一定的毒性,会对人体的神经系统和肝脏等器官产生不利影响;二是对农业的危害,选矿时使用的各种药剂使得选矿废水中含有大量的悬浮物质,当选矿废水排入天然水并作用于农业,会严重破坏土壤结构,影响土壤中微生物的活动,使农作物产量急剧降低;三是对渔业的危害,当有选矿药剂的废水汇入河流时,会消耗水中鱼类赖以生存的溶解氧及饵料,水质腐败变臭,鱼类无法生存[3]。此外,有研究表明[4-5],黄药会残留在循环水中,影响矿物的选别指标。因此,去除浮选废水中残留黄药是至关重要的。
去除水中黄药的方法主要有化学沉淀法、氧化法、酸化法、离子交换法、生物降解法及吸附法等。但是化学沉淀法成本较高并且有可能引入金属离子,酸化法和氧化法容易产生硫化物而引起二次污染,离子交换吸附法以及生物降解法目前仍处于研究阶段[6-8]。相比之下,吸附法因其吸附效率高,无污染,在废水处理中受到越来越多的关注[9]。可作为吸附剂的材料有很多,包括活性炭、膨润土、氧化石墨烯(GO)和石墨烯等。程伟等[10]以活性炭为吸附剂,成功实现了对废水中黄药的吸附。活性炭作为吸附剂在水处理中得到广泛的应用,但再生困难[11]。石墨烯是一种新型的碳纳米材料,作为吸附材料,具有非常大的比表面积,但成本较高,且吸附位点较少[12]。而GO是石墨通过强氧化剂的作用,从边缘到层间逐步氧化,经超声分散形成单层或少层的石墨烯氧化物[13]。GO表面丰富的含氧官能团的存在从而降低了其表面能,相比于石墨烯具有优良的平整性,超高的比表面积和优良的两亲性的片层结构材料,因此GO作为吸附剂具有广阔的应用前景。
本文采用改进的Hummers法制备的GO为吸附材料,探究GO对正戊基黄药、正丁基黄药和乙基黄药在不同温度条件下的吸附行为,以探明吸附规律、确定吸附机理,以此阐明GO吸附黄药的吸附机制,为黄药废水的回用及净化提供科学依据。研究黄药的废水吸附规律是探究选矿废水净化的基础,对矿山环境治理具有普遍性意义。
1 实 验
1.1 实验试剂及设备
主要试剂:石墨(+0.149 mm,化学成分见表1,青岛天盛达石墨有限公司),正丁基黄药(工业纯,青岛化学试剂有限公司),正戊基黄药(工业纯,新源化工),乙基黄药(工业纯,萨恩化学技术),P2O5,过硫酸钾,KMnO4,浓硫酸(98 wt%),过氧化氢(30 wt%),HCl(36 wt%~38 wt%),H3PO4,无水乙醇,除标注外其他均为分析纯。

表1 石墨化学成分表Table 1 Graphite chemical composition table
主要仪器:Axios型X射线荧光色谱仪(帕纳科公司);SP-756型紫外可见分光光度计(上海光谱仪器制造有限公司);S-48000扫描电子显微镜(Hitachi公司);HR EVolution型拉曼光谱仪(HORIBA Scientific公司);Max2500PC型X射线衍射仪(Rigaku公司);Nicolet380傅里叶变换红外光谱仪(赛默飞世尔科技公司)。
1.2 实验方法
1.2.1 氧化石墨烯(GO)的制备
采用改进的Hummers法制备GO。首先对石墨进行预氧化处理,在冰浴条件下,用磁力搅拌器在40 mL硫磷混合酸中加入1.0 g石墨,搅拌至均匀,后加入3 g高锰酸钾。顺次在低温(<10 ℃)、中温(35 ℃左右)和高温(65~90 ℃)条件下搅拌反应45 min、2 h和1.5 h。加一定量过氧化氢(30 wt%)至不再有气泡产生,稀释后低速离心去上清液,并用的10 wt%盐酸洗涤底物至上清液加入AgCl无白色沉淀,洗涤至中性后,超声15 min,在50 ℃真空烘干。
1.2.2 氧化石墨烯(GO)对黄药的吸附
经过前期最佳投加量试验确定,当GO的投加量为0.020 g时,黄药的单位吸附量达到最大值。称取若干份0.020 g最优条件下制备得到的GO分别放入250 mL锥形瓶中,然后加入100 mL不同浓度的黄药,分别在10 ℃、20 ℃、30 ℃和40 ℃下恒温水浴振荡2 h,用0.45 μm孔径的微孔滤膜抽滤,留取滤液,在301 nm处测其吸光度,带入标准曲线方程,求得吸附后浓度,以此确定吸附量。吸附量计算见式(1);单位吸附量计算见式(2)。
q=(ce-c0)V
(1)
qe=q/m
(2)
式中:q为吸附量;ce为吸附后黄药浓度;c0为初始黄药浓度;V为溶液体积;m为加入GO的质量。
根据所得数据,以qe对ce作图,得到等温吸附曲线。
使用Langmuir和Freundlich吸附模型对该吸附过程进行拟合,以此更加精确地判定其吸附模型。Langmuir模型及其直线形式见式(3)和式(4),利用ce/qe(纵坐标)对ce(横坐标)作图,KL和Q由斜率和截距计算获取。Freundlich吸附模型其直线形式见式(5)和式(6),利用logqe(纵坐标)对ce(横坐标)作图,n、KF由斜率和截距计算获取。

(3)

(4)

(5)
logqe=logKF+nlogce
(6)
式中:KL为Langmuir吸附常数(L/mg),与吸附热有关,代表吸附能力的强弱;KF为Freundlich吸附特征常数,表示吸附能力的大小;1/n为Freundlich吸附特征常数,表示吸附强度。
2 实验结果与讨论
2.1 氧化石墨烯(GO)的表征
GO的大小和厚度等信息可以通过扫描电镜图像观察得到,图1为GO放大20 000倍得到的电镜图像。经超声剥离后的GO呈蜂窝状的片层结构,层间距达纳米级,有轻微褶皱现象。
图2为原料石墨和由石墨制备的GO的XRD图谱,从图2可以看出石墨在2θ=26.4°出现尖锐的(002)特征峰,对应的层间距d=0.34 nm,经氧化反应制得的GO(002)特征峰完全消失,GO的(001)特征峰在2θ=9.6°出现,说明石墨经氧化后成功的实现了剥离,得到了GO。相比于石墨的(002)峰,GO的(001)特征峰强度很弱,峰型变宽,说明经氧化后,GO的粒径尺寸减小,层间距增大为0.91 nm,导致其π-π堆叠作用遭到破坏。

图1 GO的扫描电子显微镜图像Fig.1 Scanning electron microscope image of GO
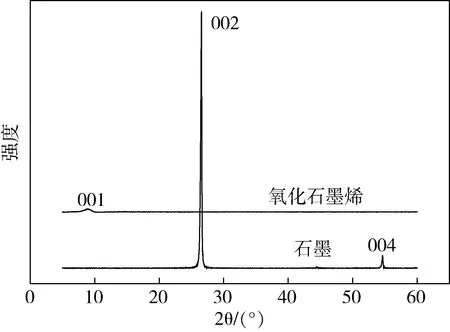
图2 石墨与GO的XRD图谱Fig.2 XRD pattern of graphite and graphene oxide
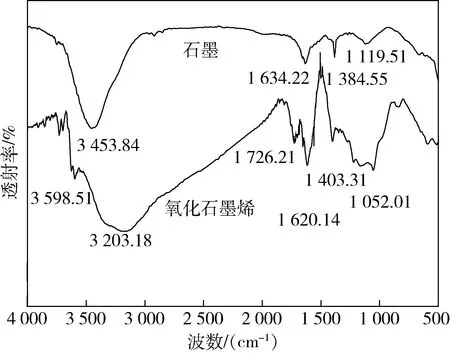
图3 石墨与GO的FT-IR图谱Fig.3 FT-IR spectra of graphite and graphite oxide
由图3可知,在石墨的FT-IR图谱中3 453.84 cm-1处对应水分子羟基的伸缩振动,1 634.22 cm-1对应C=C的伸缩振动,1 384.55 cm-1处对应羟基弯曲振动,1 119.51 cm-1处对应C—O的伸缩振动,经氧化后的GOFT-IR图谱在3 203.18 cm-1处出现羟基的伸缩振动峰,1 726.21 cm-1处C=O的伸缩振动和1 052 cm-1处C—O的伸缩振动,说明以石墨为原料制备的GO具有更丰富的官能团。
图4给出了石墨、GO的拉曼光谱,从石墨的拉曼光谱可以看出,在1 350 cm-1处出现的峰所对应的D模常被解释为石墨布里渊区K临界点附近声色子参与的双共振散射效应导致,说明石墨样品存在微弱程度的缺陷或无序性[14]。在1 580 cm-1出现的峰所对应的G模是由碳环或长链中所有sp2原子对的拉伸运动产生的属于双重简并平面内的光学振动,只有G模具有拉曼活性。从氧化石墨的拉曼光谱可知,氧化石墨的G峰宽化,且偏移至1 590 cm-1处,在1 350 cm-1处的D峰宽化且显著增强,表明石墨被氧化后,结构中一部分sp2杂化碳原子转化成sp3杂化结构,即石墨层中的C=C双键被破坏。I(D)/I(G)是衡量物质不规则度或sp2杂化域的平均尺寸,是判断物质有序性的重要指标,I(D)/I(G)与样品中sp2杂化域的平均尺寸大小(La)有关,D峰增强服从TK关系,I(D)/I(G)∝1/La[15]。石墨和GO的I(D)/I(G)分别为0.07和0.97。氧化石墨I(D)/I(G)的增大,对应的石墨微晶相对尺度La减小,进一步说明GO中sp2杂化域碳层平面尺寸变小,正是由于官能团成键作用破坏了石墨层间π-π堆叠作用而导致其层间距的增加。
2.2 黄药的等温吸附
由图5~7可知,在不同温度条件下,GO对黄药的平衡吸附量随着黄药溶液浓度的增加而增加,GO对黄药的饱和吸附量随着温度的升高而增加。GAO等[16]在利用GO对抗菌素进行吸附研究时也观察到了吸附量随温度升高而增加的现象,他们认为导致这种现象的原因是:温度的升高使得吸附剂表面可利用的活性位点增多或者使吸附质的扩散速率增高。TAN等[17]认为温度的升高会降低溶液的黏性,增加了吸附质穿过边界层和吸附剂孔内部的扩散速率,从而增加吸附量。

图4 石墨和GO的Raman光谱Fig.4 Raman spectra of graphite and GO

图5 正戊基黄药等温吸附曲线Fig.5 Isothermal adsorption curve of n-amyl xanthate
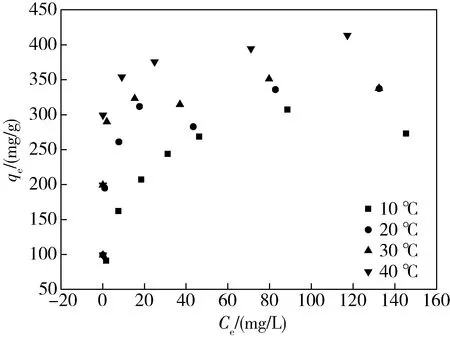
图6 正丁基黄药等温吸附曲线Fig.6 Isotherm adsorption curve of n-butyl xanthate
使用Langmuir、Freundlich等温吸附模型对实验结果进行模拟,吸附曲线图及参数见图8~13和表2。由Langmuir方程得到的相关系数R2均大于0.995,且都高于Freundlich方程得到的R2,说明GO对黄药的吸附更符合Langmuir等温吸附模型。说明吸附量随温度的升高而增加。这是由于GO的官能团在其表面分布均匀。通过Langmuir计算得出不同温度的最大吸附量Q随温度的升高而增大,说明GO对黄药的吸附为吸热过程,升高温度有利于吸附反应的进行,且最大吸附量Q明显高于同条件活性炭的最大吸附量[9]。这种现象是由于GO作为一种片层结构材料,具有超高的比表面积,且表面含有丰富的官能团,导致GO对黄药有较大的吸附量,在水中有极好的分散性,进一步提高了其对黄药的吸附速度。

图7 乙基黄药等温吸附曲线Fig.7 Isotherm adsorption curve of ethyl xanthate

图8 正戊基黄药Langmuir吸附等温线Fig.8 Langmuir sorption isotherm of n-amyl xanthate

图9 正戊基黄药Freundlich吸附等温线Fig.9 Freundlich adsorption isotherm of n-amyl xanthate

图10 正丁基黄药Langmuir吸附等温线Fig.10 n-butyl xanthate Langmuir adsorption isotherm

图11 正丁基黄药Freundlich吸附等温线Fig.11 n-butyl xanthate Freundlich adsorption isotherm

图12 乙基黄药Langmuir吸附等温线Fig.12 Ethyl xanthate Langmuir adsorption isotherm

图13 乙基黄药Freundlich吸附等温线Fig.13 Ethyl xanthate Freundlich adsorption isotherm

表2 GO对黄药的等温吸附模型参数表Table 2 Parameter table of the isothermal adsorption model of GO for xanthate
2.3 吸附热力学计算
为进一步考察GO对黄药的吸附行为,以Langmuir吸附模型参数表为基础,分析计算吉布斯自由能ΔG、焓变ΔH及熵变ΔS等热力学参数,计算公式分别见式(7)~(9)。
ΔG=-RTlnK
(7)

(8)
ΔG=ΔH-TΔS
(9)
式中:R=8.314 J/(mol·K),为摩尔气体常数;K为Langmuir常数;T为绝对温度。计算结果见表3。
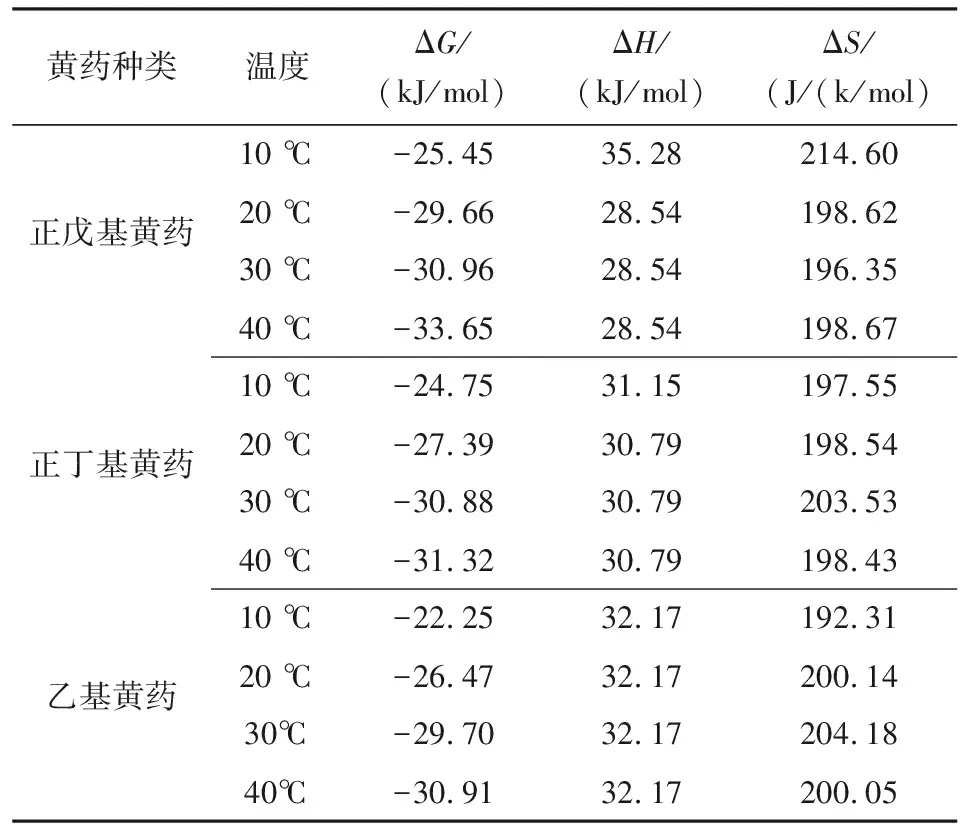
表3 GO吸附黄药的热力学参数Table 3 Thermodynamic parameters ofGO adsorption for xanthate
由表3可知,在不同温度条件下,GO吸附不同黄药的ΔG均为负值,说明吸附过程为自发过程,且随着温度的升高,ΔG的绝对值逐渐增大,说明升温有利于吸附过程进行;吸附焓变ΔH均为正值,且小于40 kJ/mol,说明GO对黄药的吸附过程为吸热过程,属于物理吸附;ΔS>0,表明吸附为熵增过程,这主要是由于黄药分子取代GO表面已吸附的水分子,导致水分子由原来在GO表面紧密排列,转变为在溶液中自由运动,从而造成整个体系的混乱度增加。同一温度下(以20 ℃为例),乙基黄药、正丁基黄药、正戊基黄药的ΔG分别为-20.67 kJ/mol、-27.39 kJ/mol、-29.66 kJ/mol,说明黄药碳链越长越易被GO吸附。
3 结 论
1) GO对黄药的吸附符合Langmuir吸附模型,吸附过程能够自发完成,为吸热过程,属于物理吸附。
2) 随着吸附温度的提高,GO对黄药的吸附量逐渐增加,升高温度有利于促进GO对黄药的吸附。
3) 随着黄药碳链的增长,GO对其饱和吸附量呈递增趋势,且吉布斯自由能的绝对值逐渐增大,吸附更容易发生。

