Snail基因与食管癌细胞侵袭迁移能力的相关性分析
鲁秦安,康龙丽
西安文理学院,陕西西安 710065
肿瘤的侵袭与转移是恶性肿瘤发生、发展的重要阶段,有证据表明90%以上的恶性肿瘤最终都是因肿瘤的侵袭转移或复发而导致死亡。近年来研究发现许多基因异常表达与肿瘤的发生、发展有关,Snail基因就是其中之一。Snail是Snail家族的第一个成员,近年来大量的研究表明,Snail在食管癌、乳腺癌、胃癌、结肠癌、卵巢癌等恶性肿瘤中高表达[1-5],并且在上皮-间质转型(EMT)并促进侵袭转移中发挥着重要的作用[6],但是目前国内外极少有关Snail在人类食管癌方面的研究。
本研究通过siRNA干扰的方法抑制人食管癌细胞EC9706的Snail基因的表达,进一步观察Snail基因对人食管癌细胞侵袭能力的影响。
1 材料与方法
1.1 材料
食管癌细胞EC9706(由中国医学科学院国家分子肿瘤实验室提供)用含有10%新生牛血清的DMEM高糖培养基(购自GIBCO公司)在37℃的培养箱中培养,细胞贴壁生长,隔夜换液,2~3 d传代1次,取对数生长期细胞进行实验。LipofectamineTM 2000购自 Invitrogen公司,Snail-siRNA购自广州锐博生物公司,Trizol试剂购自Invitrogen公司,RTPCR试剂盒购自Promega公司,内参照GAPDH引物及Snail引物由广州锐博生物公司合成,Transwell孔板购自美国Corning公司。
1.2 细胞转染
由广州锐博生物公司合成3条针对Snail的siRNA序列,筛选出其中1条有效的siRNA序列,参照说明书进行Snail-siRNA转染。Snail-siRNA序列正义链:5’-GCUGCAGGACUCUAAUCCAdTdT-3’;反义链:5’-UGGAUUAGAGUCCUGCA GCdTdT-3’。将细胞分为三组,实验组:转染时加入Snail特异性siRNA;空白对照组:转染时加入无血清1640培养液500 μl;阴性对照组:转染时加入非特异性siRNA。
1.3 RT-PCR法检测Snail mRNA的表达
应用RNA提取试剂盒提取总RNA,Snail引物设计参考文献并经过GeneBank验证。Snail引物序列上游:5’-TTC TTCGCTACTGCTGCG-3’; 下 游 :5’-GGGCAGGTATGGAGA GGAAGA-3’,预扩增片段883 bp。内参照GAPDH引物序列上游:5’-TGGTATCGTGGAAGGACTCATGAC-3’; 下游:5’-ATGCCAGTGAGCTTCCCGTTCAGC-3’,预扩增片段190 bp。 循环条件:94℃变性 1 min,56℃退火 40 s,72℃延伸 30 s,40 个循环后,72℃延伸10 min。产物行琼脂糖凝胶电泳,照像并扫描分析。
1.4 Western blotting法检测Snail蛋白的表达
取蛋白质样品上样,用12%聚丙烯酰胺凝胶 (SDSPAGE)电泳分离样品,转膜,封闭液于室温封闭后加入一抗(1∶1000)(羊抗人 Snail),4℃孵育过夜,碱性磷酸酶标记二抗IgG(1∶1000),37℃孵育 1 h,加入化学发光液,暗室曝光,显影,定影。
1.5 细胞划痕实验
将生长状态良好的细胞接种于6孔板中,待长到完全融合时,用200 μl枪头在6孔板的底面上沿直线轻轻进行划痕,划痕后PBS冲洗2次,继续培养,12 h后在倒置显微镜下观察细胞划痕愈合情况并照相,以细胞划痕愈合百分比表示细胞的运动能力(0 h的细胞划痕愈合为0%)。
1.6 Transwell小室体外侵袭实验
将Transwell小室置于24孔板内,每个孔下室内加入含10%小牛血清的DMEM培养液500 μl,上室加入200 μl细胞悬液,每组设5个复孔,常规培养12 h,取出Transwell小室,95%乙醇固定,用棉拭子将小室内面的基质胶擦去,4%的多聚甲醛固定,HE染色,显微镜下观察照相。
1.7 统计学方法
采用SPSS 15.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,三组间比较采用方差分析,组间两两比较采用SNK法,以P<0.05为差异有统计学意义。
2 结果
2.1 三组细胞Snail mRNA表达情况比较
实验组细胞Snail mRNA表述条带明显暗于阴性对照组及空白对照组 (图1)。Snail mRNA的相对表达量=Snail mRNA表达量/GAPDH表达量,Snail mRNA在实验组的相对表达量为(0.11±0.09),显著低于空白对照组的(0.61±0.20)及阴性对照组的(0.68±0.24),差异有统计学意义(P<0.05);阴性对照组与空白对照组比较,差异无统计学意义 (P>0.05)。

图1 三组细胞Snail mRNA的表达情况
2.2 三组细胞Snail蛋白表达情况比较
实验组细胞Snail的蛋白表达条带明显暗于阴性对照组及空白对照组(图2)。Snail蛋白的相对表达量=Snail蛋白表达量/β-actin蛋白表达量,Snail蛋白在实验组的相对表达量为(0.09±0.04),显著低于空白对照组的(0.61±0.22)及阴性对照组的(0.72±0.16),差异有统计学意义(P<0.05);阴性对照组与空白对照组比较,差异无统计学意义(P>0.05)。

图2 三组细胞Snail蛋白的表达情况
2.3 三组细胞的迁移能力比较
单层细胞划痕实验12 h后,实验组细胞的划痕愈合速度明显慢于阴性对照组及空白对照组(图3)。三组细胞划痕愈合百分比分别为:实验组为(32.7±4.5)%;空白对照组为(87.6±4.9)%;阴性对照组为(92.6±2.1)%,实验组细胞的迁移能力明显低于空白对照组和阴性对照组,差异有高度统计学意义(P<0.01),空白对照组和阴性对照组间比较,差异无统计学意义(P>0.05)。
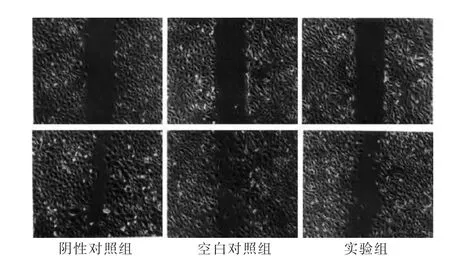
图3 三组细胞划痕愈合情况
2.4 三组细胞侵袭能力的比较
Matrigel胶能在聚碳酸酯微孔滤膜上形成类似哺乳动物基底膜样结构,因此,EC9706细胞穿过Matrigel胶的情况可以反映出EC9706细胞的侵袭能力。Transwell侵袭小室实验结果显示,实验组穿膜细胞数为(34.0±2.4)个/HP,明显低于阴性对照组[(72.0±4.7)个/HP]与 空白 对照 组[(75±5.3)个/HP],差异有统计学意义(P<0.05);阴性对照组与空白对照组穿膜细胞数比较,差异无统计学意义(P>0.05),说明实验组细胞的侵袭能力明显低于空白对照组及阴性对照组(图4)。

图4 三组细胞的侵袭能力情况
3 讨论
食管癌是目前常见的消化道恶性肿瘤之一,我国是世界上食管癌的高发地区。近年来随着外科技术及新辅助治疗的飞速发展,使部分食管癌患者得到了一定治疗,但是由于食管癌高侵袭性的生物学特点,总体来说食管癌仍是一种预后较差的恶性肿瘤,因此探索控制食管癌细胞侵袭的相关机制成为进一步提高食管癌疗效的关键。目前研究发现Snail基因与肿瘤的侵袭转移密切相关。
Snail是近年来发现的锌指转录因子,其属于转录抑制子中的Snail超家族,首先在果蝇中发现,具有促进细胞迁移的作用,在上皮-间质转型(EMT)并促进侵袭转移中发挥着重要的作用。EMT是指上皮细胞在特定生理病理状态下向间充质细胞转化的现象,发生于多种病理、生理过程中,例如伤口愈合、胚胎发育等,近年来大量的研究表明肿瘤的侵袭转移与EMT密切相关[7]。肿瘤在侵袭转移的过程中上皮性肿瘤细胞失去极性,转化成为有能力的间质细胞,从而穿透基底膜进入到循环系统而播散转移。研究证实,Snail参与了某些恶性肿瘤的细胞EMT并且促进了其侵袭转移[8]。体外实验已经证实抑制Snail基因的表达可以显著降低肿瘤细胞的侵袭能力。将反义Snail转染入鼻咽癌5-8F细胞、肝癌HepG2细胞及卵巢癌HO9810细胞后,肿瘤细胞的运动能力显著降低,并且侵袭细胞外基质的能力也显著降低,从而限制了肿瘤细胞的侵袭与转移[9-11],但是目前国内外有关抑制食管癌细胞Snail基因的研究甚少。
本研究发现利用RNA干扰技术可以显著降低食管癌EC9706细胞中Snail的表达,并且随着食管癌细胞Snail mRNA及蛋白表达的降低食管癌细胞的侵袭迁移能力随之明显下降,这与其他研究中的结果一致侵袭。研究中笔者证实了Snail与食管癌细胞的侵袭转移能力的关系,为食管癌分子转移机制提出了理论依据,并且为食管癌的靶向治疗提供了新的参考靶点。
[1]Usam Y,Satake S,Nakayama F,et al.Snail associated epithelial-mesenchymal transition promotes oesophageal squamous cell carcinoma motility and progression[J].J Path,2008,215(3):330-339.
[2]Come C,Arnoux V,Bibeau F,et al.Roles of the transcription factors snail and slug during mammary morphogenesis and breast carcinoma progression[J].J Mammary Gland Biol Neoplasia,2004,9(2):183-193.
[3]Rosivatz E,Becker I,Specht K,et al.Differential expression of the epithelial-mesenchymal transition regulators snail,SIPI,and twist in gastric camer[J].Am J Pathol,2002,161(5):1881-1891.
[4]Roy HK,Kunte DP,Koetsier JL,et al.Chemoprevention of colon carcinogenesis by polyethylene glycol:suppression of epithelial proliferation via modulation of Snail/beta-catenin signaling[J].Mol Cancer Ther,2006,5(8):2060-2069.
[5]Elloul S,Elstrand MB,Nesland JM,et al.Snail,Slug and Smad-interacting protein 1 as novel Parameters of disease ag gressiveness in metastatic ovarian and breast carcinoma[J].Cancer,2005,103(8):1631-1643.
[6]Peinado H,Olmeda D,Cano A.Snail,Zeb and bHLH factors in tumour progression:an alliance against the epithelial phenotype[J].Nat Rev Cancer,2007,7(6):415-428.
[7]Lee JM,Dedhar S,Kalluri R,et al.The epithelial-mesenchymal transition:newinsights in signaling development and disease [J].J Cell Biol,2006,172(7):973-981.
[8]Usami Y,Satake S,Nakayama F,et al.Snail-associated epithelial-mesenchymal transition promotes oesophageal squamous cell carcinoma mortality and progression[J].J Pathol,2008,215(3):330-339.
[9]陈丽,刘求真,邱际华,等.人snail基因RNAi慢病毒载体对鼻咽癌5-8F细胞增殖和侵袭的影响[J].第三军医大学学报,2009,31(2):1151-1154.
[10]刘海,王志强.反义Snail转录因子抑制肝癌转移[J].世界华人消化杂志,2006,14(35):3409-3413.
[11]金鸿雁,丰有吉.反义Snail转录因子抑制卵巢癌转移的实验研究[J].中华妇产科杂志,2005,40(6):400-403.

