犬细小病毒病的临床诊疗
王世雄 王荣琼 尹世平 刘永张
1.云南农业职业技术学院,昆明650212;2.云南省昆明市康爱犬猫诊所,昆明 650107;3.云南省昆明市动物园,昆明 650021
犬细小病毒病是由犬细小病毒(CPV)引起的以呕吐、腹泻和便血为主的一种犬高度接触性传染病,特点是发病率高、传染性强、死亡率高。1977年美国学者Eugster和Nairn最先从患出血性肠炎的犬粪便中分离得到该病毒,其后,加拿大、澳大利亚、法国、日本等国均有此病发生的报道。1982年,中国学者梁士哲等最早报道了类似CPV所致的犬出血性肠炎;1983年,徐汉坤等正式报道了犬细小病毒病的流行;2003年,王彤光等对上海地区犬细小病毒病进行了调查;2004年,宋永鸿对西宁地区犬细小病毒病的发病流行原因进行了调查。在犬细小病毒病的研究调查方面,国外起步较早、进展较快,目前欧美等一些发达国家已基本消灭、并控制了犬细小病毒病的流行;近期主要围绕犬的肠道病毒感染、遗传病进行研究。中国则由于对犬类疫病的研究起步较晚,处于初级阶段;加之养殖者对犬的管理不够完善、对疾病的预防控制不够重视,造成犬细小病毒病不断发生,且多发生于4~6月龄的幼犬,使之成为危害最严重的犬类烈性传染病之一。
1 材料与方法
1.1 试验材料
1)试验动物。昆明市康爱犬猫诊所收治的279例病犬。
2)试验仪器。深圳迈瑞生物医疗电子股份有限公司生产的BC-800Vet兽用全自动血液细胞分析仪;韩国生产的CPV抗原检测试纸和CPV+犬瘟热(CDV)抗原检测试纸;美国生产的CPV+犬冠状病毒(CCV)抗原检测试纸。
3)试验药品。α-干扰素,犬源血浆,辅酶 A(COA),三磷酸腺苷(ATP),生理盐水,葡萄糖,等。
1.2 方 法
1)临床诊断。采用问诊、视诊、触诊、听诊、嗅诊等方法,对患犬进行基础检查及消化系统为主的系统检查。
2)血液检查。保定患犬,采其静脉血液,将采集的血液立即注入0.5离心抗凝管内0.3mL刻度处,轻微振荡使其混合均匀,待检;然后把待检样本置于BC-2800Vet兽用全自动血液细胞分析仪吸口,并吸取样本(13.0μL),等待分析仪打印结果即可。
3)粪便检查。CPV抗原试纸检测:用消毒棉签插入患犬肛门内,采集少许粪便及肛门腺,将消毒棉签浸入装有1mL稀释液的样品收集管内,充分摇匀;静置1min后,取上层液2~3滴于平放的试纸样品孔中,5~10min后观察结果。判断标准:如在试纸T、C处同时呈现2条红线者,为阳性;在试纸C处呈现1条红线者,为阴性;在试纸T处呈现1条红线,则该试纸无效,需重新检测。CPV+CDV抗原试纸检测:方法大致同CPV抗原试纸检测。CPV+CCV抗原试纸检测:方法大致同CPV抗原试纸检测。
2 结果与分析
2.1 流行病学调查
犬是CPV主要的自然宿主,其它犬科动物如郊狼、食蟹狐和鬣狗等也可感染。本病主要由直接接触和间接接触而感染,CPV随感染犬的粪便、尿液、呕吐物、唾液排出,污染食物、垫草、食具和周围环境,通过消化道感染而使易感犬受到感染;无症状的带毒犬也是危险的传染源。不同年龄、性别、品种的犬均可感染,以幼犬、纯种犬易感;本病一年四季均可发生,但在昆明以冬季多发,感染犬往往发病急、死亡率高。
通过对昆明市康爱犬猫诊所收治的279例病犬的统计、分析,发现犬细小病毒病感染与犬的年龄、品种、免疫情况及季节等有密切关系。
1)犬细小病毒病感染与犬年龄的关系,见表1。
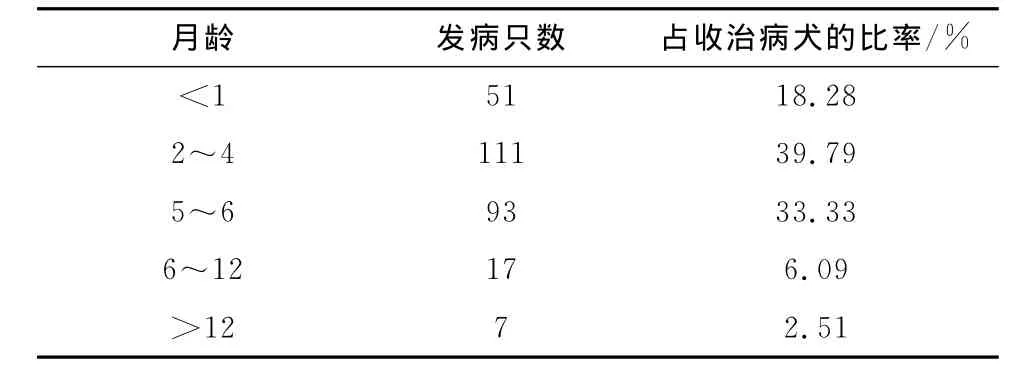
表1 犬细小病毒病感染与犬年龄关系统计
从表1可以看出,1月龄以内的犬由于受到母源抗体的影响,感染率较低;从2月龄开始,体内的母源抗体几乎消失,而自身的免疫机能还不健全,此时易感;自6月龄后,犬的免疫机能基本健全,抗病能力增强,感染率下降。
2)犬细小病毒病感染与季节的关系,见表2。

表2 犬细小病毒病感染与季节关系统计
从表2可以看出,冬季发病率最高,夏季发病率最低。
3)犬细小病毒病感染与犬品种的关系,见表3。
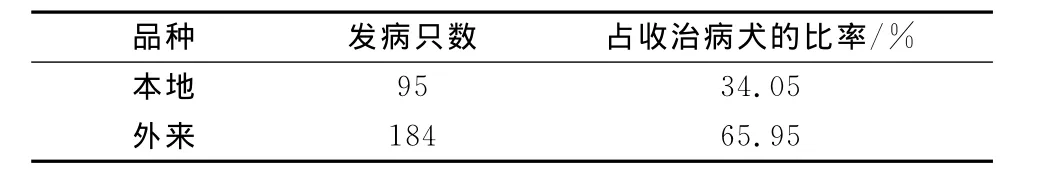
表3 犬细小病毒病感染与犬品种关系统计
从表3可以看出,本地犬发病率低于外来犬,说明本地犬的抵抗力及适应能力均高于外来犬。
4)犬细小病毒病感染与犬免疫情况的关系,见表4。
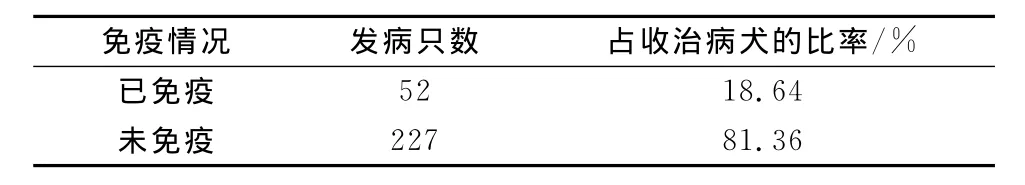
表4 犬细小病毒病感染与犬免疫情况统计
从表4可以看出,犬细小病毒病感染与免疫有很大关系,预防接种犬细小病毒疫苗是控制本病的最好途径。
2.2 临床症状
心肌炎型犬细小病毒病多发生于1月龄以内的幼犬,病犬可在短时间内死亡,发病率低、死亡率高,门诊量少或无。本研究的279例感染犬细小病毒病患犬全部为肠炎型。发病初期患犬精神沉郁,厌食;体温升高至39.5~41.0℃;软便,粪便呈灰色、黄色或乳白色,带胨状粘液;轻微呕吐。随病情发展,呕吐物清亮或胆汁样或带血(咖啡色样);粪便呈番茄汁样,带血,有特殊腥臭味;脱水,消瘦;眼窝深陷,被毛凌乱,皮肤无弹性,耳、鼻、四肢发凉;精神高度沉郁,休克;病犬因水、盐代谢障碍和酸中毒而最终死亡。
2.3 诊断方法
1)临床诊断。根据临床表现作出初步诊断,然后进行血液检测及粪便检测。
2)血液检测。根据血液检测中白细胞数减少、血红蛋白降低等作为诊断的依据。
3)粪便检测。根据CPV抗原试纸检测、CPV+CDV抗原试纸检测或CPV+CCV抗原试纸检测为阳性作为诊断的依据。
2.4 治疗方法
1)分组。从收治的279例病犬中选择150只,分R1、R2、R3组,每50只为1组。
2)处理。R1组:对症治疗。R2组:R1+补液+COA+ATP+肌苷+VB12+犬源血浆的治疗。R3组:R1+R2+α-干扰素+CPV单抗的治疗。
3)治疗。3组治疗,具体介绍如下。
R1组采取对症治疗。消炎:头孢拉定0.25~0.50g/kg体重+消毒注射液2.00mL,皮下或肌肉注射。止吐:犬吐停0.04~0.10mL/kg体重,皮下或肌肉注射。止泻:三七二止泻灵0.20mL/kg体重,皮下或肌肉注射。止血:止血敏0.50~1.00 mL/次,皮下或肌肉注射。灌肠:0.10%高锰酸钾灌肠。
R2组采取R1+补液+COA+ATP+肌苷+VB12+犬源血浆进行治疗。R1同上(补液后进行)。补液方法:有呕吐、腹泻时,按0.90%氯化钠与5.00%葡萄糖以2∶1的比例补给;无呕吐、腹泻时,按0.90%氯化钠与5.00%葡萄糖以1∶1的比例补给;无呕吐、腹泻,但有高热时,按0.90%氯化钠与5.00%葡萄糖以1∶2的比例补给。0.90%氯化钠+头孢拉定0.25~0.50g/kg体重,静脉滴注;5.00%葡萄糖+COA 50.00~200.00IU/次+ATP 10.00~20.00mg/次+肌苷50.00~200.00 mg/次+VB12 0.30~1.00mL/次,静脉滴注;犬源血浆1~4袋/次,静脉滴注。禁食3d以上的犬只,给予补钾、补钙、补碳酸氢钠。补钾:每天0.10~0.20g/kg体重,分2~3次补充,浓度不超过3.00%。补钙:10.00%葡萄糖酸钙1.00~2.00 mL/kg体重,静脉滴注。补碳酸氢钠:5.00%碳酸氢钠5.00mL/kg体重,静脉滴注。
R3组采取R1+R2+α-干扰素+CPV单抗进行治疗。R1+R2同上。α-干扰素50.00万IU/kg体重,皮下或肌肉注射;CPV单抗5.00mL/kg体重,皮下或肌肉注射。
2.5 治疗情况统计
不同方法治疗的统计结果,见表5。

表5 不同方法的治疗情况
从表5可以看出,R1、R2、R3组的治愈率分别为46.00%、90.00%、94.00%,说明 R3组的治疗方案最佳;同时,也说明R1组的治疗也起着重要作用。
3 讨 论
1)犬感染CPV后会出现呕吐、腹泻、肠道出血、厌食、绝食等临床特征,但只靠临床症状就判定其患犬细小病毒病是不可取的,采用CPV抗原检测试纸、CPV+CDV抗原检测试纸或CPV+CCV抗原检测试纸进行检测,快速、简便、准确。
2)经过对收治的279例患犬的统计与分析,发现犬细小病毒病感染与犬的年龄、品种、免疫情况及季节等有密切关系。幼犬断乳后,随着年龄的增长,抗病能力增强,治愈率也就越高;气温越低,犬感染细小病毒病的机率越高,昆明以冬季的感染率最高;纯种犬及外来犬较杂种犬及本地犬易感染;完成免疫程序的犬只,能减轻发病症状。
3)经过对收治的150例患犬进行分组治疗的统计与分析,发现R3组的治愈率明显高于R1、R2组。R1组对患犬进行消炎、止呕、止泻、止血等治疗,多数患犬由于脱水、自身免疫力下降而引起死亡;治愈的患犬,主要是因为治疗早,且患犬年龄大、体格健状。R2组在R1组的基础上增加了能量剂,有效地补充了机体自身所需体液,增加了血溶量,防止白细胞、血小板减少等,较R1组治愈率高。R3组在R1和R2组的基础上增加了α-干扰素和CPV单抗,增强了机体抗病毒及免疫机能,抑制了病毒增殖,减慢、降低了病毒侵害的速度和程度,从而减缓病情发展,较R2组治愈率高,患犬恢复快;死亡患犬主要是由于养殖者未及时带其就诊,或是没有母乳吮吸的幼犬。从3个组的统计与分析说明,R3组的治疗方案是最佳治疗方案,对CPV感染的治疗具有一定的临床指导意义。
4)早发现、早治疗可缩短病程,并获得高治愈率。
5)由于患犬感染CPV后会呕吐、腹泻,治疗过程中应禁食。通过治疗,多数患犬在治疗的第3天开始有食欲,无呕吐、腹泻症状,再可供给患犬少量食物,这样有利于患犬的康复。
6)加强对犬的护理,特别是冬季一定要注意保温。
7)本病发生迅猛,应及时隔离病犬,对犬舍及用具等,用10%~20%漂白粉液反复消毒。
8)疫苗接种是预防犬细小病毒病的有效措施,可接种二联疫苗(犬细小病毒病和传染性肝炎)、三联疫苗(犬瘟热、犬细病毒病和犬传染性肝炎)和五联疫苗(犬瘟热、犬细小病毒病、犬传染性肝炎Ⅰ型、犬传染性肝炎Ⅱ型和犬副流感)。
[1]刘万平,利凯.小动物疾病诊治[M].北京:化学工业出版社,2009.
[2]胡延春.犬猫疾病类症鉴别诊疗[M].北京:中国农业出版社,2010.
[3]周铁忠,陆桂平.动物病理[M].北京:中国农业出版社,2008.
[4]金霞,任一鸣,张宇,等.河南省犬细小病毒病的流行病学调查及诊疗研究[J].养犬,2010(1):3-7.

