盐酸米托蒽醌脂质体的药效学及毒性研究
赵 倩,王彩霞,邱云良,杨汉煜,魏 娜,王炳森,吕晶晶
(1.河北省制剂工程技术研究中心,河北石家庄 050051;2.石药集团中奇制药技术(石家庄)有限公司,河北石家庄 050051;3.国家上海新药安全评价研究中心,上海 201203)
米托蒽醌属蒽环类广谱抗肿瘤药物,主要用于治疗恶性淋巴瘤、乳腺癌和急性白血病,然而米托蒽醌进入血液后大部分(95%以上)迅速与血浆蛋白结合,造成了严重的毒副作用,如骨髓抑制、胃肠道反应及心脏毒性,使其临床应用备受限制[1]。脂质体是人工制备的由磷脂双分子定向排列而成的微球[2],可作为抗肿瘤药物的载体被动的靶向肿瘤,增加药物在肿瘤组织的蓄积,从而降低药物毒性、改善药物的治疗指数[3-4],但并不是所有的脂质体处方均可以达到此种效果,本课题组采用硫铵梯度法制备并优选出一个盐酸米托蒽醌脂质体(Mit-lipo)[5],本文对该脂质体与盐酸米托蒽醌普通制剂(Mit-inj)的抗肿瘤作用及毒性进行了比较研究,为米托蒽醌脂质体的临床应用提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞 小鼠肝癌H22细胞株,小鼠前列腺癌RM-1细胞株均由中国科学院上海生命科学研究院细胞资源中心提供。
1.1.2 实验动物 清洁级昆明种小鼠,体质量18~22 g,河北省实验动物中心提供,实验动物生产许可证号为 SCXK[冀]2008-1-003;C57小鼠,7~8周,♂,北京维通利华实验动物技术有限公司提供,实验动物生产许可证号为SCXK[京]2007-0001。动物饲养于清洁级环境,动物自由摄食、饮水,室温20~25℃,湿度40% ~70%,昼夜明暗交替时间12 h/12 h,实验动物使用许可证号:SYXK(冀)2006-0046。所有实验动物饲料及垫料由河北省实验动物中心提供。
1.1.3 药物及试剂 Mit-lipo[石药集团中奇制药技术(石家庄)有限公司研制,每支10 ml∶10 mg,批号070501,临用前以5%葡萄糖注射液稀释];Mit-inj(重庆凯林制药有限公司,含量99.4%,批号M20070104,临用前以5%葡萄糖注射液稀释);PRMI 1640培基(Sigma公司);胎牛血清(Gibco产品);Trypsin 1∶250(Sigma公司);5%葡萄糖注射液(石家庄四药有限公司)。
1.1.4 仪器及设备 IX70型倒置荧光显微镜(O-lympus公司);HERAcell 150二氧化碳培养箱(德国Heraeus贺利氏);AL204电子分析天平(Mettler Toledo)。
1.2 方法
1.2.1 对小鼠肝癌H22实体瘤的抑制作用 选取接种H22瘤细胞7 d的腹水型荷瘤小鼠,断颈处死,抽取乳白色粘稠腹水,以生理盐水注射液稀释,稀释后调整瘤细胞数为5×109·L-1。将瘤细胞悬液接种于♂KM小鼠前肢腋下皮下组织,接种体积为0.2 ml,含瘤细胞约106个,接种完成后,剩余的瘤细胞悬液在光镜下计数,活瘤细胞数>95%。接种4 d后,肿瘤长至100~300 mm3左右,按瘤体积随机均匀分为 Mit-lipo的1、2、4和6 mg·kg-1剂量组,Mit-inj的2、4和6 mg·kg-1剂量组及空白5%葡萄糖注射液对照组。分别按组单次静脉给药,给药后动物正常饲养,至接种后d 13脱颈处死小鼠,剖取瘤块并称重,计算肿瘤抑制率(%),肿瘤抑制率/%=(1-给药组平均瘤重/对照组平均瘤重)×100%。实验结果采用SPSS 11.5统计软件,Oneway ANOVA统计分析。
1.2.2 对小鼠前列腺癌RM-1实体瘤的抑制作用收集 RM-1瘤细胞,调整细胞数为2.5×109·L-1。将瘤细胞悬液接种于体重7~8周C57♂小鼠前肢腋下皮下组织,接种体积为0.2 ml,含瘤细胞约5×105个。接种完成后,剩余的瘤细胞悬液在光镜下计数,活瘤细胞数>95%。接种14 d后,挑选肿瘤体积为100~300 mm3的小鼠,按肿瘤体积将动物随机均匀分为 Mit-lipo 1、2、4和6 mg·kg-1剂量组,Mit-inj 2、4和6 mg·kg-1剂量组及空白5%葡萄糖注射液给药组,每组10只动物,分别按组单次静脉给药,给药容积为10 ml·kg-1。给药后动物正常饲养,使用测量瘤径的方法,动态观察受试药的抗肿瘤作用。每次测量瘤径同时称鼠重。计算肿瘤体积(V)及肿瘤抑制率(%),肿瘤体积(V)=1/2×a×b2,其中 a和 b分别表示肿瘤长和宽,肿瘤抑制率/%=(1-给药组平均肿瘤体积/对照组平均肿瘤体积)×100%。实验结果采用SPSS 11.5统计软件分析,Repeated Measure过程分析随时间变化多次测量间肿瘤体积及鼠重的变化,Multivariate比较各次测量时组间肿瘤体积及鼠重差异。
1.2.3 犬单次静脉毒性试验 毒性试验全部委托国家上海新药安全评价研究中心进行实验研究。♂Beagle犬单次静脉注射5%葡萄糖注射液,空白脂质体,Mit-inj 0.6、0.9、1.34、2.0 mg·kg-1,Mit-lipo 0.6、0.9、1.34、2.0、3.0 mg·kg-1,每组各一只动物,观察29 d。
1.2.4 大鼠16周毒性试验 试验设置空白脂质体组、5%葡萄糖注射液组、Mit-lipo 0.5、1.5和2.5 mg·kg-1组,以及Mit-inj 2.5 mg·kg-1组。尾静脉注射给药,1次/4周,连续4次,恢复期4周;给药体积为5 ml·kg-1,每组动物数20只,♀♂各半。于末次给药后2周以及末次给药后4周各处死解剖1/2动物。
1.2.5 犬16周毒性试验 试验设置Mit-lipo 0.1、0.3和0.45 mg·kg-1组,静脉滴注给药,1次/4周,连续4次,恢复期4周;对照组设米托蒽醌普通制剂0.45 mg·kg-1组;同时设置空白脂质体组和5%葡萄糖注射液组对照组。给药容量均为1.5 ml·kg-1,给药速度0.5 ml·min-1,每组动物数6只,♀♂各半。于末次给药后2周以及末次给药后4周分别处死解剖2/3和1/3只动物。
2 结果
2.1 Mit-lipo对H22实体瘤的体内抑制作用 与空白组相比,Mit-lipo各给药组可以剂量依赖性地明显抑制肿瘤生长(P<0.01),而 Mit-inj仅6 mg·kg-1可以抑制肿瘤生长。与等剂量的Mit-inj相比,Mit-lipo 2、4、和 6 mg·kg-1可以明显增强米托蒽醌对H22实体瘤的抑制作用(P<0.01)。各治疗组动物体重在给药后均有减轻现象,除Mit-inj 6 mg·kg-1剂量组外,其余给药组动物体重在实验结束时均恢复。结果表明米托蒽醌脂质体可以明显增加米托蒽醌对H22实体瘤的治疗效果,并可降低毒性。见Tab 1。
Tab 1Antitumor effect of Mit-lipo on H22(±s,n=10)
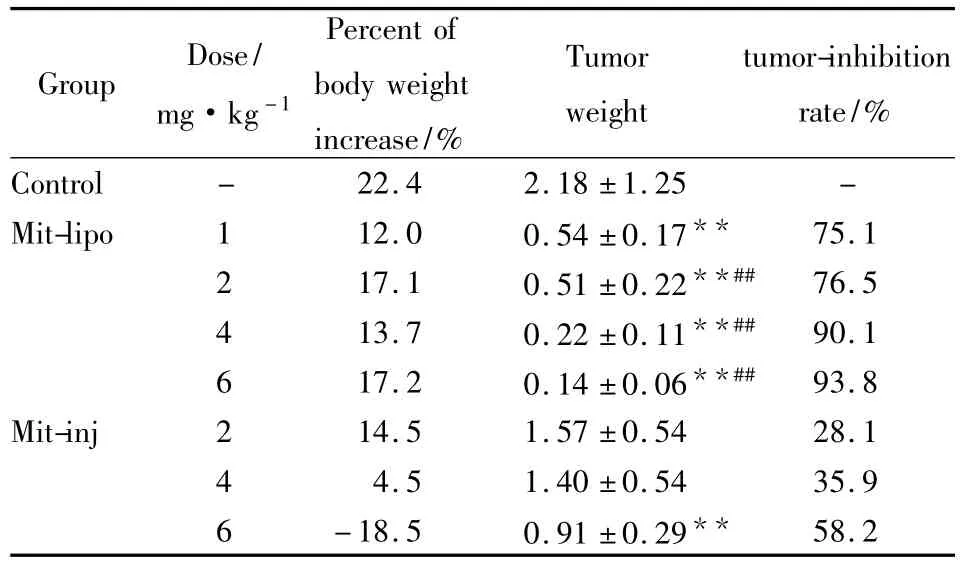
Tab 1Antitumor effect of Mit-lipo on H22(±s,n=10)
**P<0.01 vs control;##P<0.01 vs Mit-inj of same dose
Group Dose/mg·kg-1 Percent of body weight increase/%Tumor weight tumor-inhibition rate/%Control - 22.4 2.18±1.25 -Mit-lipo 1 12.0 0.54±0.17** 75.1 2 17.1 0.51±0.22**## 76.5 4 13.7 0.22±0.11**## 90.1 6 17.2 0.14±0.06**## 93.8 Mit-inj 2 14.5 1.57±0.54 28.1 4 4.5 1.40±0.54 35.9 6 -18.5 0.91±0.29**58.2
2.2 Mit-lipo对RM-1实体瘤的体内抑制作用实验结束时Mit-lipo各剂量组动物体重分别增长16.6%、18.4%、15.9%和17.4%,Mit-inj各剂量组动物体重分别增长26.5%、16.5%和10.9%,空白对照组体重增加了19.3%。
实验结果显示,Mit-lipo 2、4和6 mg·kg-1剂量组从给药后d 4开始至实验结束一直具有抑瘤作用。而Mit-inj的2和4 mg·kg-1剂量组仅在给药后d 2,6 mg·kg-1剂量组在给药后d 4和d 7具有抑瘤作用。RM-1实体瘤药效模型结果说明Mit-lipo的抑瘤维持时间明显优于Mit-inj(Mit-lipo和Mit-inj抑瘤维持时间分别为给药后4~18 d和给药后4~7 d)。见Fig 1。
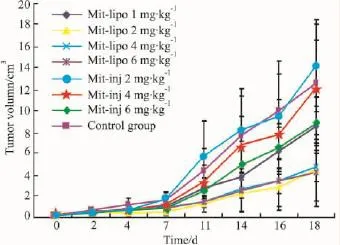
Fig 1 Effect of Mit-lipo on tumor volumn of RM-1
2.3 犬单次静脉毒性试验 Mit-inj致死剂量为0.9 mg·kg-1。毒性表现为摄食减少,活动低下,便血,WBC、RBC、HGB 和 PLT 降低。0.9 mg·kg-1剂量动物死亡原因系肺重度水肿、出血、淤血以及心肌间质重度弥漫性出血,可能是由于药物使心功能降低后继发肺水肿和出血引起的。Mit-lipo最大耐受剂量(MTD)为2.0 mg·kg-1,致死剂量为3.0 mg·kg-1,毒性表现为轻微至中度的皮肤毒性,给药4周后皮肤毒性逐渐减轻。3.0 mg·kg-1剂量动物死亡原因为肺部弥漫性肺水肿、出血、淤血,可能是由于药物使心功能降低后继发肺淤血和肺水肿引起的。
2.4 大鼠16周毒性试验 Mit-inj对SD大鼠的毒性靶器官是肾脏和骨髓,表现为以肾小球变性萎缩,肾小管扩张伴管型,肾间质反应性炎症伴纤维化为主的重症肾炎,以及中度到重度的骨髓增生抑制;并由于肾脏和骨髓毒性导致动物在第3次给药后第4周动物全部死亡。Mit-lipo主要毒性反应为皮肤毒性(四肢肿胀,溃烂,脱毛),和骨髓毒性(表现为血液学改变:WBC、RBC、HB、HCT和 PT值下降,MCV、MCH和MPV值升高),试验中没有观察到肾毒性,也没有发现与空白脂质体相关的副作用。
2.5 犬16周毒性试验 整个试验期间未见动物死亡。Mit-lipo的MTD为0.45 mg·kg-1,所有给药组动物体重增长情况,摄食、体温、ECG、眼科检查、血清生化指标、尿粪和骨髓涂片检查均未见与药物相关的副作用。Mit-lipo 0.1、0.3、0.45 mg·kg-1剂量对犬的主要毒性靶器官为皮肤和睾丸。皮肤毒性主要表现为四肢、颌下、腹部脱毛、红斑、渗出、结痂、溃疡等征状的轻微至轻度的皮肤毒性反应,其严重程度与剂量及重复给药有关。睾丸毒性表现为双侧睾丸曲精小管上皮不同程度的变性萎缩坏死,至恢复期末未见明显恢复。
Mit-inj组在第2次给药后2周和末次给药后2周♀动物可见WBC和PLT值明显降低,♂动物可见RBC、HB、HCT、WBC和 PLT明显降低,至恢复期末恢复正常。相同剂量的Mit-lipo在第2次给药后2周仅见♂动物HB轻微降低,末次给药后2周♀动物可见WBC降低,♂动物可见RBC、HB和HCT降低,降低的程度均较Mit-inj给药组小,至恢复期末恢复正常。
3 讨论
抗肿瘤药物脂质体治疗效果的改善依赖于药物的靶向效率和释药速率的交互作用[6],已有研究资料表明盐酸米托蒽醌制成脂质体后体内的药动学参数和组织分布均发生了改变[7],使其具有了体内长循环特点和明显的肿瘤组织靶向性,因此Mit-lipo血液中药物维持时间延长,在正常组织的分布减少,而在肿瘤组织的蓄积量增加,这与本研究中Mit-lipo对小鼠肝癌H22和小鼠前列腺癌RM-1的抑瘤作用提高相一致。
米托蒽醌为细胞周期非特异性细胞毒药物,临床应用中表现出极大的毒副作用,特别是骨髓抑制及心脏毒性大大限制了其临床用量[8]。本研究显示大鼠长期给药Mit-inj可引起中度到重度的骨髓增生抑制而使动物全部死亡,相同剂量的Mit-lipo仅引起半数动物表现胸骨骨髓增生抑制现象,且恢复期末恢复正常。犬长期毒性试验中以红细胞、白细胞和血小板数量减少来评价骨髓毒性,Mit-lipo给药组较Mit-inj对犬的骨髓毒性轻微。米托蒽醌在临床对心血管的毒性表现为充血性心力衰竭、心动过速等[9],本研究没有观察到 Mit-inj和 Mit-lipo的心毒性表现,可能是给药剂量偏低所致。大鼠长毒试验发现Mit-inj表现明显的肾毒性,而相同剂量的Mit-lipo没有观察到肾毒性。之前研究表明[7]相同给药剂量下Mit-lipo和Mit-inj在肾脏中的Cmax分别为(7.09±0.50)mg·kg-1和(18.55±2.45)mg·kg-1,说明米托蒽醌制成脂质体后在肾脏中的分布明显降低,所以毒性减轻。并且临床使用中也未见米托蒽醌致肾脏毒性的有关报道,因此可以认为肾脏不是米托蒽醌的主要靶器官。
Mit-lipo副作用的主要表现是皮肤毒性,主要发生在动物的四肢和腹部,损害程度从轻微到中度。大鼠和犬皮肤毒性一般在初次给药后1~2周时开始出现,在试验结束时皮肤毒性都能可逆性恢复。皮肤毒性的发生和严重性与临床连续或长期接受细胞毒类抗癌药物所致的手足综合症相似,阿霉素制成脂质体后也可剂量依赖性的引起皮肤毒性[10],其严重程度与剂量强度(给药间隔和剂量水平)有关,较低的给药剂量和较长给药间隔可降低皮肤毒性的损害程度,临床上可通过精心设计给药方案而降低毒性症状。因此,Mit-lipo引起的皮肤毒性在临床中可以通过减小给药剂量和(或)延长给药间隔来改善。
综合以上研究结果,与米托蒽醌普通制剂相比,本课题组所研制的米托蒽醌脂质体注射液在提高疗效的同时还大大降低了毒性,可以更大剂量的被使用,将是一个极具开发潜力的药物。
[1] Kroger N,Damon L,Zander A R,et al.Secondary acute leukemia following mitoxantrone-based high-dose chemotherapy for primary breast cancer patients[J].Bone Marrow Transplant,2003,32(12):1153-7.
[2] 符民桂,刘乃奎,唐朝枢.脂质体靶向性的研究进展[J].中国药理学通报,1999,15(1):18-21.
[2] Fu M G,Liu N K,Tang C S.Progress in study on targeting of liposome[J].Chin Pharmacol Bull,1999,15(1):18-21.
[3] Gabizon A,Shmeeda H,Barenholz Y.Pharmacokinetics of pegylated liposomal doxorubicin:review of animal and human studies[J].Clin Pharmacokinet,2003,42(5):419-36.
[4] Immordino M L,Dosio F,Cattel L.Stealth liposomes:review of the basic science,rationale,and clinical applications,existing and potential[J].Int J Nanomed,2006,1(3):297-315.
[5] Li C L,Cui J X,Wang C X,et al.Lipid composition and grafted PEG affect in vivo activity of liposomal mitoxantrone[J].Int J Pharm,2008,362(1-2):60-66.
[6] Cui J X,Li C L,Guo W M,et al.Direct comparison of two pegylated liposomal doxorubicin formulations:is AUC predictive for toxicity and efficacy[J]?J Control Release,2007,118(2):204-15.
[7] 王彩霞,李春雷,赵 曦,等.盐酸米托蒽醌脂质体的药效学、药动学及组织分布[J].药学学报,2010,45(12):1565-9.
[7] Wang C X,Li C L,Zhao X,et al.Pharmacodynamics,pharmacokinetics and tissue distribution of liposomal mitoxantrone hydrochloride[J].Acta Pharm Sin,2010,45(12):1565-9.
[8] Dunn C J,Goa K L.Mitoxantrone:a review of its pharmacological properties and use in acute nonlymphoblastic leukaemia[J].Drugs Aging,1996,9(2):122-47.
[9] Marriott J J,Miyasaki J M,Grouseth G,et al.Evidence Report:The efficacy and safety of mitoxantrone(Novantrone)in the treatment of multiple sclerosis:Report of theTherapeutics and Technology Assessment Subcommittee of the American Academy of Neurology[J].Neurology,2010,74(18):1463-70.
[10] Von Moos R,Thuerlimann B J,Aapro M,et al.Pegylated liposomal doxorubicin-associated hand-foot syndrome:Recommendations of an international panel of experts[J].Eur J Cancer,2008,44(6):781-90.
