甲基橙的催化氧化降解工艺研究
张金涛,曹桂萍,刘宝亮,壮亚峰
(常州工学院化工系,江苏 常州 213022)
纺织印染废水具有水量大、有机污染物含量高、碱性大、水质变化大等特点,废水中含有染料、浆料、助剂、油剂、酸、碱、纤维杂质、砂类物质、无机盐等,属难处理的工业废水之一[1]。印染废水中的污染物质,主要来自纤维材料、纺织用浆料和印染加工所使用的染料、化学试剂、表面活性剂和各类整理剂,其可生化性差,而染料结构的高稳定性,给脱色处理增加了难度[2,3]。印染废水的处理方法主要有物化法、高级氧化法和生物法等[4]。在高级氧化法中,采用光敏化半导体材料来催化降解印染废水成为近年来国内外研究的热点。其中,对TiO2及其复合氧化物的光催化性能研究较多[1,5~7]。在紫外光的照射下,TiO2与H2O产生强氧化能力的HO·,可使有机污染物完全降解为CO2、H2O等[8]。由于紫外光对不透明的废水溶液的穿透能力较低,严重影响了TiO2的光催化性能。因此,出现了超声波辅助纳米TiO2降解印染废水的新技术[8~12],超声波产生的空化作用有效提高了TiO2对有机污染物的催化降解作用。
NiO作为重要的p型半导体材料,广泛应用于催化剂、气敏传感材料、电池电极、光电材料、电化学电容器等领域[13,14]。纳米NiO的制备方法有化学沉淀法[15,16]、电化学和溶胶-凝胶综合法[17]、水热法[18]及固相法[19]等。在纳米NiO催化性能的研究中,有采用光照来提高纳米NiO的催化氧化能力[18,20~22],也有在无光照条件下用纳米NiO作为催化剂对有机物进行降解[17,23]。这表明,纳米NiO在有无光照的情况下均对有机污染物具有一定的催化降解作用。但采用超声波与纳米NiO协同催化降解印染废水中有机污染物的研究尚未见报道。
作者在此采用沉淀法制备纳米NiO,分别在单一实验条件(紫外光照射、超声波辐射和纳米NiO催化)和复合实验条件(紫外光照射+超声波辐射、紫外光照射+纳米NiO催化、超声波辐射+纳米NiO催化、紫外光照射+超声波辐射+纳米NiO催化)下研究了模拟印染废水甲基橙溶液的催化氧化降解过程。
1 实验
1.1 试剂与仪器
可溶性淀粉,分析纯,上海化学试剂厂;甲基橙,分析纯,上海试剂三厂;Ni(Ac)2·4H2O,分析纯,国药集团化学试剂有限公司;氨水,分析纯,丹阳市永丰化学试剂厂。
78-1型磁力加热搅拌器;D/max 2500 PC型X-射线衍射仪(XRD),日本;SX-4-10型马弗炉;723型紫外可见分光光度计;KH-500B型超声波清洗器(40 kHz,500 W);WFH-204A型交直流手提紫外灯(紫外光波长为254 nm)。
1.2 纳米NiO的制备
参照文献[24]进行纳米NiO的制备。将2.0 g淀粉加入40 mL蒸馏水中,磁力搅拌2 h得到乳白色的悬浊液。将该悬浊液与20 mL 0.2 mol·L-1的醋酸镍溶液混合,强烈磁力搅拌5 h。滴加5%(质量分数)氨水,将上述混合溶液的pH值调至9,此时混合物中生成浅绿色的Ni(OH)2。加热混合物至糊状,然后将糊状物置于100℃的干燥箱内烘干。充分研磨后,于400℃马弗炉中煅烧4 h,即得纳米NiO。
1.3 模拟印染废水甲基橙溶液的催化氧化降解
分别取150 mL 12 mg·L-1模拟印染废水甲基橙溶液于烧杯中进行以下7种降解实验,每隔30 min取样(如需要立即进行离心分离),在甲基橙溶液的最大吸收波长处测定其吸光度。实验持续6 h,实验过程中保持甲基橙溶液温度为40℃。
(1)甲基橙溶液进行紫外光照射。
(2)甲基橙溶液置于超声波清洗器中进行超声处理。
(3)向甲基橙溶液加入0.3 g纳米NiO催化剂,置于磁力搅拌器上搅拌。
(4)取甲基橙溶液置于超声波清洗器中进行超声处理,同时进行紫外光照射。
(5)将0.3 g纳米NiO加入甲基橙溶液中,进行紫外光照射。
(6)将0.3 g纳米NiO加入甲基橙溶液中,进行超声处理。
(7)将0.3 g纳米NiO加入甲基橙溶液中,进行超声处理和紫外光照射。
甲基橙降解效果采用溶液脱色率(D)进行评价:
(1)
式中:A0为降解前吸光度;At为降解t时间的吸光度。
2 结果与讨论
2.1 甲基橙溶液最大吸收波长的确定
分别配制浓度为12 mg·L-1和18 mg·L-1的甲基橙溶液,在400~500 nm的波长范围内进行紫外可见光光谱扫描,结果见图1。
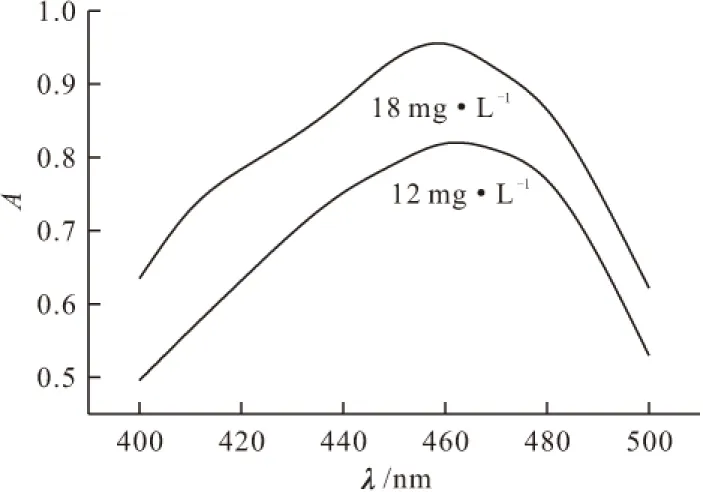
图1 甲基橙溶液的紫外可见吸收光谱
由图1可知,两种浓度的甲基橙溶液的最大吸收波长均约为460 nm。表明浓度对甲基橙溶液的最大吸收波长没有影响,仅使吸光度产生差异,12 mg·L-1甲基橙溶液的吸光度为0.819,而18 mg·L-1的为0.955。
2.2 纳米NiO的XRD分析
400℃煅烧所得纳米NiO样品的XRD图谱见图2。XRD测量条件:Cu靶,石墨片滤波,管压40 kV,电流100 mA,波长0.154056 nm。
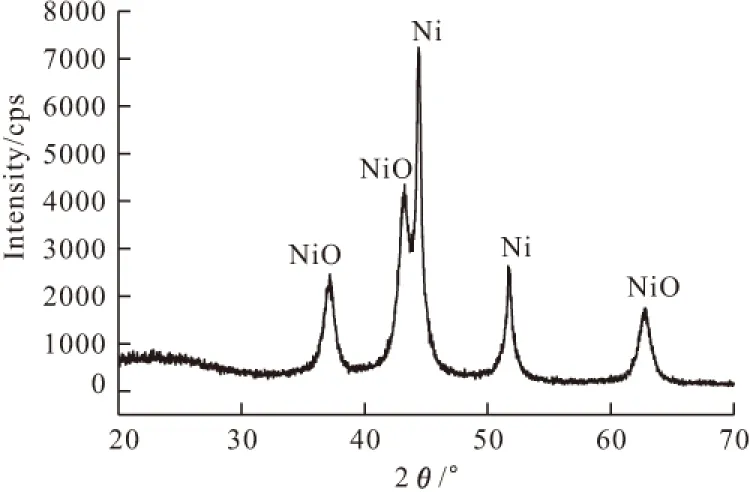
图2 纳米NiO的XRD图谱
通过与JCPDS卡对比,确认图2中2θ为37.16°、43.22°和62.84°的衍射峰代表NiO的衍射峰;2θ为44.40°和51.72°的衍射峰被确认为Ni的衍射峰。Ni的出现可能是由于在Ni(OH)2的煅烧过程中因氧气量不足,导致淀粉中的碳生成单质碳或一氧化碳,其具有还原性,从而使二价镍还原为单质。由于单质镍的存在,必将导致催化剂的性能有所下降。
根据Scherrer公式,计算得到NiO晶粒尺寸分布在11.5~23.5 nm范围内。
2.3 单一实验条件下甲基橙的降解
按1.3中(1)~(3)进行甲基橙溶液在紫外光照射、超声波辐射和纳米NiO催化3种单一实验条件下的降解实验,降解率随时间的变化曲线见图3。

图3 3种单一实验条件下甲基橙溶液的降解率
由图3可以看出,在3种单一实验条件下,超声波辐射对甲基橙溶液的降解效果最差,降解6 h,仅有少量甲基橙分子被破坏,降解率从0.24%升高至1.10%,表明单独采用超声波辐射催化降解甲基橙溶液效果甚微。紫外光照射对甲基橙溶液的降解效果不甚显著,降解6 h,降解率仅升高至3.05%,且在降解的前3.5 h,紫外光照射和超声波辐射的降解率十分相近,说明紫外光照射还不足以破坏偶氮类化合物分子的结构。在甲基橙溶液中加入0.3 g纳米NiO催化剂后,降解率随降解时间的延长不断升高,降解4.5 h后,降解率升幅不明显,降解6 h的降解率为4.76%,说明纳米NiO作为甲基橙的降解催化剂,即使在无光照条件下仍具有一定的催化效果。
总体而言,甲基橙溶液在紫外光照射、超声波辐射和纳米NiO催化3种单一实验条件下的降解率均未获得令人满意的效果。
2.4 复合实验条件下甲基橙的降解
按1.3中(4)~(7)进行甲基橙溶液在复合实验条件下的降解实验,降解率随时间的变化曲线见图4。
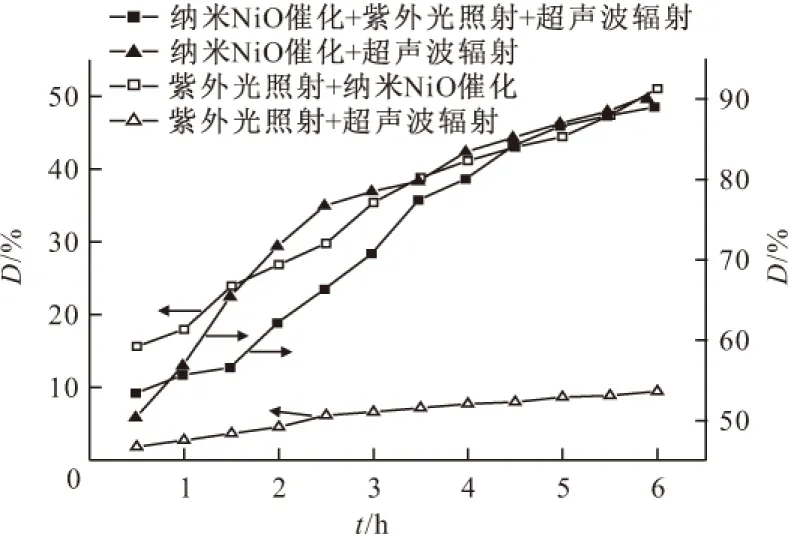
图4 4种复合实验条件下甲基橙溶液的降解率
由图4可以看出,在紫外光照射+超声波辐射作用下,甲基橙溶液的降解效果较单独进行紫外光照射或超声波辐射显著提高,降解6 h,其降解率升高至9.44%,说明超声波辐射和紫外光照射具有良好的协同作用,有利于甲基橙分子的破坏。而在纳米NiO催化剂存在的情况下,紫外光照射发挥了更好的催化降解作用,甲基橙溶液降解率显著升高到51.04%,与文献报道[18,20~22]基本一致。在纳米NiO催化剂存在的情况下,超声波辐射对甲基橙的催化降解具有显著增强效果,降解6 h,甲基橙溶液降解率达到90.71%。虽与文献[10]报道的采用TiO2为催化剂结合超声催化降解甲基橙溶液可达98%的降解率还存在差距,但考虑到纳米NiO催化剂的纯度所带来的影响,此降解率已令人满意。在此基础上,采用纳米NiO催化+紫外光照射+超声波辐射对甲基橙进行催化降解,其效果并未得到进一步提高,只是在降解0.5 h内,降解率略高于纳米NiO催化+超声波辐射。
2.5 纳米NiO催化降解甲基橙的机理分析
NiO在无光照情况下对甲基橙分子具有一定的催化降解作用,在此过程中甲基橙分子首先吸附在催化剂微粒表面,然后被催化剂降解为无色小分子[18]。而在光照条件下,纳米NiO的满带电子被激发,跃迁至导带,从而产生相应的电子-空穴。光生电子的捕获剂主要为NiO表面的吸附氧,有效抑制光生电子与空穴的复合[18,21]。催化剂表面产生的空穴与溶液中H2O作用生成·OH,破坏甲基橙的分子结构。
关于超声波与半导体光催化剂协同对有机污染物进行降解的作用机制,目前存在两种观点[10~12]:声致发光机理与高热激发机理。当超声波作用于水分子时,发生如下反应:
·OH+·OH →H2O2
·H+O2→ ·HO2
·HO2+O2→H2O2
·HO2+·HO2→H2O2+O2
反应产生的高活性·OH、·H及强氧化性的H2O2等将有机物氧化降解为CO2和H2O等无机小分子,而半导体材料NiO的存在可促进这些物质的产生,从而有效提高有机污染物的降解效率。
3 结论
在单一实验条件(紫外光照射、超声波辐射、纳米NiO催化)和复合实验条件(紫外光照射+超声波辐射、紫外光照射+纳米NiO催化、超声波辐射+纳米NiO催化、紫外光照射+超声波辐射+纳米NiO催化)下,对模拟印染废水甲基橙溶液的催化氧化降解过程进行了研究。结果表明,在单一实验条件下,甲基橙溶液的降解效果不明显,6 h后仅有少量甲基橙分子发生降解;采用超声波辅助纳米NiO催化降解甲基橙溶液,取得良好的效果,表明超声波可显著提高纳米NiO对甲基橙的催化降解作用;在超声波辅助纳米NiO催化降解甲基橙的过程中,增加紫外光照射并未能进一步提高纳米NiO的催化降解作用。
[1] 罗洁,陈建山,程凯英.TiO2光催化氧化降解印染废水的研究[J].应用化工,2004,33(5):24-26.
[2] 王振东,张志祥.印染废水的污染与控制[J].环境科学与技术2001,24(1):19-23.
[3] 单国华,贾丽霞.印染废水处理方法及其研究进展[J].广西轻工业,2007,23(4):75-77.
[4] 严永红,任洪强,王晓蓉,等.印染废水深度处理及回用技术的研究进展[J].工业水处理,2004,24(11):16-19.
[5] 王成国,邓兵.纳米TiO2光催化氧化处理直接耐晒翠蓝染色废液[J].印染,2004,30(7):10-12.
[6] Linsebiger A L,Lu Guangguan,Yates J T. Photocatalysis on TiO2surfaces:Principle,mechanisms,and selected results[J]. Chem Rev,1995,95(3):735-758.
[7] 王九思,赵红花.负载型纳米TiO2光催化降解活性艳红X-3B染料[J].应用化学,2002,19(8):792-794.
[8] 李凡修,陆晓华,梅平.TiO2催化超声波降解钻井污水中CODCr技术研究[J].工业水处理,2007,27(4):35-37,40.
[9] 刘振荣,李红,王君,等.TiO2催化超声降解亚甲基蓝溶液[J].化学研究,2005,16(1):69-71.
[10] 王君,张向东,李绮,等.SiO2掺杂TiO2催化超声降解甲基橙溶液[J].化学研究,2004,15(1):12-15.
[11] 程欣,吴胜举,张宁宁.超声催化二氧化钛深度处理染料废水[J].工业安全与环保,2006,32(11):1-3.
[12] 任百祥,孙淑波.Fe2O3掺杂TiO2催化超声降解染料工业废水的研究[J].工业水处理,2010,30(8):36-39.
[13] 赵晓华,安娜,王晓兵,等.纳米氧化镍研究进展[J].无机盐工业,2007,39(7):1-4.
[14] 张煜,邱运仁.纳米氧化镍的制备与应用[J].化学工业与工程技术,2009,30(2):51-54.
[15] 李冬丽,崔鹏.沉淀转化法制备NiO催化剂及其催化性能研究[J].应用化工,2008,37(8):902-905.
[16] 李建芬,肖波,晏蓉,等.均匀沉淀法制备纳米氧化镍及其工艺优化[J].化学工程,2007,35(8):53-56.
[17] 周幸福,韩爱杰,褚道葆,等.非水体系中电解镍中间产物制备纳米NiO[J].物理化学学报,2002,18(7):613-616.
[18] 娄向东,楚文飞,韩珺,等.水热法制备片状纳米氧化镍及其光催化性能[J].水处理技术,2007,33(11):23-27.
[19] 王艳萍,朱俊武,张莉莉,等.纳米NiO的制备及其谱学特性研究[J].光谱学与光谱分析,2006,26(4):690-693.
[20] 娄向东,楚文飞,韩珺,等.氧化镍纳米片光催化降解蒽醌染料B-RN的研究[J].环境科学与技术,2007,30(8):83-85.
[21] 郭丽华,丁士华,杨晓静,等.锂掺杂氧化镍光催化剂的制备与性能研究[J].材料导报,2010,24(Z1):141-143.
[22] 张建英,杨合情,杨瑞丽,等.金属镍基质上直立六边形NiO纳米片的制备与光催化性能[J].科学通报,2007,52(17):2015-2020.
[23] 高建峰,徐春彦,白婷婷.NiO/活性炭催化氧化降解水中LAS研究[J].河南化工,2008,25(4):20-23.
[24] 陈勇平.利用多糖制备无机纳米材料及其性能研究[D].南京:南京航空航天大学,2007.

