表阿霉素联合紫杉醇在局部晚期乳腺癌新辅助化疗治疗中的临床疗效分析
汪全新
(红安县人民医院,湖北 红安 438500)
乳腺癌是常见的一种女性恶性肿瘤,随着生活方式的改变,发病率有升高趋势。大部分的局部晚期乳腺癌已经出现转移,其中约一半转移病灶为微小灶,不仅使得手术难度增加,也会因病灶较小而不易被彻底切除降低手术成功率。有文献报道[1],手术治疗前给予表阿霉素(EPB)联合紫杉醇(Taxus brevifolia,TB)进行辅助化疗能较为有效地解决这个问题。现将我院采取EPB联合TB对局部晚期乳腺癌进行新辅助化疗的情况报道如下。
1 材料与方法
1.1 一般资料
收集2008年5月—2011年2月我院收治局部晚期乳腺癌病例127例,全为女性,平均年龄(49.6±9.2)岁(38.4~67.5岁)。其中,绝经者72例,未绝经者55例。乳腺癌的临床分期:0~I期55例(43.3%),Ⅱ期47例(37.0%),Ⅲ期25例(19.7%)。入院前均经CR数字化乳腺高频钼靶X线检查和粗穿刺针组织学病理检查,确诊为乳腺癌患者,入选前均给予超声检查、X线检查、骨扫描检查及肝肾功能检查等评估全身情况。
1.2 方法
1.2.1 给药方法
全部病例均采用ET方案:EPB(辉瑞制药公司)40mg/m2(静脉滴注,第1、2天),TB175mg/m2(持续静脉滴注3h,第1天),以21d为1个疗程。化疗3周后评估效果。化疗前一天起预防性使用地塞米松,共3天。
1.2.2 疗效及不良反应评定
依据超声检查、CR数字化乳腺高频钼靶检查及粗穿刺针组织学病理检查等结果,结合WHO实体瘤评定标准进行疗效评价[2],以病灶完全消失为完全缓解(CR),以病灶缩小≥50%为部分缓解(PR),以病灶缩小<50%或扩大≤25%为病情稳定(SD),以病灶扩大>25%或出现新的病灶为病情进展(PD)。
2 结果
2.1 TB与EPB联合化疗效果 见表1。
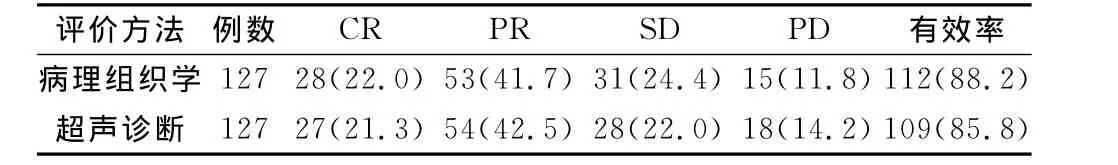
表1 新辅助化疗疗效评价 [n(%)]
2.2 TB与EPB联合化疗不良反应
TB与EPB联合化疗不良反应见表2。
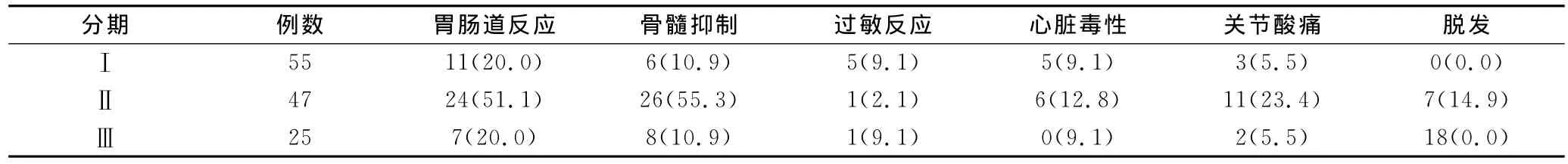
表2 TB与EPB联合化疗不良反应 [n(%)]
3 讨论
大多数被确诊的乳腺癌患者已有远处转移,对于伴有微转移灶的患者,如给予强行手术,手术的范围常需要扩大,更可因部分病灶不能被切除而达不到临床根治目的。新辅助化疗又称诱导化疗,是指在局部治疗(手术或放疗)之前给予的全身化疗,具有如下优势[3]:①新辅助化疗可降低癌组织的病理分期,进而降低手术难度而提高根治术和保乳术的成功率;②新辅助化疗可杀死部分微转移灶内的癌细胞,减少术前癌细胞的分裂活性,降低术后癌细胞转移率或化疗耐药性的发生率等。EPB是一种抗生素类抗肿瘤药,通过抑制癌细胞DNA聚合酶而阻滞其核酸的合成来达到抗癌的作用。其相对于其他蒽环类药物,抗癌的活性更高,但化疗期间的不良反应较低[4]。TB可以促进微管聚合并稳定已聚合的微管,使接触到它的细胞内产生道理的微管,进而影响细胞的功能,尤其处于分裂期的细胞。它不仅可以使细胞停滞于有丝分裂期阻止正常分裂,同时还具有诱导肿瘤细胞凋亡和抗肿瘤血管生成的作用。因此,EPB联合TB联合可起到协同治疗效果。本组资料显示,127例患者中,病理组织学诊断完全缓解占88.2%,部分患者治疗过程中并发不良反应,化疗停止不久后症状逐渐缓解。
总之,EPB联合TB的辅助化疗方案治疗局部晚期乳腺癌有效率较高,术后不良反应均可耐受,有着一定临床应用价值。
[1]SAKORAFAS GH,SAFIOLEAS M.Breast cancer surgery:an historical narrative.Part 1.From prehistoric times to Renaissance[J].Eur J Cancer Care(Engl),2009,18(6):530-544.
[2]刘志洋,张瑾.新辅助化疗TE与CEF方案治疗乳腺癌的临床效果比较[J].中华乳腺病杂志,2009,2(1):18-23.
[3]刘慧,张恒伟,崔树德.新辅助化疗在乳腺癌保乳手术中的应用分析[J].中国误诊学杂志,2007,7(21):4981-4982.
[4]RIGAS JR,DRAGNEV KH,BUBIS JA.Docetaxel in the treatment of esophageal cancer[J].Semin One,2005,32(4):39-51.

