鸡血藤提取物中缩合鞣质的含量测定及其抗肿瘤活性初步研究*
程 悦,符 影,王志宇,杨得坡,陈建萍,王冬梅
(1.中山大学药学院,广东 广州 510006;2.香港大学中医药学院,香港)
鸡血藤为豆科密花豆属植物密花豆SpatholobussuberectusDunn.的干燥藤茎。中医认为其具有补血、活血、通络之功效,临床上常用鸡血藤治疗贫血、各种原因(如放疗、化疗)引起的白细胞、血小板、红细胞等全血象减少和再生障碍性贫血等疾病,具有较好的疗效[1]。此外,现代药理学研究证明,它还有抗肿瘤、抗病毒、免疫调节、抗炎、抗氧化、镇静催眠等作用[2]。迄今为止,从鸡血藤中发现的化合物结构类型主要有黄酮类、萜类、甾醇类、蒽醌类、内酯类、挥发油类等类型的化合物,近年来,对鸡血藤的化学成分研究主要集中在黄酮类化合物[3-11],而其他结构类型的化合物研究较少。
经过对鸡血藤/φ=60%醇提物化学成分系统预试试验,发现除黄酮类、萜类、蒽醌及其苷、香豆素及其苷、酚类化合物的系统预试结果为阳性外,缩合鞣质的特征反应结果也为阳性,但已有文献中并无任何关于鸡血藤中含有缩合鞣质类成分的报道。
缩合鞣质,又称为原花青素,是一类广泛存在于植物界的多酚类物质。缩合鞣质由儿茶素或没食子酸儿茶素等黄烷-3-醇类化合物以碳-碳键聚合而形成的化合物,通常三聚体以上才具有鞣质的性质,根据其黄烷-3-醇结构的差别分为procyanidins和prodelphinins。缩合鞣质具有多种显著的生物活性,其抗氧化和抗癌活性的研究已备受关注[12]。
故本论文对鸡血藤/φ=60%醇提物及其不同极性溶剂萃取部位中的缩合鞣质及总黄酮含量进行测定,同时考察了各萃取物对肿瘤细胞增殖的抑制活性,可对鸡血藤抗肿瘤活性部位的制备提供科学依据。
1 材料与仪器
1.1 供试材料
鸡血藤药材,产地广西,购自香港大学中医药学院临床教研中心大药房,经中山大学药学院生药学与天然药化实验室杨得坡教授鉴定为豆科密花豆属植物密花豆(SpatholobussuberectusDunn)的藤茎。
1.2 实验试剂与仪器
TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司),酶联免疫检测仪ELK-800型(Bio-Tek),倒置显微镜(TS100F,日本NIKON公司),HPLC色谱仪: LC-20AB泵、SIL-20A自动进样器、SPD-M20A 二极管阵列检测器(日本岛津公司),Ultimate AQ-C18色谱柱(5 μm, 4.6 mm×250 mm,美国Welch公司),Millipore超纯水系统,通用水套CO2培养箱(美国Thermo公司)。
DMEM培养基、1640 培养基(美国Gibco 公司),胎牛血清(FBS)(美国Hyclone 公司),四甲基噻唑蓝(MTT)、dm5825抗生素(青、链霉素)、儿茶素均购自美国Sigma 公司,芒柄花素(w> 99%,HPLC,西安慈缘生化科技有限公司),石油醚、乙酸乙酯、正丁醇、95%乙醇、甲醇、硫酸、香草醛为国产分析纯试剂。人乳腺癌细胞MCF-7和人结肠癌细胞HT-29均由香港大学中医药学院提供。
2 方法与结果
2.1 鸡血藤/醇提物及其各萃取部位的制备
将鸡血藤药材1.5 kg,经粉碎后,加入10倍φ=60%乙醇超声提取2次,每次1 h,减压回收溶剂后,得到鸡血藤/φ=60%醇提物(以下简称醇提物)约195 g。称取180 g醇提物均匀分散于适量的水溶液中,分别用等体积的石油醚、乙酸乙酯、正丁醇萃取,分别得石油醚萃取物、乙酸乙酯不溶物,乙酸乙酯萃取物,正丁醇萃取物和水层留余物,其结果如表1所示。
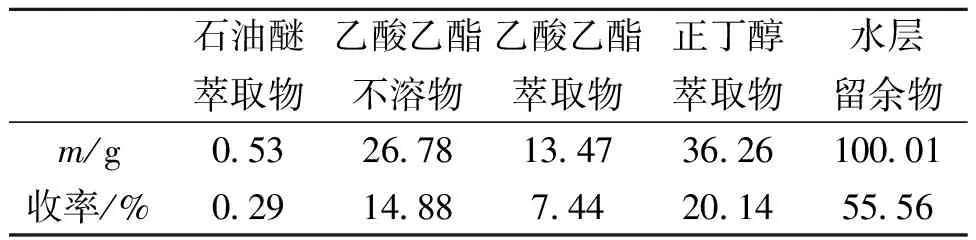
表1 鸡血藤醇提物各萃取部位的收率
2.2 鸡血藤醇提物及各萃取部位对肿瘤细胞增殖的抑制活性
采用噻唑兰(MTT)法测定鸡血藤醇提物及各个萃取部位对肿瘤细胞增殖的抑制活性。人结肠癌细胞HT-29培养在含RPMI1640培养液中(含100 mL/L加热灭活胎牛血清,青霉素,链霉素各10×105U/L),人乳腺癌细胞MCF-7培养在含DMEM培养液中(含100 mL/L加热灭活胎牛血清,青霉素,链霉素各10×105U/L),培养条件为37 ℃,φ=5% CO2,2~3 d换液1次。取对数生长期细胞进行实验。
分别取对数生长期的各细胞每孔100 μL接种于96孔板,细胞浓度为5×104/mL,培养24 h待细胞贴壁后,换无血清培养基,24 h后吸除旧培养基,再分别加入90 μL无血清培养基和10 μL 500 μg/mL的药液(含0.2% DMSO),使药液终浓度为50 μg/mL;空白对照组加入10 μL含0.2% DMSO的磷酸盐缓冲液,每组设6个平行孔,置于37 ℃、φ=5% CO2细胞培养箱中培养48 h。之后加入10 μL的5 mg/mL的MTT溶液,再培养4 h,弃去培养液,加150 μL DMSO,轻轻振荡15 min,待完全溶解显色后,用酶联免疫检测仪于540 nm波长下测每孔的吸光度A值,按照如下公式求出增殖抑制率,结果如表2所示。
抑制率=[(对照组平均A值-药物组平均A值) /对照组平均A值]×100 %
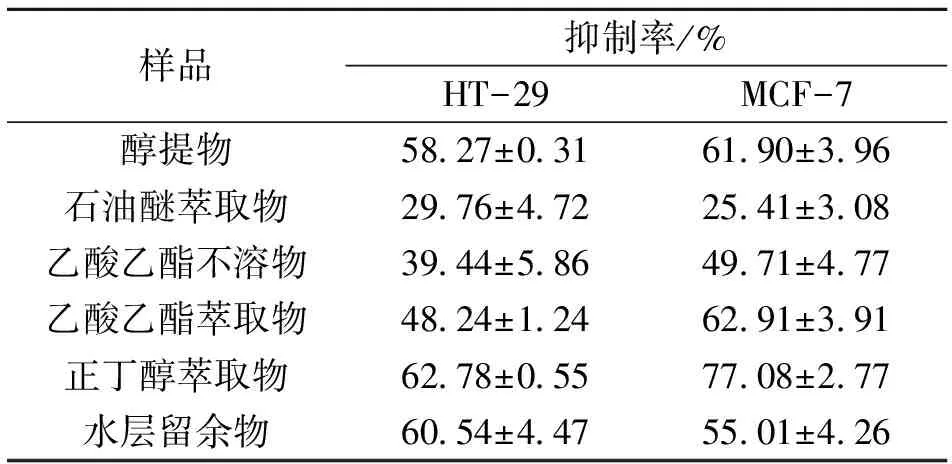
表2 鸡血藤/醇提物及各萃取部位对HT-29和MCF-7细胞增殖的抑制活性
2.3 鸡血藤醇提物及各萃取部位的高效液相色谱分析
以乙腈和水为流动相,乙腈浓度(φ)10%(0 min)-15%(10 min)-30%(35 min)-60%(45 min)-90%(60 min)-90%(70 min);流速1 mL/min;进样量20 μL;检测波长250 nm;结果如图1所示。鸡血藤/醇提物、乙酸乙酯不溶物、正丁醇萃取物有明显的“包峰”,表明其中可能含有大分子物质。
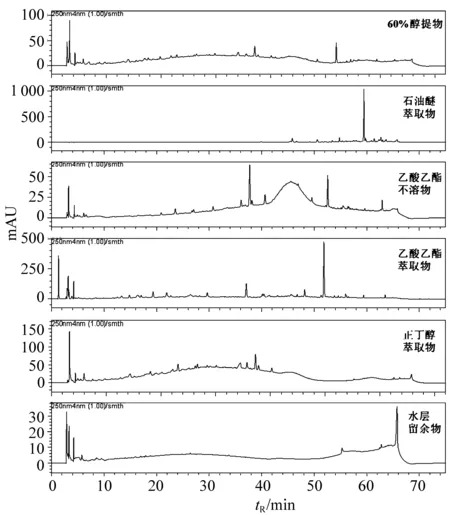
图1 鸡血藤醇提物及各萃取物的HPLC分析图谱(250 nm)
2.4 鸡血藤醇提物及各萃取部位总黄酮含量测定
由于鸡血藤中黄酮类化合物以芒柄花素的含量较高,故以其作为鸡血藤总黄酮含量测定的指标成分。在一定浓度范围内,芒柄花素的浓度与其最大吸收波长处的吸光度成正比,可以通过吸光度的测定来计算鸡血藤样品中总黄酮的浓度。由于鸡血藤/石油醚萃取物的收率很低且其对肿瘤细胞增殖抑制活性很弱,故不对其进行总黄酮和鞣质的含量测定。
2.4.1 对照品溶液的制备 精密称取芒柄花素对照品5.2 mg,用少量φ=95%乙醇溶解后置25 mL容量瓶中,并用φ=95%乙醇稀释至刻度,摇匀作为对照品储备液(0.208 mg/mL)。
2.4.2 检测波长的确定 将对照品溶液在200~800 nm范围进行扫描,在250 nm波长处有最大吸收,故选用250 nm作为测定波长。
2.4.3 供试品溶液的制备及测定 精密称取醇提取物和各萃取物样品各约1 mg, 置10 mL容量瓶中,加入φ=95% 乙醇 1 mL,超声溶解,用φ=95%乙醇稀释至刻度,摇匀,得供试液,用紫外分光光度法测定供试品溶液的A250,计算其中总黄酮的含量。
2.4.4 含量测定的方法学考察
1) 标准曲线和线性范围。
精密量取上述对照品储备液0.1、0.2、0.3、0.4、0.5 mL分别置于10 mL容量瓶中,分别加入φ=95%乙醇稀释至刻度,摇匀,在250 nm处测定吸收度。以对照品吸光度A250(Y)为纵坐标,以对照品溶液的浓度(X,μg/mL)为横坐标,绘制标准曲线。结果表明,总黄酮浓度在2.08~10.40 μg/mL范围内线性关系良好,回归方程为Y=0.116 9X+0.146 4,R2=0.999 9。
2)精密度试验。
精密吸取对照品储备液0.3 mL分别置于10 mL容量瓶中,加入φ=95%乙醇稀释至刻度,摇匀,连续测定6次A250, RSD为0.20%,表明仪器精密度良好。
3)重复性试验。
分别精密称取1 mg鸡血藤醇提物 6份,按照2.4.3项下制备供试液样品6份并分别测定A250,计算总黄酮含量均值为6.58%,RSD为1.69%,表明该方法重复性良好。
4)稳定性试验。
精密称取1 mg鸡血藤醇提物,按照2.4.3项下制备供试液样品,同一供试液分别于第0、1、2、4、8、16 h进行测定A250,共测定6次,RSD为0.65%,表明样品溶液在16 h内稳定性良好。
5)加样回收率试验。
称取0.5 mg已知总黄酮含量的鸡血藤醇提取物9份,分别加入相当于其含量120%(高浓度)、100%(中浓度)、80%(低浓度)的芒柄花素对照品溶液,每个浓度平行3份,按照2.4.3项下制备供试液样品9份,并分别测定A250,结果如表3所示,加样回收率为101.26%,RSD值为1.40%,表明该方法的准确度良好。

表3 总黄酮含量测定的加样回收率试验
2.4.5 鸡血藤醇提物及各萃取部位中总黄酮的含量测定 分别称取鸡血藤醇提物、乙酸乙酯不溶物、乙酸乙酯萃取物、正丁醇萃取物、水层留余物各3份,按照2.4.3项下制备供试液样品溶液,并分别测定A250,计算其中的总黄酮含量,结果显示,鸡血藤/醇提物、乙酸乙酯不溶物、乙酸乙酯萃取物、正丁醇萃取物、水层留余物的总黄酮含量分别为(6.49±1.99)%、(7.36±0.13)%、(9.35±0.22)%、(8.41±0.27)%、(4.48±1.53)%。
2.5 鸡血藤醇提物及各萃取部位缩合鞣质含量测定
采用香草醛硫酸法,酸性条件下,缩合鞣质A 环的化学活性较高,其上的间苯二酚或间苯三酚可与香草醛发生缩合,产物在浓酸作用下形成有色的正碳离子。采用分光光度法测其吸光度,根据标准曲线即可得到样品中缩合鞣质含量,硫酸作为反应过程的催化剂[13]。经过显色反应条件优化试验,最终确定香草醛甲醇溶液的体积浓度为3%,浓硫酸甲醇溶液的体积浓度为30%,避光显色20 min为反应条件。
2.5.1 对照品溶液的制备 精密称取儿茶素对照品52.59 mg置于50 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,为对照品贮备液(1.051 8 mg/mL)。
2.5.2 供试品溶液的制备 称取醇提取物和各萃取物样品各约2 mg,置于5 mL容量瓶中,加入甲醇,超声溶解后,用甲醇稀释至刻度,摇匀,为供试品溶液。
2.5.3 缩合鞣质含量测定方法 取供试品溶液0.5 mL,加入包有锡箔的试管中,分别加入2.5 mLφ=3%香草醛甲醇溶液和2.5 mLφ=30%浓硫酸甲醇溶液,摇匀,避光显色20 min后,在500 nm处测定吸光度A500。
2.5.4 缩合鞣质含量测定的方法学考察
1) 标准曲线和线性范围。
精密量取儿茶素对照品贮备液1、2、3、4、5 mL分别置于10 mL容量瓶中,分别加入甲醇稀释定容至刻度,摇匀,备用。分别取上述各浓度对照品溶液0.5 mL,按照2.5.3项下测定,以对照品溶液的浓度(X,mg/mL)为横坐标,吸光度值A500(Y)为纵坐标,进行回归分析。结果显示,儿茶素对照品浓度在0.105 2~0.525 9 mg/mL范围内与吸光度的线性关系良好,回归方程为Y=2.282 8X-0.119 9,R2=0.999 3。
2)精密度试验。
取对照品溶液0.5 mL,按照2.5.3项下测定,连续测定6次A500,RSD为0.19%,表明仪器精密度良好。
3)重复性试验。
精密称取2 mg鸡血藤醇提取物6份,按照2.5.2项下制备供试液,按照2.5.3项下测定A500,计算缩合鞣质含量均值为51.71%,RSD为2.06%,表明该方法重复性良好。
4)稳定性试验。
精密称取鸡血藤醇提取物2 mg,按照2.5.2项下制备供试液,同一供试品溶液分别于第0、1、2、4、8、16 h按照2.5.3项下测定A500,共测定6次,RSD为3.12%,表明样品溶液在16 h内稳定性良好。
5)加样回收率试验。
称取1.2 mg已知缩合鞣质含量的鸡血藤醇提取物9份,分别加入相当于其含量120%(高浓度)、100%(中浓度)、80%(低浓度)的儿茶素对照品溶液,每个浓度平行3份,按照2.5.2项下制备供试液样品9份,按照2.5.3项下测定A500,结果如表4所示,儿茶素的加样回收率为99.93%,RSD值为1.86%,表明该方法的准确度良好。
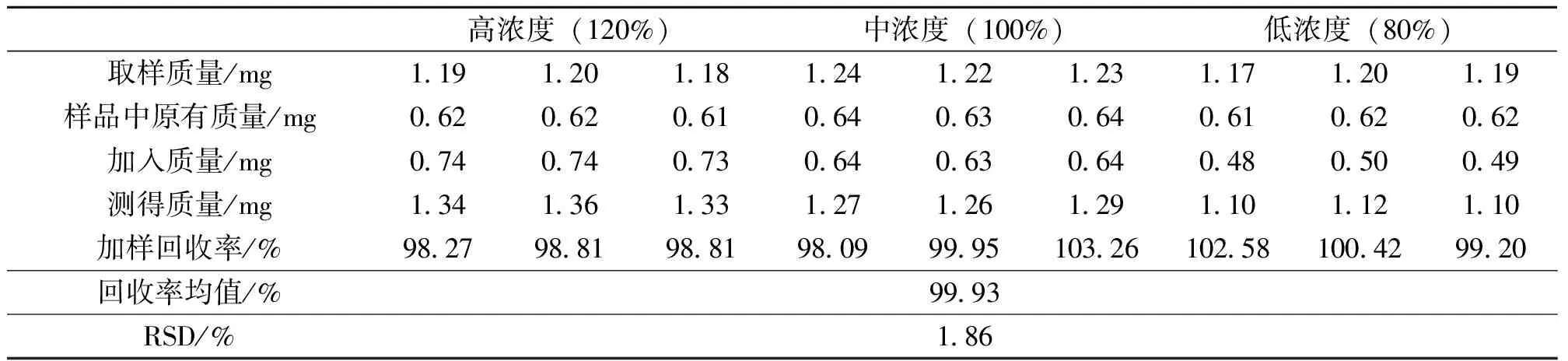
表4 缩合鞣质含量测定的加样回收率试验
2.5.5 鸡血藤醇提物及各萃取部位中缩合鞣质的含量测定 分别称取鸡血藤醇提物、乙酸乙酯不溶物、乙酸乙酯萃取物、正丁醇萃取物、水层留余物各3份,按照2.5.2项下制备供试液样品,按照2.5.3项下测定A500,结果显示,0.6 mg/mL鸡血藤醇提物、乙酸乙酯不溶物、乙酸乙酯萃取物、正丁醇萃取物、水层留余物的缩合鞣质含量分别为(51.09±0.37)%、(52.34±4.73)%、(73.22±2.72)%、(83.11±5.87)%、(29.74±2.12)%。
3 讨 论
由于缩合鞣质分子中含有较多的酚羟基,性质活泼,不稳定,容易氧化,形成极性更大聚合度更高的复杂多聚体,与其他天然产物相比,分离鉴定都有较大难度,其化学结构和组成复杂,但却有良好的生物活性。本论文首次报道中药鸡血藤中含有大量缩合鞣质类化合物,并对鸡血藤醇提物及各萃取部位的缩合鞣质和总黄酮含量进行了测定。
3.1 鸡血藤醇提物及各萃取物的总黄酮和缩合鞣质含量的差异
鸡血藤醇提物中,总黄酮含量为(6.49±1.99)%,缩合鞣质含量为(51.09±0.37)%,缩合鞣质的含量远远高于总黄酮。在各萃取部位中,总黄酮含量大小顺序为乙酸乙酯萃取物>正丁醇萃取物>乙酸乙酯不溶物>水层留余物,缩合鞣质含量的大小顺序为正丁醇萃取物>乙酸乙酯萃取物>乙酸乙酯不溶物>水层留余物。可知总黄酮及缩合鞣质均在正丁醇萃取物和乙酸乙酯萃取物中含量较高,其次是乙酸乙酯不溶物,说明经过萃取,鸡血藤中的黄酮类化合物和缩合鞣质得到了一定程度的富集。
3.2 鸡血藤抗肿瘤物质基础的研究
鸡血藤化学成分复杂,药理作用多样,多年来对其研究主要围绕鸡血藤刺激骨髓造血功能,对其抗肿瘤活性研究较少,近年来有文章报道鸡血藤粗提物及其黄酮分离产物SSCE在细胞水平和整体动物水平都表现出抗肿瘤活性[14-16],具体的作用机制至今仍未被阐明,物质基础亦不明确。本论文研究结果显示,鸡血藤/醇提物及各萃取物对两种肿瘤细胞的增殖均有一定程度的抑制活性,对MCF-7的抑制活性高于HT-29,其中正丁醇萃取物浓度为50 μg/mL时对MCF-7肿瘤细胞增殖的抑制活性明显高于其它萃取物,抑制率为77.08%,且其缩合鞣质含量高达83.11%,说明除了黄酮类化合物之外,缩合鞣质也可能是其发挥抗肿瘤作用的药效物质基础。正丁醇萃取物总黄酮和缩合鞣质含量均较高,且对肿瘤细胞增殖抑制作用强,可作为鸡血藤抗肿瘤的有效部位,为下一步抗肿瘤活性单体的获得提供了指导。
3.3 鸡血藤质量控制方法的研究
目前对鸡血藤药效物质基础的研究尚很薄弱,而药典中对鸡血藤的质量控制,只关注了芒柄花素单一化合物,因此鸡血藤药材现有的质量控制方法有着很大的局限性。本实验发现鸡血藤中缩合鞣质含量远高于其它类型化合物,同时,黄酮类成分被认为是鸡血藤的活性成分[2],因此本文通过建立鸡血藤中的总黄酮和缩合鞣质的含量测定方法,可为鸡血藤药材的质量控制提供一定的参考和依据。
参考文献:
[1]郑虎占. 中药现代研究与应用.鸡血藤[M].北京:学苑出版社,1997:2539.
[2]邓家刚, 梁宁, 周程艳,等.鸡血藤药效及作用机理研究进展[J].广西中医药, 2006, 29(6): 311-313.
[3]崔艳君, 刘屏, 陈若芸,等.鸡血藤的化学成分研究[J].药学学报,2002,37(10):784-787.
[4]郑岩,刘桦, 白焱晶,等.鸡血藤黄酮类化合物的研究[J].中国中药杂志,2008,33(2):251-253.
[5]崔艳君, 刘屏, 陈若芸,等.鸡血藤有效成分研究[J].中国中药杂志,2005,30(2):121-123.
[6]YOON J S, SUNG S H, PARK J H, et al. Flavonoids from Spatholobus suberectus[J]. Archive of Pharmacal Research, 2004, 27(6): 589-582.
[7]LEE M H, LIN Y P, HSU F L, et al. Bioactive constituents ofSpatholobussuberectusin regulating tyrosinase-related proteins and mRNA in HEMn cells[J]. Phytochemistry, 2006, 67: 1262-1270.
[8]ZHANG S W, XUAN L X. New Phenolic Constituents from the stems ofSpatholobussuberectus[J]. Helvetica Chimica Acta, 2006, 89: 1241-1245.
[9]成军, 梁鸿,王媛,等.中药鸡血藤化学成分的研究[J].中国中药杂志,2003, 28(12): 1153-1154.
[10]严启新,李萍,胡安明,等.鸡血藤化学成分的研究[J].中草药,2003,34(10):876-878.
[11]严启新,李萍,王迪,等.鸡血藤脂溶性化学成分的研究[J].中国药科大学学报,2001, 32(5):336-338.
[12]TOSHIHIKO S, SAEKO M, NINA M, et al. Apple (Maluspumila) procyanidins fractionated according to the degree of polymerization using normal-phase chromatography and characterized by HPLC-ESI/MS and MALDI-TOF/MS[J]. Journal of Chromatography A, 2006, 1102(1-2): 206-213.
[13]孙芸,谷文英.硫酸-香草醛法测定葡萄籽缩合鞣质含量[J].生产与科研经验,2003,29: 43-46.
[14]唐勇, 王笑民, 何薇,等.鸡血藤提取物体外抗肿瘤实验研究[J].中国中医基础医学杂志, 2007, 13 (4) : 306-308.
[15]唐勇, 何薇, 王玉芝,等.鸡血藤黄酮类组分抗肿瘤活性研究[J].中国实验方剂学杂志, 2007,13 (2) : 51-54.
[16]薛丽君,韩景光,李定光,等.鸡血藤提取物的抗肿瘤作用研究[J].现代医药卫生, 2009, 25(1):3-4.

