Smad4通过 fascin和 cortactin影响肝癌细胞SMMC-7721迁移的研究
韩 香,黄晓丹,薛慧婷,黄 曙,张发明,季国忠
0 引 言
肝细胞肝癌(hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,在恶性肿瘤其致死率中占第 3位[1]。HCC初期症状不明显,早期诊断率较低,5年生存率小于 5%,往往确诊时多数已发展为中晚期,发生远处扩散转移[2]。因此,研究 HCC侵袭转移的发生机制,对改善肝癌患者预后、延长患者生存期,具有重要的意义。
肿瘤的侵袭、转移受多种因素的调控和影响,转化生长因子-β(transforming grow th factor-β,TGF-β)-Smad信号通路是其中一种重要的调控因素,Smad4分子是该信号通路中的关键效应分子,它与受体型的 Smad结合形成异源复合物,从而调控通路下游靶基因的表达[3-4]。近年来研究发现Smad4与多种肿瘤的发生、发展密切相关[3],在结肠癌、前列腺癌中 Smad4都有抑制肿瘤转移的作用[5-6],但其在肝癌转移中的作用及其机制的研究报道却较少。我们在体外培养人肝癌细胞 SMMC-7721,通过构建Smad4的 RNAi慢病毒载体,经包装、浓缩后感染肝癌细胞,验证 Smad4的干扰效率,观察干扰 Smad4表达后肝癌细胞迁移能力的变化,进一步通过检测细胞骨架相关蛋白 fascin和 cortactin表达的改变,探讨 Smad4对肝癌细胞迁移的影响及可能的分子机制,以期为进一步提高肝癌患者的治疗效果、改善预后提供依据。
1 材料与方法
1.1 材料 人肝癌细胞株 SMMC-7721和人胚肾细胞株 293T购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;慢病毒载体购自美国Tronolab公司;鼠抗人 Smad4单克隆抗体购自美国Santa Cruz公司;鼠抗人 fascin单克隆抗体购自美国Upstate公司;鼠抗人 cortactin单克隆抗体购自美国Cell Signaling Technology公司;小鼠抗大鼠 β-actin单克隆抗体和 HRP标记的羊抗鼠二抗购自武汉博士德公司;Matrigel胶购自美国 BD公司。
1.2 方法
1.2.1 细胞培养 人肝癌细胞株 SMMC-7721和人胚肾细胞株 293T,均以含 10%胎牛血清的高糖DMEM培养基,于 37℃、5%CO2培养箱中培养,胰酶消化、传代,取对数生长期细胞实验。
1.2.2 Smad4的 RNAi慢病毒载体的构建 根据Smad4基因序列,设计、合成 16对针对 Smad4基因的 RNA干扰序列,经退火形成双链 DNA,与双酶切后的 pMAGIC1.0载体连接,转化大肠杆菌 DH5a,挑取阳性克隆行 PCR鉴定。
1.2.3 慢病毒载体的包装和浓缩 取对数生长期的 293T细胞(密度为 3 ×105个 /ml)培养,细胞汇合达 70%~80%时转染。将慢病毒质粒溶液和病毒转染试剂溶液混合,加入培养皿中并混匀,37℃、3%CO2和 95%相对湿度培养箱中培养。8h后更换新鲜培养基,继续培养 24h后收集上清液,24h后再次收集上清液。将收取的上清液中加入 5 mol/L NaCl溶液至终浓度为 0.15mol/L和 20%体积的聚乙二醇 8000,4℃振荡过夜,4℃、10000×g离心 30 min后,弃去上清液加入适量OMEM溶解病毒沉淀,封口 4℃保存。
1.2.4 慢病毒滴度测定 取对数生长期的 293T细胞消化计数后稀释至 1×105个/ml,加入 96孔板(100μl/孔),37℃、5%CO2培养箱中培养。取 10个eppendorf管,每管中加入 90μl培养液,加入 10μl病毒颗粒于第 1管,混匀,从第 1管中吸取 10μl加入下一管,混匀,依次稀释病毒颗粒至第 10管。吸取 96孔板中原有的培养液,加入含稀释号的病毒液。24h后每孔再加入含抗生素的 100μl完全培养液,37℃孵育 24h后,计算病毒滴度。
1.2.5 慢病毒感染 SMMC-7721细胞 取对数生长期的 SMMC-7721细胞消化计数后稀释至 3×104个 /ml,加入 96孔板(90μl/孔)。当细胞汇合率为 50%时进行感染,并加入 5μg/μl的聚凝胺以增加感染效率。12 h后弃去上清,加入 100μl/孔的完全培养液。感染后次日加入抗生素进行筛选,观察细胞生长优势。
1.2.6 Western blot检测 Smad4、fascin和 cortactin蛋白的表达 提取细胞总蛋白,BCA法测定各组蛋白浓度。根据浓度上样行电泳后转膜至 PVDF膜上,5%脱脂奶粉的 TBST封闭 1h,加一抗(β-actin 1∶500、Smad4 1∶200、fascin 1∶500、cortactin 1∶500)4℃杂交过夜,TBST漂洗,加二抗(1∶2000)室温孵育 2h,TBST漂洗,化学发光试剂检测蛋白条带,测定各条带积分光密度值,定量分析。
1.2.7 细胞划痕 取对数生长期的细胞消化、计数后稀释至 2×105个/m l,接种于 6孔板,待细胞基本长满后,用 200μl枪头沿各孔底部中央划一直线,PBS洗涤 3次,加入无血清培养基培养,0、12、24、48h后于倒置显微镜下观察划痕区细胞的迁移情况并拍照。
1.2.8 3D培养 将 Matrigel胶加入 96孔板(35 μl/孔),待其覆盖均匀后 37℃孵育 45min。取对数生长期的细胞消化、计数后稀释至 2×104个/m l,加入之前的 96孔板(35μl/孔),37℃、5%CO2培养箱内连续培养 4d后倒置相差显微镜下观察细胞形态并拍照。
1.2.9 统计学分析 所有实验均重复 3次以上,用SPSS 13.0软件进行统计分析,定量结果采用均数 ±标准差(s)表示,多组均数间比较采用单因素方差分析,两两组间比较采用组间 q检验,以 P≤0.05为差异有统计学意义。
2 结 果
2.1 pMAGIC1.0载体质粒的酶切 载体质粒pMAGIC1.0经 AgeⅠ和 EcoRⅠ双酶切的结果,见图1。
2.2 阳性克隆 PCR鉴定 以连接产物转化后形成的阳性克隆为模板,行 PCR扩增后,连接入双链片段的阳性克隆PCR片段大小为 343bp,如图2所示。PCR结果与预测相符,说明已经将 RNAi的双链连接到慢病毒载体上,Smad4的 RNAi慢病毒载体质粒构建成功。
2.3 慢病毒载体的包装和滴度测定 将慢病毒质粒溶液与慢病毒转染试剂混合共同转染 293T细胞,转染后 48h细胞生长良好,病毒浓缩后测定滴度为2×108TU/m l,表明病毒包装、浓缩成功。
2.4 慢病毒感染 SMMC-7721细胞后 Smad4蛋白的表达 Western blot结果见图3。与 SMMC-7721组(1.17±0.06)及 RNAi-NC组(1.20±0.02)相比,RNAi-Smad4-2组(0.12±0.02)和 RNAi-Smad4-12组(0.10±0.01)细胞中 Smad4蛋白出现明显的低表达(P<0.05);而 SMMC-7721组和 RNAi-NC组细胞间比较,Smad4蛋白的表达无明显差异。这说明慢病毒感染 SMMC-7721细胞后能有效的抑制Smad4蛋白的表达。
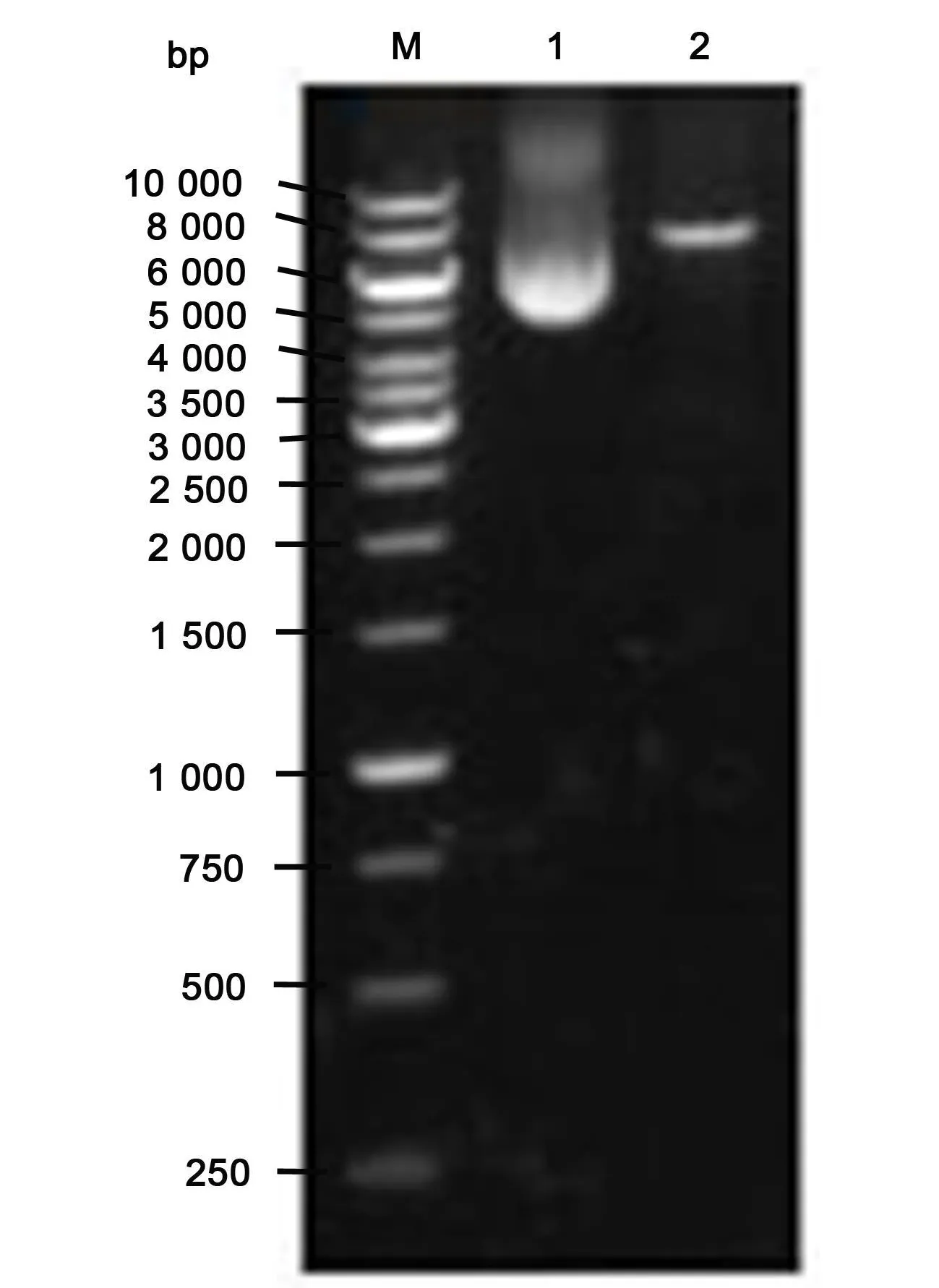
图1 p MAGIC 1.0载体质粒 AgeⅠ/EcoRⅠ双酶切产物的琼脂糖凝胶电泳图Figure 1 Restriction map of p lasm id by AgeⅠ /EcoRⅠ

图2 阳性克隆的琼脂糖凝胶电泳图Figure 2 Electrophoretic profile of positive clones

图3 慢病毒感染 SMMC-7721细胞后 Smad4蛋白的表达Figure 3 Expression of Sm ad 4 protein in SMMC-7721 cells after lentivirus infection
2.5 低表达 Smad4后对 SMMC-7721细胞迁移能力的影响 细胞划痕 12 h后,SMMC-7721组和RNAi-NC组细胞的划痕仍较明显,并且随观察时间的延长,其划痕愈合速度明显慢于RNAi-Smad4-2组和 RNAi-Smad4-12组细胞,见图4。3D培养环境下,RNAi-Smad4-2组和 RNAi-Smad4-12组细胞边缘逐渐不规则,向周围凝胶渗透;而 SMMC-7721组和RNAi-NC组细胞仍呈边缘完整的类球形形态,见图5。细胞划痕和 3D培养的结果显示,低表达 Smad4后 SMMC-7721细胞迁移能力明显增强。

图4 低表达 Smad4后SMMC-7721细胞迁移能力的变化-细胞划痕实验(×200)Figure 4 Change of SMMC-7721 cells migration after Smad 4 knock-down in wound-healing experiment(×200)
2.6 低表达 Smad4后对 fascin和 cortactin蛋白表达的影响 相较于 SMMC-7721组(fascin:0.33±0.07,cortactin:0.13±0.02)和 RNAi-NC组(fascin:0.50±0.10,cortactin:0.13±0.01),RNAi-Smad4-2组(fascin:0.72±0.11,cortactin:0.53±0.07)和RNAi-Smad4-12组 (fascin:0.83±0.11,cortactin:0.36±0.05)细胞中的 fascin(图6)和 cortactin(图7)蛋白表达量均显著增加(P<0.05)。cortactin蛋白在 SMMC-7721组和 RNAi-NC组细胞中表达相仿,无显著差异。

图5 低表达Smad4后SMMC-7721细胞迁移力的变化-3D培养实验(×400)Figure 5 Change of SMMC-7721 cells migration after Smad 4 knock-down in a 3-dimensiona l Matrigel(×400)

图6 低表达Smad4后细胞中fascin蛋白的表达变化Figure 6 Change of fascin p rotein expression in cells after Smad 4 knock-down

图7 低表达Smad4后细胞中cortactin蛋白的表达变化Figure 7 Change of cortactin protein exp ression in cells a fter Smad 4 knock-dow n
3 讨 论
肿瘤的侵袭、转移是一个复杂的多步骤的过程,受到多种因素的精密调控[7-8]。在这些众多调控因素的研究中,Smad4分子的研究越来越受到重视。Smad4分子是 TGF-β-Smad信号通路中的关键应答分子,处于 TGF-β信号转导的中枢地位,它能够参与调控多种下游靶基因的表达[4]。近年来的研究发现 Smad4与多种肿瘤的发生、发展密切相关:Smad4在胰腺癌、结肠癌等肿瘤中存在表达缺失或突变,并且其低表达与这些肿瘤的不良预后[9-11]、转移[5-6,12]密切相关。虽然 Smad4在这些肿瘤中得到了广泛的研究,但其在肝癌转移过程中的研究却很少。
在本实验中,我们以肝癌细胞 SMMC-7721为模型,观察 Smad4对肝癌细胞迁移能力的影响,并探讨可能的机制。为了观察 Smad4在肝癌细胞迁移中作用,我们利用 RNAi技术[13],构建了针对Smad4的 RNAi慢病毒载体,使 Smad4低表达。慢病毒载体的阳性克隆 PCR结果显示 Smad4的干扰序列正确连接入慢病毒载体,表明 Smad4的 RNAi慢病毒载体构建成功。将构建成功的慢病毒载体包装、浓缩、感染肝癌细胞 SMMC-7721后发现肝癌细胞中 Smad4蛋白的表达显著降低。进一步的实验结果显示:与对照组细胞相比,低表达 Smad4后肝癌细胞的划痕愈合速度加快,并且随着观察时间延长,愈合速度越快;在 3D培养条件下,低表达 Smad4后肝癌细胞边缘逐渐不规则,向周围凝胶穿透,而对照组细胞仍呈类圆形的细胞形态,细胞边缘完好。上述的研究结果表明,对于体外培养的肝癌细胞 SMMC-7721,低表达 Smad4可以提高肝癌细胞的迁移能力。而我们前期通过对肝癌患者临床组织学标本的检测研究也发现,肝癌组织中 Smad4蛋白的阳性表达率要明显低于癌旁组织[14],并且 Smad4的低表达与肝癌的侵袭转移密切相关,本实验的研究结果与其相符。这些结果都提示 Smad4与肝癌的侵袭、转移的过程相关,但其相关的机制却还一直不明。
肿瘤细胞的迁移是肿瘤侵袭、转移的基础,受到多种因素的调控,其中肿瘤细胞自身的运动能力至关重要[15]。国外的研究发现具有转移潜能的大鼠前列腺癌细胞中,其与细胞运动有关的基因表达发生改变[16];Lewis-Wambi等[17]研究乳腺癌细胞时也发现了与细胞运动有关基因的表达变化;更有意义的是,干扰胰腺癌细胞 Smad4的表达后,发现其下游多种调控细胞运动的基因表达也发生了改变[18]。这些研究提示 Smad4对肿瘤细胞迁移过程的作用可能与细胞运动能力的改变相关。研究发现,发生转移的肿瘤细胞不仅呈现出变形虫样的运动,而且其细胞内出现多种骨架蛋白调控分子的上调[19]。Zhu等[20]研究也证实在运动能力增强的结肠癌细胞中,多种细胞骨架相关基因的表达发生改变。本实验中拟探讨的蛋白 fascin和 cortactin,就是 2种重要的细胞骨架相关蛋白,参与维持细胞的骨架结构,影响细胞的粘连性能,调控细胞的运动能力[21-23]。近年来的研究发现,fascin和 cortactin蛋白与结肠癌[24]、前列腺癌[25]、胃癌[26]等多种肿瘤的生物学行为密切相关。本实验中,我们利用 RNA干扰技术将肝癌细胞中 Smad4低表达后发现,细胞骨架相关蛋白 fascin和 cortactin的表达量明显上调,提示低表达 Smad4后可以通过上调下游靶分子 fascin和 cortactin的表达,改变肝癌细胞的运动能力,从而促进肝癌细胞的迁移。
综上所述,本实验的研究结果表明 Smad4的低表达能促进肝癌细胞 SMMC-7721的迁移能力,并且其作用的机制可能与 Smad4低表达后上调细胞骨架相关蛋白 fascin和 cortactin的表达,进而改变细胞的运动能力有关,但其具体机制还有待进一步研究明确。
[1]El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[2]Forner A,Hessheimer AJ,Isabel Real M,et al.Treatment of hepatocellular carcinoma[J].Crit Rev Oncol Hematol,2006,60(2):89-98.
[3]Yang G,Yang X.Smad4-mediated TGF-beta signaling in tumorigenesis[J].Int J Biol Sci,2010,6(1):1-8.
[4]Kretzschmar M,MassaguéJ.SMADs:mediators and regulators of TGF-beta signaling[J].Curr Opin Genet Dev,1998,8(1):103-111.
[5]Papageorgis P,Cheng K,Ozturk S,et al.Smad 4 Inactivation Promotes Malignancy and Drug Resistance of Colon Cancer[J].Cancer Res,2011,71(3):998-1008.
[6]Ding Z,Wu CJ,Chu GC,et al.SMAD4-dependent barrier constrains prostate cancer growth and metastatic progression[J].Na-ture,2011,470(7333):269-273.
[7]左衍海,施 鑫.恶性肿瘤转移机制研究新进展[J].医学研究生学报,2008,21(3):293-297.
[8]Gupta GP,MassaguéJ.Cancer metastasis:building a framework[J].Cell,2006,127(4):679-695.
[9]Isaksson-Mettävainio M,Palmqvist R,Forssell J,et al.SMAD 4/DPC4expression and prognosis in human colorectal cancer[J].Anticancer Res,2006,26(1B):507-510.
[10]Blackford A,Serrano OK,Wolfgang CL,et al.SMAD 4 gene mutations are associated with poor prognosis in pancreatic cancer[J].Clin Cancer Res,2009,15(14):4674-4679.
[11]Tascilar M,Skinner HG,Rosty C,et al.The SMAD 4 protein and prognosis of pancreatic ductal adenocarcinoma[J].Clin Cancer Res,2001,7(12):4115-4121.
[12]Losi L,Bouzourene H,Benhattar J.Loss of Smad4 expression predicts liver metastasis in human colorectal cancer[J].Oncol Rep,2007,17(5):1095-1099.
[13]陈芳芳,李晓军.RNA干扰在肿瘤治疗上的研究进展[J].医学研究生学报,2009,22(8):879-883.
[14]Ji GZ,Wang XH,Miao L,et al.Role of transform ing growth factor-beta1-smad signal transduction pathway in patients with hepatocellular carcinoma[J].World J Gastroenterol,2006,12(4):644-648.
[15]Kedrin D,van Rheenen J,Hernandez L,et al.Cell motility and cytoskeletal regulation in invasion and metastasis[J].JMammary Gland Biol Neoplasia,2007,12(2-3):143-152.
[16]Reyes I,Tiwari R,Geliebter J,et al.DNA m icroarray analysis reveals metastasis-associated genes in rat prostate cancer cell lines[J].Biomedica,2007,27(2):190-203.
[17]Lewis-Wambi JS,Cunliffe HE,K im HR,et al.Overexpression of CEACAM6 promotes migration and invasion of oestrogen-deprived breast cancer cells[J].Eur J Cancer,2008,44(12):1770-1779.
[18]Jazag A,Ijichi H,Kanai F,et al.Smad4 silencing in pancreatic cancer cell lines using stable RNA interference and gene expression profiles induced by transforming growth factor-beta[J].Oncogene,2005,24(4):662-671.
[19]Olson MF,Sahai E.The actin cytoskeleton in cancer cell motility[J].Clin Exp Metastasis,2009,26(4):273-287.
[20]Zhu XL,Zeng YF,Guan J,et al.FMNL2 is apositive regulator of cell motility and metastasis in colorectal carcinoma[J].J Pathol,2011,224(3):377-388.
[21]Jayo A,Parsons M.Fascin:a key regulator of cytoskeletal dynam ics[J].Int J Biochem Cell Biol,2010,42(10):1614-1617.
[22]Cosen-Binker LI,Kapus A.Cortactin:the gray eminence of the cytoskeleton[J].Physiology(Bethesda),2006,21:352-361.
[23]Adams JC.Rolesof fascin in cell adhesion and motility[J].Curr Opin Cell Biol,2004,16(5):590-596.
[24]Jung EJ,Lee JH,Min BW,et al.Clinicopathologic significance of fascin,extracellular matrix metalloproteinase inducer,and ezrin expressions in colorectal adenocarcinoma[J].Indian J Pathol Microbiol,2011,54(1):32-36.
[25]Darnel AD,Behmoaram E,Vollmer RT,et al.Fascin regulates prostate cancer cell invasion and is associated with metastasis and biochem ical failure in prostate cancer[J].Clin Cancer Res,2009,15(4):1376-1383.
[26]Li X,Zheng H,Hara T,et al.Aberrant expression of cortactin and fascin are effective markers for pathogenesis,invasion,metastasis and prognosis of gastric carcinomas[J].Int J Oncol,2008,33(1):69-79.

