Caspase 8和9在肿瘤局部微环境形成早期与调控蛋白Twist1的关联性*
宗文康 孙保存 孙 涛 董学易 刘艳荣 古 强 赵秀兰
线形程序性坏死(linearly patterned programmed cell necrosis,LPPCN)是近年来发现的一种规律性的Caspases依赖性的肿瘤细胞群体死亡模式,其与血管生成拟态(vasculogenic mimicry,VM)、内皮依赖性血管(endothelium-dependent vessels,EV)的形成有关[1-2]。上皮-间充质转变(epithelial-mesenchymal transition,EMT)是指上皮细胞失去上皮表型转变为具有迁移能力的间充质表型的现象。EMT参与了VM的形成过程[3]。本实验通过构建黑色素瘤小鼠模型,研究在LPPCN和VM形成中,Caspase 8、9对EMT调控蛋白Twist1表达的影响。
1 材料与方法
1.1 实验动物及试剂 C57BL6小鼠96只,6~8周龄,平均体质量(21.0±1.9)g,购自北京军事医学科学院,清洁实验室饲养,饮用水和饲料均由天津医科大学实验动物中心提供。Cas⁃pase 8抑制剂Z-IETD-FMK和Caspase 9抑制剂Z-LEHD-FM购自SIGMA公司,按照相应剂量分别溶于0.1 mL含10%DMSO的生理盐水中,药物终剂量均为100 μg/kg。兔多抗Twist1抗体和sc-15393均购自Santa Cruz公司,工作浓度为1∶50。
1.2 方法
1.2.1 B16黑色素瘤小鼠模型的建立及分组 将低温保存的B16黑色素瘤组织于43℃的热水中迅速升温20~30 s,然后以1 000 r/min离心10 min,吸取上清液后,剪碎瘤组织,加入生理盐水制成瘤细胞悬液(细胞浓度为2×109/L)。于小鼠蹊部注射瘤细胞悬液0.2 mL/只。待小鼠荷瘤后随机分为Caspase 8抑制剂组(8抑制剂组),Caspase 9抑制剂组(9抑制剂组),Caspase 8、9抑制剂联合用药组(联合组)及对照组,每组24只。
1.2.2 给药方法 (1)8抑制剂组:于小鼠瘤周皮下注射Cas⁃pase 8抑制剂0.1 mL/d。(2)9抑制剂组:于小鼠瘤周皮下注射Caspase 9抑制剂0.1 mL/d。(3)联合组:于小鼠瘤周皮下注射Caspase 8抑制剂0.1 mL/d和Caspase 9抑制剂0.1 mL/d。(4)对照组:于小鼠瘤周皮下注射含10%DMSO的生理盐水0.1 mL/d。
1.2.3 免疫组织化学染色 断颈法处死小鼠后剖取移植瘤,福尔马林固定,石蜡包埋,制成4 μm切片,采用二步法进行免疫组织化学染色:二甲苯脱蜡,梯度乙醇至水,3%双氧水灭活内源性过氧化酶,PBS缓冲液振洗,抗原微波热修复,正常山羊血清封闭、一抗4℃冰箱过夜,二抗1 h,DAB显色10~15 min,苏木精复染核,梯度乙醇脱水,二甲苯透明,中性树胶封固。
1.2.4 计数方法 在低倍镜(×100)下找到典型区域,高倍镜(×400)下连续计数10个高倍视野中LPPCN周围和VM周围第1~4层肿瘤细胞核和胞浆的染色指数,取其平均值[4]。染色指数=阳性率积分+染色强度。阳性率积分的评定:阳性率<25%为0分,26%~50%为1分,51%~75%为2分,≥76%为3分;染色强度评定:肿瘤细胞无着色为0分,染成浅黄色为1分,棕黄色为2分,深黄色为3分。
1.3 统计学处理 应用SPSS 17.0统计软件进行处理,均数比较采用单因素方差分析,两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
Twist1在细胞核和细胞浆中皆有表达,见图1。4组LPPCN周围第1~4层肿瘤细胞核Twist1阳性染色指数差异均有统计学意义(P<0.05或P<0.01),见表1,且有逐层递减趋势,见表2;同层不同组的LPPCN肿瘤细胞核Twist1阳性染色指数,联合组与对照组相比,差异均有统计学意义(均P<0.01),见表1。LPPCN和VM周围第1~4层肿瘤细胞、同一层不同组的肿瘤细胞胞浆,VM周围第1~4层肿瘤细胞、同一层不同组的肿瘤细胞核Twist1阳性染色指数差异均无统计学意义(均P>0.05),见表3~5。
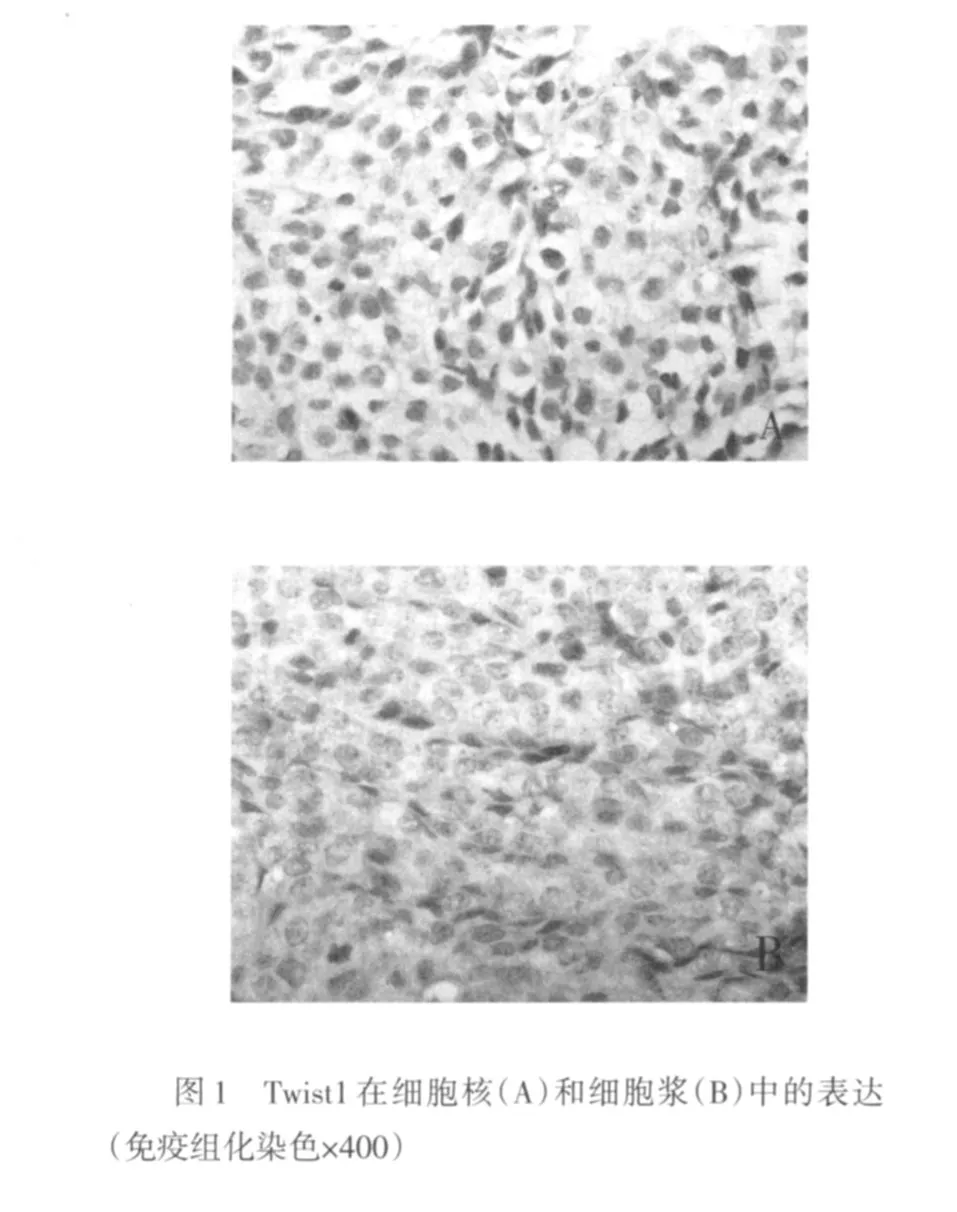
表1 LPPCN周围第1~4层肿瘤细胞核Twist1阳性染色指数的比较 (n=24x±s)
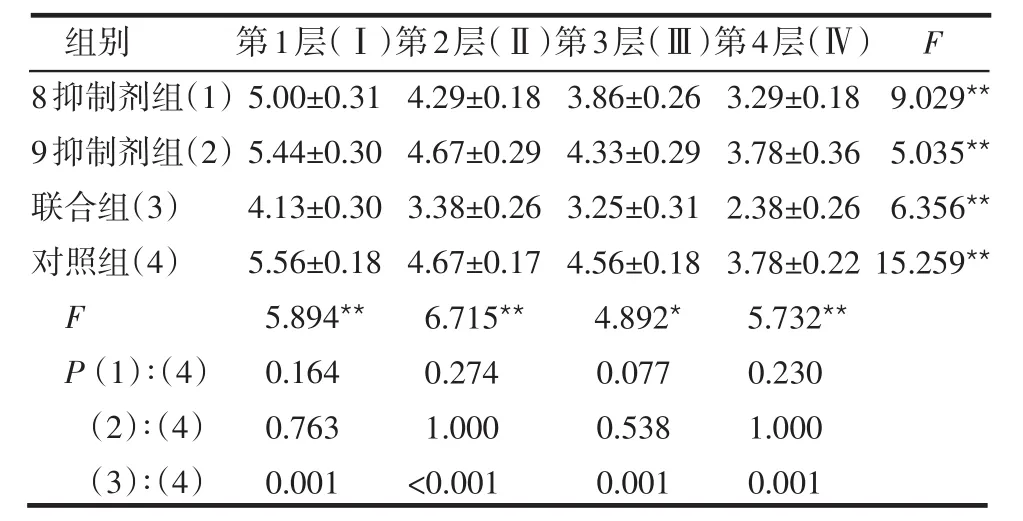
表1 LPPCN周围第1~4层肿瘤细胞核Twist1阳性染色指数的比较 (n=24x±s)
*P<0.05,**P<0.01
?
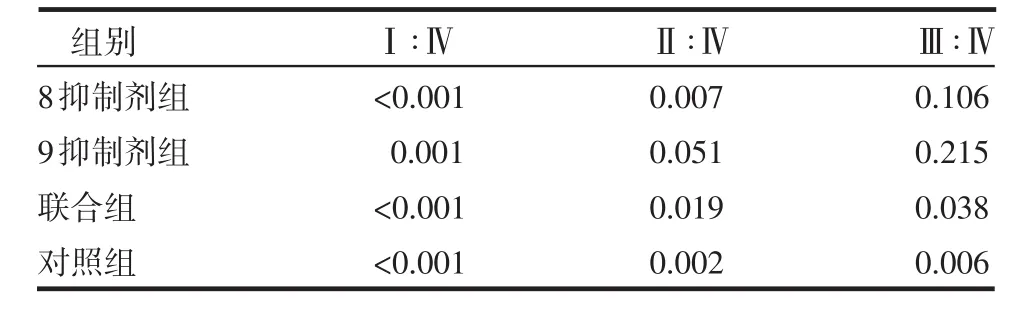
表2 同一组别不同层两两比较的P值
表3 LPPCN周围第1~4层肿瘤细胞浆Twist1阳性染色指数的比较 (n=24, ±s)
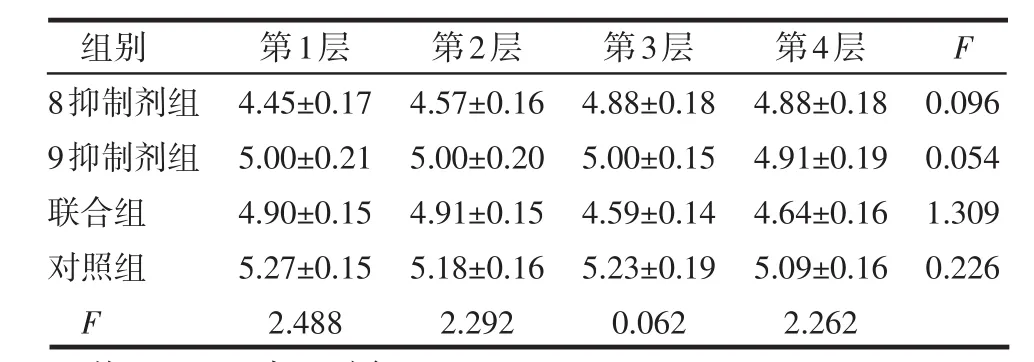
表3 LPPCN周围第1~4层肿瘤细胞浆Twist1阳性染色指数的比较 (n=24, ±s)
均P>0.05,表3、4同
组别8抑制剂组9抑制剂组联合组对照组F第1层4.45±0.17 5.00±0.21 4.90±0.15 5.27±0.15 2.488第2层4.57±0.16 5.00±0.20 4.91±0.15 5.18±0.16 2.292第3层4.88±0.18 5.00±0.15 4.59±0.14 5.23±0.19 0.062第4层4.88±0.18 4.91±0.19 4.64±0.16 5.09±0.16 2.262 F 0.096 0.054 1.309 0.226
表4 VM周围第1~4层肿瘤细胞核Twist1阳性染色指数的比较 (n=24±s)
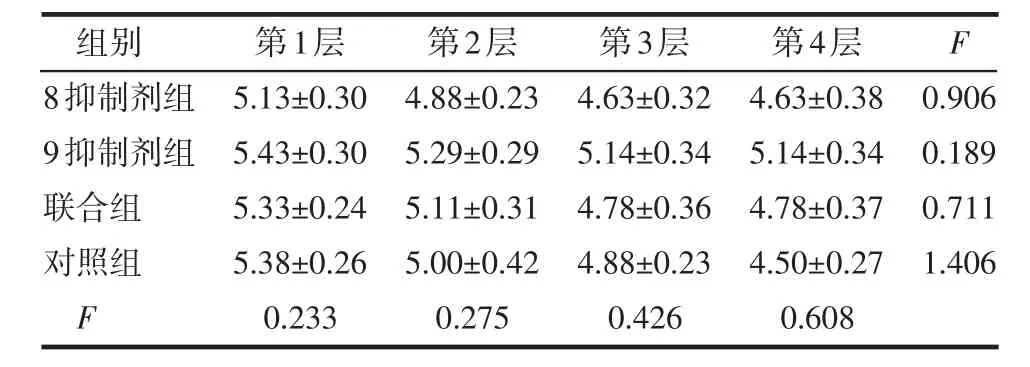
表4 VM周围第1~4层肿瘤细胞核Twist1阳性染色指数的比较 (n=24±s)
组别8抑制剂组9抑制剂组联合组对照组F第1层5.13±0.30 5.43±0.30 5.33±0.24 5.38±0.26 0.233第2层4.88±0.23 5.29±0.29 5.11±0.31 5.00±0.42 0.275第3层4.63±0.32 5.14±0.34 4.78±0.36 4.88±0.23 0.426第4层4.63±0.38 5.14±0.34 4.78±0.37 4.50±0.27 0.608 F 0.906 0.189 0.711 1.406
表5 VM周围第1~4层肿瘤细胞浆Twist1阳性染色指数的比较 (n=24 ±s)

表5 VM周围第1~4层肿瘤细胞浆Twist1阳性染色指数的比较 (n=24 ±s)
组别8抑制剂组9抑制剂组联合组对照组F第1层5.10±0.18 5.32±0.22 4.76±0.15 5.33±0.14 2.186第2层4.95±0.19 5.22±0.26 4.64±0.18 5.23±0.15 1.756第3层4.86±0.16 4.91±0.21 4.55±0.18 4.95±0.19 1.120第4层4.95±0.15 4.96±0.21 4.45±0.17 5.05±0.19 2.105 F 0.35 0.76 0.57 1.01
3 讨论
VM是Maniotis等[5]发现的一种不依赖于血管内皮的肿瘤微循环模式。在肿瘤快速生长早期,肿瘤组织内部处于高压、缺氧状态,内皮细胞很难长入肿瘤组织,因此EV生长无法满足肿瘤细胞快速生长的需要。VM的形成可有效缓解肿瘤快速生长早期肿瘤细胞微环境的缺氧状态。此后VM逐渐被EV所取代,马赛克血管(Mosaic Vessels,MV)则是处于VM和EV过渡阶段的血液供应模式,这就是肿瘤血管生成的三阶段学说[4]。因此VM是肿瘤组织生长早期重要的功能性血管,可有效地改善肿瘤内部的缺氧环境,与肿瘤生长、侵袭和转移等生物学行为有关。本课题组前期研究发现黑色素瘤中存在一些深染的肿瘤细胞,这些肿瘤细胞呈线形分布或网状分布,胞核深染、碎裂、胞浆浓缩、细胞间彼此分离,并与内皮依赖性血管相通[2],这些深染的肿瘤细胞被命名为LPPCN。与凋亡和坏死这2种经典的细胞死亡模式不同,LPPCN是主动性的,肿瘤细胞群体发生的,并且没有炎细胞浸润的肿瘤细胞死亡模式。在LPPCN过程中,Caspases发挥着重要作用[6-7]。发生LPPCN的肿瘤细胞原位缺口末端标记染色阴性,Caspase 3、Caspase 9免疫组织化学染色阳性[1]。发生LPPCN的肿瘤细胞死亡脱落后形成的管腔样空隙可能为VM、EV的形成提供一定的空间结构基础[1]。LPPCN常发生于血液供应无法到达、缺氧最严重的肿瘤细胞,而LPPCN周围尤其是第1~4层肿瘤细胞则处于相对缺氧状态,这些濒死的肿瘤细胞可能启动一系列机制发生EMT,对抗缺氧微环境。肿瘤细胞发生EMT后上皮细胞丧失上皮特性,即细胞间黏附能力和细胞极性的丧失,同时获得间充质细胞的特性,即细胞侵袭、转移能力和抗凋亡能力的增强[8-9]。在缺氧环境下缺氧诱导因子(HIF)1高表达可以诱导肿瘤细胞发生EMT。LPPCN周围尤其是第1~4层肿瘤细胞发生EMT后,不仅发生了形态学上的改变,还具有了自分泌细胞因子和细胞外基质的能力,为VM的形成提供物质基础。
参与EMT过程的转录调节因子主要有Twist1、Snail和Slug等。Twist1是一种螺旋-环-螺旋的转录因子,在多种恶性肿瘤中表达上调,参与肿瘤的发生发展过程。Twist1可以与E-cadherin的转录启动子E-box结合,抑制E-cadherin的表达,从而诱导肿瘤细胞发生EMT。将胰腺癌细胞系放置于缺氧环境48 h后,Twist1 mRNA表达水平上调[10]。有研究表明转染Slug的犬肾细胞系高表达血管内皮生长因子(VEGF)和Twist1[11]。在97例肝细胞肝癌样本中VM阳性组Twist1表达明显强于VM阴性组,转染Twist1的HepG2肝癌细胞系E-cadherin表达下调,侵袭和转移能力增强,并且在体外培养时形成了管腔样结构[3]。
本实验通过抑制Caspase 8、9来干扰LPPCN的形成,破坏肿瘤早期微环境的构建加重肿瘤组织内部缺氧程度,促使肿瘤组织发生大片坏死,从而下调LPPCN周围尤其是第1~4层肿瘤细胞Twist1的表达,其中Caspase 8、9抑制剂联合组肿瘤细胞核Twist1下调更显著,LPPCN周围第1~4层肿瘤细胞核Twist1表达呈递减趋势。但LPPCN周围第1~4层肿瘤细胞浆Twist1表达无递减趋势,且VM周围第1~4层肿瘤细胞核和细胞浆中Twist1表达此种趋势并不明显,可能与VM形成后改善肿瘤细胞局部缺氧微环境有关。实验表明LPPCN周围肿瘤细胞在缺氧的诱导下可上调细胞核Twist1表达促使肿瘤细胞发生EMT,发生EMT的肿瘤细胞可能在一系列机制的诱导下自分泌多种细胞因子并重塑细胞外基质促使VM的最终形成。
在肿瘤组织快速生长早期,内皮依赖性血管无法满足肿瘤生长需要,VM的形成对缓解肿瘤细胞局部缺氧微环境起重要作用。此外,VM形成还有利于肿瘤细胞的侵袭和转移。单纯针对内皮细胞的抗血管生成治疗在部分高度恶性肿瘤中没有达到预期效果,可能与肿瘤组织内存在VM这种独特的微循环模式有关。研究VM及其形成机制将有可能为临床肿瘤抗血管生成治疗提供药物新靶点。
[1]Zhang S,Guo H,Zhang D,et al.Microcirculation patterns in different stages of Melanoma growth[J].Oncology Report,2006,15(1):15-20.
[2]Zhang S,Li M,Zhang D,et al.Hypoxia influences linearly patterned programmed cell necrosis and tumor blood supply patterns forma⁃tion in melanoma[J].Lab Invest,2009,89(5):575-586.
[3]Sun T,Zhao N,Zhao XL,et al.Expression and functional signifi⁃cance of twist1 in hepatocellular carcinoma:its role in vasculogenic mimicry[J].Hepatology,2010,51(2)545-556.
[4]Hendrix MJ,Seftor EA,Hess AR,et al.Vasculogenic mimicry and tumor-cell plasticity:lessons from melanoma[J].Nat Rev Cancer,2003,3(6):411-421.
[5]Manitois AJ,Folberg R,Hess A,et al.Vascular channel formation by human melanoma cells in vivo and in vitro:vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-752.
[6]Shimizu S,Eguchi Y,Kamiile W,et al.Retardation of chemical hy⁃poxia-induced necrotic cell death by Bcl-2 and ICE inhibitors:pos⁃sible involvement if common mediators in apoptotic and necrotic signal transduction[J].Oncogene,1996,12(10):2045-2050.
[7]Tsujimoto Y.Apoptosis and necrosis:intracellular ATP level as a de⁃terminant for cell death modes[J].Cell Death Differ,1997,4(6):429-434.
[8]Greenberg G,Hay ED.Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J].J Cell Biol,1982,95(1):333-339.
[9]Fardin P,Ognibene M,Vanni C,et al.Induction of epithelial mes⁃enchimal transition and vasculogenesis in the lenses of Dbl onco⁃gene transgenic mice[J].PLoS One,2009,4(9):e7058.
[10]Hotz B,Arndt M,Dullat S,et al.Epithelia to mesenchymal transi⁃tion:expression of the regulators snail,slug and twist in pancreatic cancer[J].Clin Cancer Res,2007,13(16):4769-4776.
[11]Huang CH,Yang WH,Chang SY,et al.Regulation of membrane-type 4 matrix metalloproteinase by SLUG contributes to hypoxia-mediated metastasis[J].Neoplasia,2009,11(12):1371-1382.

