丙泊酚后处理对大鼠脑缺血再灌注损伤的长时程保护作用*
李 翠 王国林 王海云 罗猛强
脑缺血常伴有再灌注损伤,如何减轻这种损伤是临床关注的重点之一,而临床急性脑缺血发生的不可预测性,使得后处理具有更为广阔的应用前景。脑缺血患者围手术期间麻醉药物的选择是麻醉医师需要慎重考虑的问题,近年来,丙泊酚由于起效快、清除迅速和不良反应少等优点被广泛应用于临床麻醉,其还能够降低氧代谢率、抗氧化和抑制细胞凋亡从而减轻脑缺血再灌注损伤[1-2]。研究显示,丙泊酚后处理对脑缺血再灌注损伤具有急性期保护作用[3]。这些研究大多限于损伤后8 d内,其是否具有长时程保护作用目前尚不清楚。本研究旨在观察丙泊酚后处理是否对脑缺血再灌注损伤具有长时程保护作用,从而为临床已发生或存在脑缺血潜在危险患者麻醉药物的选择提供理论依据。
1 材料与方法
1.1 实验材料 健康雄性SD大鼠144只,10~12周龄,体质量250~280 g,购自军事医学科学院实验动物中心。丙泊酚购自意大利Astra Zeneca公司,脂质溶剂(丙泊酚脂质载体)类似物、10%脂肪乳注射液(C14~24)(intralipid)购自四川科伦药业股份有限公司,2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)购自 Sigma 公司。大脑中动脉阻塞(MCAO)线栓购自北京沙东生物技术有限公司,思路高TCI-Ⅰ型输液泵购自北京思路高科技发展有限公司,Morris水迷宫及分析软件EthoVision(荷兰Noldus公司)。
1.2 动物模型的建立 参照Longa等[4]提出的可逆性MCAO线栓法加以改良制作局灶性脑缺血再灌注模型。10%水合氯醛350 mg·kg-1腹腔注射麻醉,右侧股静脉以小儿24号静脉留置针插管,以备输注液体,取颈正中切口,钝性分离右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external ca⁃rotid artery,ECA)及颈内动脉(internal carotid artery,ICA),并结扎右CCA、ECA近心端,根据大鼠个体不同选用不同球端直径(0.24、0.26和0.28 mm)的栓线,于CCA分叉上方2 mm处将线栓球端置入ICA,沿ICA缓慢插入,向颅内深入直到感觉有轻微阻力即止,以CCA分叉处为起点,进线长度约为18~20 mm,此时大脑中动脉(MCA)起始处血流被阻断,固定好线栓,缝合切口,线栓尾端留于皮肤外。缺血60 min后拔出线栓至CCA内进行再灌注。假手术组进线深度为10 mm。术中和术后室温控制在25℃~28℃,用电灯泡照射大鼠保暖以保持直肠温度为(37.0±0.5)℃,以动物苏醒后出现左侧以前肢为重的偏瘫为造模成功。
1.3 实验分组 将大鼠随机分为4组,每组36只大鼠,分别为假手术组(S组)、缺血再灌注组(IR组)、脂质溶剂对照组(I组)和丙泊酚后处理组(P组)。P组在再灌注即刻经股静脉给予丙泊酚20 mg·kg-1·h-1泵注4 h,S组和IR组于该时间点泵注等体积的生理盐水,I组泵注等体积的脂质溶剂,均持续4 h。
1.4 改良神经功能缺损程度(modified neurological severity score,mNSS)评分 每组各取 6 只大鼠在术后 1、3、7、14、21和28 d分别进行mNSS评分,包括运动、感觉、反射和平衡试验,测试方法参考Chen等[5]的方法,得分越高提示神经功能损伤越重,0分为正常,18分为最高功能障碍。
1.5 脑梗死体积百分比测量 在术后1、7、14和28 d每个时间点每组取6只大鼠,腹腔注射10%水合氯醛350 mg·kg-1麻醉后处死取脑,置于-20℃冰箱冷冻30 min后,以2 mm间距连续冠状切成6片,弃去嗅球及小脑组织。放入1%TTC溶液中37℃温箱避光孵育30 min,每隔15 min翻动脑片使均匀接触到染色液,取出脑切片放至10%福尔马林中固定,24 h后数码相机拍照,输入计算机,采用Imageproplus 6.0图像处理软件计算梗死面积(粉红色区域为正常脑组织,白色区域为梗死组织),各脑片梗死面积之和乘以厚度(2 mm)即为脑梗死体积,以梗死体积占全脑体积得百分比作为脑梗死体积百分比,其中为代偿脑缺血后水肿效应,脑梗死面积矫正计算方法如下:矫正后梗死面积=测量的梗死面积×{1-[(同侧半球面积-对侧半球面积)/对侧半球面积]}[6]。
1.6 Morris水迷宫测试 每组各取6只大鼠于术后8和22 d开始进行两周期的Morris水迷宫测试,检测大鼠空间学习记忆能力。参照Vorhees等[7]的方法,进行每周期历时5 d的定位航行实验,记录大鼠逃避潜伏期(escape latency,EL;即从大鼠入水到找到水下隐蔽平台并立于其上所需时间),用于测量大鼠对水迷宫学习和记忆的能力。
1.7 统计学方法 采 用SPSS 17.0统计软件进行分析,所有数据均以±s表示,mNSS评分、梗死体积百分比及定位航行实验数据均用单因素方差分析进行检验,组间两两比较采用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 mNSS评分 S组无神经功能缺损,各时间点均为0分。与S组相比,IR组和I组在缺血后多时间点的mNSS评分差异均有统计学意义(均P<0.01),P组评分随缺血时间延长逐渐降低,在缺血后28 d与S组比较差异无统计学意义;IR组与I组比较差异无统计学意义(P>0.05);P组大鼠缺血3 d后的mNSS评分与IR组比较有明显的降低(P<0.05或P<0.01),见表1。
表1 各组大鼠mNSS评分比较 (n=6,分±s)

表1 各组大鼠mNSS评分比较 (n=6,分±s)
*P<0.05,**P<0.01;表2~4同
组别S组(1)IR组(2)I组(3)P 组(4)F q(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)1 d 0 10.50±1.05 10.33±1.03 9.17±1.17 172.20**27.369**26.926**23.903**0.443 3.467 3.024 3 d 0 9.17±0.98 8.67±1.03 6.83±1.33 113.10**23.075**21.817**17.187**1.258 5.888**2.919 7 d 0 7.83±0.75 7.50±1.05 6.00±1.26 97.55**21.269**20.373**16.298**0.896 4.971*4.074*14 d 0 4.83±0.98 5.17±0.75 3.33±1.03 51.45**14.720**15.757**10.149**1.036 4.571*5.608**21 d 0 2.83±0.75 2.50±0.55 1.00±0.63 33.16**12.342**10.903**4.361*1.439 7.981**6.542**28 d 0 2.00±0.63 1.50±0.55 0.50±0.55 20.00**9.789**7.341**2.447 2.447 7.341**4.894*
2.2 脑梗死体积百分比 假手术组大鼠均未见明显梗死灶,IR组、I组及P组均出现大小不一的梗死灶;IR组与I组脑梗死体积百分比差异无统计学意义(P>0.05);P组的脑梗死体积百分比较IR组、I组小(P<0.05或P<0.01),P组在28 d与S组比较差异无统计学意义,见图1、表2。
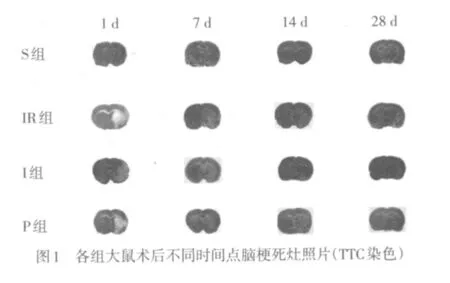
表2 各组大鼠脑梗死体积百分比 (n=6,%±s)
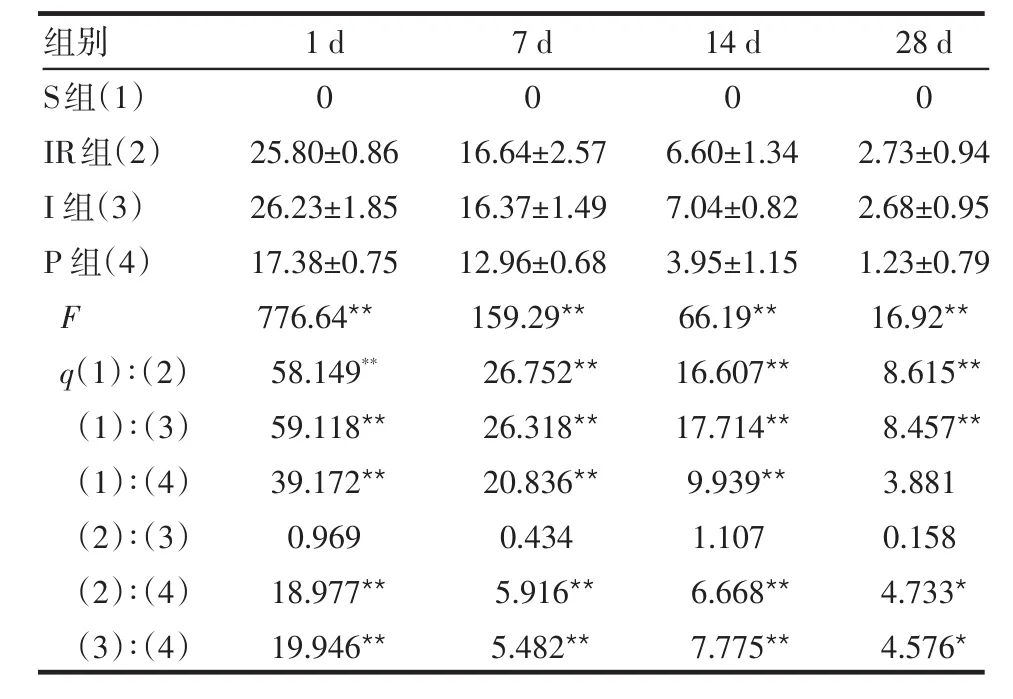
表2 各组大鼠脑梗死体积百分比 (n=6,%±s)
组别S组(1)IR组(2)I组(3)P 组(4)F q(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)1 d 0 25.80±0.86 26.23±1.85 17.38±0.75 776.64**58.149**59.118**39.172**0.969 18.977**19.946**7 d 0 16.64±2.57 16.37±1.49 12.96±0.68 159.29**26.752**26.318**20.836**0.434 5.916**5.482**14 d 0 6.60±1.34 7.04±0.82 3.95±1.15 66.19**16.607**17.714**9.939**1.107 6.668**7.775**28 d 0 2.73±0.94 2.68±0.95 1.23±0.79 16.92**8.615**8.457**3.881 0.158 4.733*4.576*
2.3 Morris水迷宫测试 定位航行实验中各组大鼠两周期的EL见表3、4。S组EL较IR及I组缩短(P<0.01),在8~11 d及22 d,P组较 S组 EL延长(P<0.05和P<0.01),在12 d及23~26 d,P组与 S组比较差异无统计学意义(P>0.05);IR组与I组之间EL差异均无统计学意义(P>0.05);P组除8和22 d外,EL均较IR组缩短,差异均有统计学意义(均P<0.05)。
表 3 各组大鼠8~12 d的EL比较 (n=6,s±s)
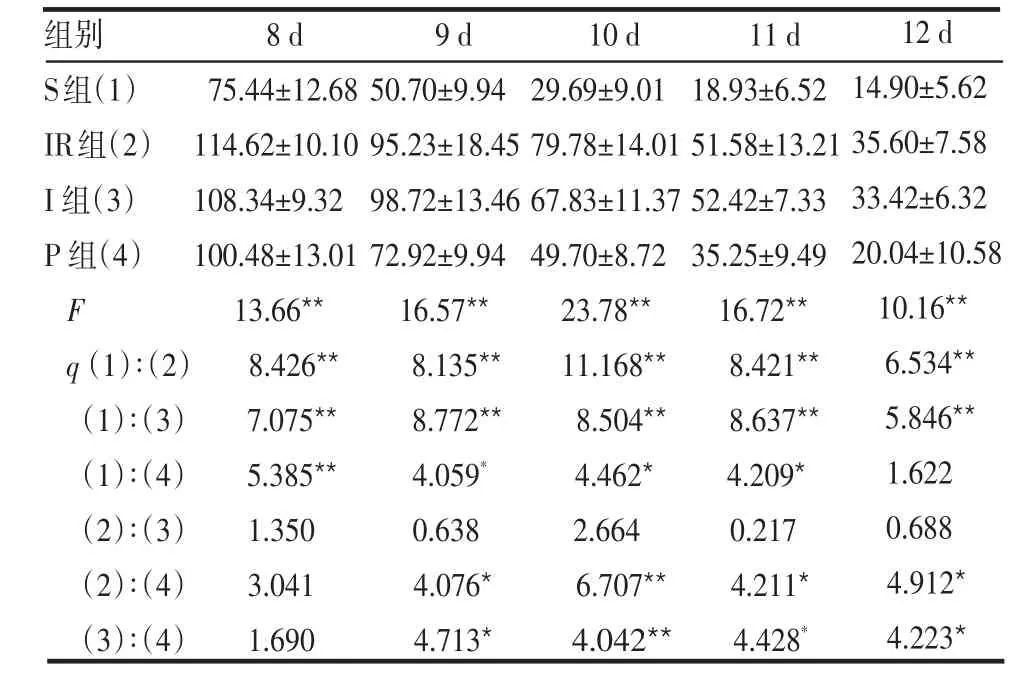
表 3 各组大鼠8~12 d的EL比较 (n=6,s±s)
组别S组(1)IR组(2)I组(3)P 组(4)F q(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)8 d 75.44±12.68 114.62±10.10 108.34±9.32 100.48±13.01 13.66**8.426**7.075**5.385**1.350 3.041 1.690 9 d 50.70±9.94 95.23±18.45 98.72±13.46 72.92±9.94 16.57**8.135**8.772**4.059*0.638 4.076*4.713*10 d 29.69±9.01 79.78±14.01 67.83±11.37 49.70±8.72 23.78**11.168**8.504**4.462*2.664 6.707**4.042**11 d 18.93±6.52 51.58±13.21 52.42±7.33 35.25±9.49 16.72**8.421**8.637**4.209*0.217 4.211*4.428*12 d 14.90±5.62 35.60±7.58 33.42±6.32 20.04±10.58 10.16**6.534**5.846**1.622 0.688 4.912*4.223*
表 4 各组大鼠22~26 d的EL比较 (n=6,s,±s)
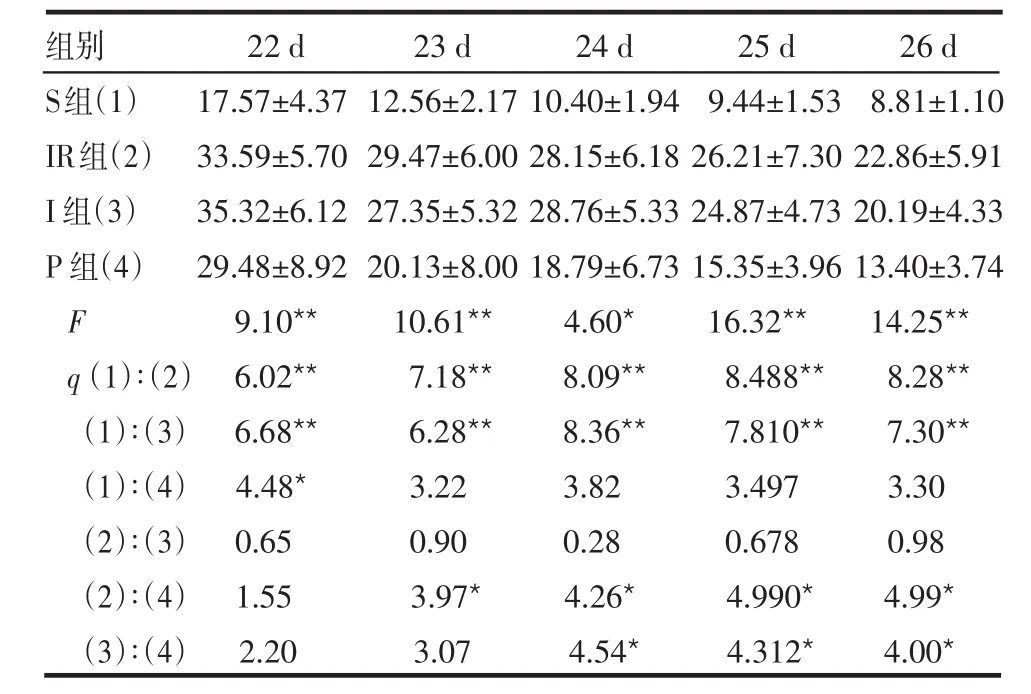
表 4 各组大鼠22~26 d的EL比较 (n=6,s,±s)
组别S组(1)IR组(2)I组(3)P组(4)F q(1)∶(2)(1)∶(3)(1)∶(4)(2)∶(3)(2)∶(4)(3)∶(4)22 d 17.57±4.37 33.59±5.70 35.32±6.12 29.48±8.92 9.10**6.02**6.68**4.48*0.65 1.55 2.20 23 d 12.56±2.17 29.47±6.00 27.35±5.32 20.13±8.00 10.61**7.18**6.28**3.22 0.90 3.97*3.07 24 d 10.40±1.94 28.15±6.18 28.76±5.33 18.79±6.73 4.60*8.09**8.36**3.82 0.28 4.26*4.54*25 d 9.44±1.53 26.21±7.30 24.87±4.73 15.35±3.96 16.32**8.488**7.810**3.497 0.678 4.990*4.312*26 d 8.81±1.10 22.86±5.91 20.19±4.33 13.40±3.74 14.25**8.28**7.30**3.30 0.98 4.99*4.00*
3 讨论
参照Longa法制作的大鼠MCAO局灶性脑缺血再灌注模型是研究脑缺血的经典模型。在局灶性脑缺血再灌注损伤中,梗死部位多反映在大脑皮质及基底节区,缺血后多伴随功能性的改变。因此本研究通过形态学和功能学相结合的方法评价脑损伤状况,mNSS评分和梗死体积测量是评价脑缺血再灌注损伤的金指标。海马区神经元对缺血缺氧耐受能力较差,脑缺血会直接或间接引起海马区神经元的变性坏死,不同程度影响个体的学习及记忆功能[7]。本研究应用Morris水迷宫对大鼠脑缺血损伤后空间学习记忆能力进行客观评价,从另一方面反映大鼠神经功能缺损情况。
药物后处理通过药物激发或模拟机体内源性物质(如腺苷、缓激肽等),从而发挥脑保护作用,以药物替代缺血刺激,较缺血后处理在临床上更具有应用价值。静脉麻醉药丙泊酚由于能降低脑氧代谢率及颅内压等脑生理药理学特性,被认为是神经外科手术较为理想的麻醉用药。笔者前期研究结果显示于再灌注血流再通即刻给予丙泊酚10和20 mg·kg-1·h-1后处理30 min对脑缺血再灌注损伤具有急性期保护作用,能够减少脑梗死体积和细胞凋亡,改善神经缺损评分,20 mg·kg-1·h-1组效果更明显[3],但其是否具有长时程保护作用的研究尚少见。临床上应用的丙泊酚多以甘油、卵磷脂、大豆油等脂质成份作为赋形剂,主要成分为多不饱和脂肪酸,具有促炎症反应和免疫抑制效应[8]。
本研究结果显示,丙泊酚脂质溶剂成分并不参与调控或介导丙泊酚后处理的长时程脑保护作用,再灌注即刻给予丙泊酚20 mg·kg-1·h-1后处理4 h,从总体上能够明显改善mNSS评分、减小大鼠脑组织梗死体积及改善缺血大鼠的学习记忆水平,从形态和功能两方面表明丙泊酚后处理具有长时程的脑保护作用,且其保护时间窗至少长达缺血后28 d,且这种脑保护作用可能最终通过缩小脑梗死体积及改善神经功能来实现。
综上所述,丙泊酚缺血后处理有一定的长时程脑保护作用,且这种作用可维持至28 d,与脂质溶剂成分无关。
[1]马婕,董志,李勤耕,等.丙泊酚对实验性脑出血大鼠的脑保护作用[J].药学学报,2009,44(4):344-349.
[2]Chen L,Xue Z,Jiang H.Effect of propofol on pathologic time-course and apoptosis after cerebral ischemia-reperfusion injury[J].Acta An⁃aesthesiol Scand,2008,52(3):413-419.
[3]Wang HY,Wang GL,Yu YH,et al.The role of phosphoinositide-3-ki⁃nase/Akt pathway in propofol-induced postconditioning against fo⁃cal cerebral ischemia-reperfusion injury in rats[J].Brain Res,2009,1297:177-184.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cere⁃bral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5]Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous ad⁃ministration of bone marrow stromal cells after cerebral ischemia in rats[J].Stroke,2001,32(4):1005-1011.
[6]Xing B,Chen H,Zhang M,et al.Ischemic postconditioning inhibits apoptosis after focal cerebral ischemia/reperfusion injury in the rat[J].Stroke,2008,39(8):2362-2369.
[7]Vorhees CV,Williams MT.Morris water maze:procedures for assess⁃ing spatial and related forms of learning and memory[J].Nat Pro⁃toc,2006,1(2):848-858.
[8]Das UN.Perinatal supplementation of long-chain polyunsaturated fatty acids,immune response and adult diseases[J].Med Sci Monit,2004,10(5):HY19-25.

