含血栓曲张静脉管壁肥大细胞浸润分布与定量研究
褚海波,严 菲,徐永波,王 涛,郭文君
下肢大隐静脉曲张是周围血管外科最常见的疾病之一。已共识深或浅瓣膜功能不全是静脉曲张形成的重要因素,继发性或原发性静脉高压是导致管壁不规则性扩张的主要原因,由此产生薄壁理论和重塑理论[1,2]。此外,遗传、激素、静脉壁新陈代谢能力下降等因素亦会影响静脉管壁的扩张[3-5]。近年来,许多学者从不同角度对曲张静脉管壁中内皮细胞、平滑肌细胞及炎症介质的变化做了深入细致的研究[2,6]。本研究旨含血栓的曲张大隐静脉管壁肥大细胞的浸润程度,寻找静脉血栓形成与静脉管壁炎症反应的关联性,为其临床治疗提供新的理论依据。
1 资料与方法
1.1 一般资料 选取笔者所在医院2008-10~2010-05行高位结扎剥脱加旋切治疗的大隐静脉曲张患者22例,术中取膝关节下方(不含静脉瓣)大隐静脉主干3~4 mm。经彩色多谱勒超声判断分为静脉曲张并血栓形成组(血栓组)和单纯静脉曲张组(曲张组)。血栓组11例,男7例,女4例;年龄45岁,平均32~54岁。曲张组11例,男6例,女5例;年龄46岁,平均33~55岁。另设对照组为本院骨科行截肢术而大隐静脉正常无损伤患者共8例,男5例,女3例;年龄41岁,平均20~49岁。排除标准:下肢严重水肿(有深静脉瓣功能不全表现);静脉曲张伴皮肤改变;血栓性静脉炎(非急性期);动脉疾病及糖尿病者。
1.2 方法 将收集到的曲张和正常大隐静脉主干管壁标本共30份,常规石蜡切片(每个蜡块切5张片)脱蜡入水,加入1%甲苯胺蓝溶液20 min,蒸馏水洗,95%乙醇分化,使切片清晰即可,自来水清洗,常规脱水、透明、树胶封固。
1.3 结果判定 肥大细胞胞质内充满具有异染性的粗大圆形嗜碱性颗粒,与甲苯胺蓝结合在光学显微镜下呈深紫红色,易于辨认。在400倍光学显微镜下计数整个管壁肥大细胞数目,再计数标本所有的视野数,然后计算两者比值作为每个高倍镜视野下细胞数,5张切片求得的平均值作为该标本的肥大细胞数目。
1.4 统计学处理 采用SPSS16.0统计软件,数据用±s表示,显著性分析,计量资料3组间采用单因素方差分析,两两比较采用SNK法。
2 结 果
2.1 血管壁肥大细胞的分布 肥大细胞体积大,呈圆形、卵圆形、短梭形或星形,细胞核小,呈圆形或椭圆形,染色浅,位于细胞中央,胞质丰富,充满细小的蓝紫色颗粒。血栓组外膜肥大细胞明显增多呈“聚集征”,有些胞质颗粒减少,呈脱颗粒现象,中膜、内膜肥大细胞均呈散在增多,在部分血栓的机化周围肥大细胞呈“灶状”分布(图1、2);曲张组外膜、中膜、内膜均见少量肥大细胞(图3、4);对照组在血管外膜层滋养血管的周围肥大细胞呈零散分布,中膜和内膜未见。
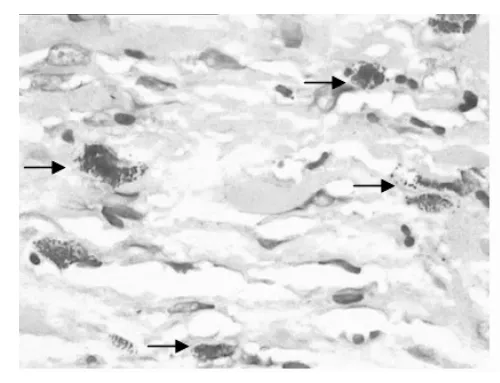
图1 血栓组外膜肥大细胞(甲苯胺蓝染色×400,箭头所示)
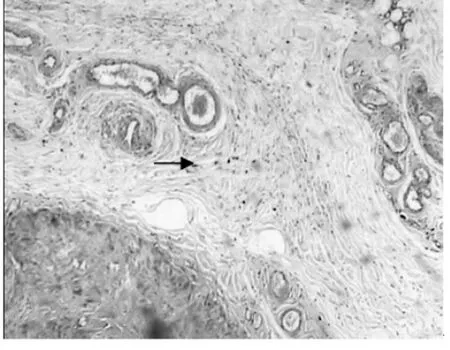
图2 血栓组外膜部分滋养血管周围肥大细胞呈“集聚征”(甲苯胺蓝染色×100,箭头所示)
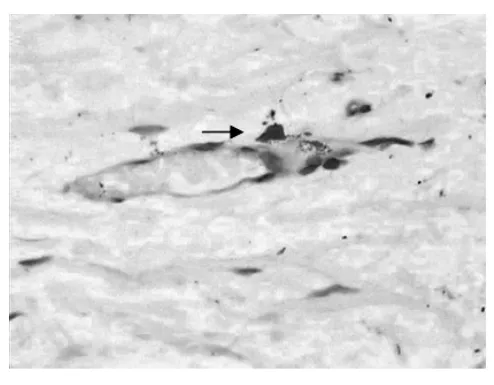
图3 曲张组管壁外膜肥大细胞(甲苯胺蓝染色×400,箭头所示)
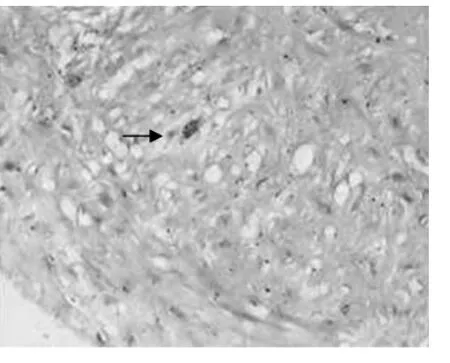
图4 曲张组管壁内膜肥大细胞(甲苯胺蓝染色×400,箭头所示)
2.2 血管壁肥大细胞的计数 血栓组血管壁外膜、中膜、内膜肥大细胞计数与曲张组、正常组之间比较均有统计学差异(P<0.05);曲张组与正常组之间比较无统计学差异 (P>0.05);各组内外膜与中膜、内膜之间比较均有统计学差异(P<0.01);内膜与中膜之间比较差异均无统计学差异 (P>0.05),见表 1。
表1 各组静脉管壁内、中、外膜肥大细胞计数(个/HP,±s)
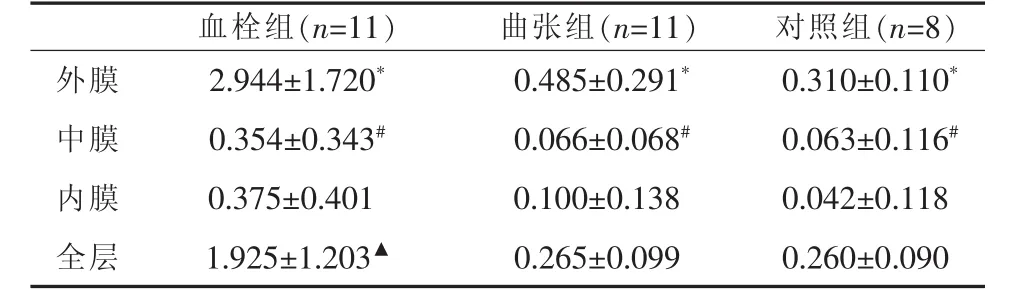
表1 各组静脉管壁内、中、外膜肥大细胞计数(个/HP,±s)
与中膜、内膜比较,*P<0.05;与内膜比较,#P>0.05;与曲张组、对照组比较,▲P<0.01
血栓组(n=11)曲张组(n=11)对照组(n=8)外膜 2.944±1.720* 0.485±0.291* 0.310±0.110*中膜 0.354±0.343# 0.066±0.068# 0.063±0.116#内膜 0.375±0.401 0.100±0.138 0.042±0.118全层 1.925±1.203▲ 0.265±0.099 0.260±0.090
3 讨 论
肥大细胞是具有强嗜碱性颗粒的组织细胞,常分布于结缔组织和黏膜上。它与血管有密切的关系,尤其在皮肤或皮下的血管内,肥大细胞分布广泛,并且参与Ⅰ型超敏反应、炎症反应、免疫反应[7]。肥大细胞可以产生、储存和释放各种血管活性物质,包括组胺、花生四烯酸、肝素、白三烯、前列腺素、类胰蛋白酶及多种细胞因子。这些被释放的血管活性物质,能激活中性粒细胞、单核细胞、嗜碱性粒细胞、嗜酸性粒细胞,吸引更多的淋巴细胞和单核吞噬细胞,促进T细胞及其它白细胞分泌细胞因子,影响炎性细胞的增生、分化、迁移、趋化、活化,启动炎症反应,参与曲张静脉壁的病理变化和结构重塑[8,9]。肥大细胞还能被各种T细胞介导的炎症过程激活,如T细胞来源的介质β-趋化因子能直接诱导肥大细胞脱颗粒[10]。正常情况下,肥大细胞主要分布在血管壁外膜,参与外膜成分的构成,并与滋养血管的功能密切相关。即内皮细胞可介导肥大细胞增殖,肥大细胞可通过分泌胰蛋白酶产生新生滋养血管,增加对血管壁的氧供[11]。
血管炎症反应是机体的一种保护性反应,它可以产生组织因子、粘附分子前炎症细胞因子、血栓形成前的血栓驱动微粒,发生级联效应加速纤维蛋白沉积,形成血栓[12]。当下肢静脉曲张时,抑制血小板粘附和抗凝血作用的内皮细胞被损伤或激活,启动局部的炎症反应,形成血栓前状态[13]。静脉高压、血流减慢、静脉扩张及静脉瓣变形,均可满足血栓形成的条件[14]。有研究发现,形成血栓的曲张静脉炎细胞浸润大隐静脉比小隐静脉更易发生,曲张静脉的血栓可以影响静脉壁细胞成分的重塑,炎性细胞可以参与血栓的机化和再通[15-17]。
有关肥大细胞浸润与曲张静脉管壁重塑之间关系的研究,国内外已有多家报道,但其结果颇有争议。有研究发现,曲张静脉组管壁中肥大细胞的浸润明显高于正常静脉组(P<0.05),认为肥大细胞可能参与静脉曲张的形成和重塑过程,并通过释放介质在血管病理生理的改变中发挥其作用[8,18]。有些研究结果却恰恰相反,即曲张静脉和正常静脉血管壁的肥大细胞含量相同,认为肥大细胞浸润与静脉高压无相关性[11,19,20]。
本文结果显示,血栓组血管壁外膜肥大细胞明显增多,在滋养血管周围呈现“聚集征”,中膜、内膜呈散在增多;曲张组血管壁外膜、中膜、内膜肥大细胞均呈零散分布,且无规律;对照组血管壁仅在外膜有肥大细胞散在分布。从血管壁肥大细胞浸润的定量分析看,有如下特点:①血栓组肥大细胞在外膜、中膜、内膜计数均多于曲张组和正常组(P<0.05);②曲张组与正常组之间无显著性差异(P>0.05);③各组内外膜多于中膜和内膜(P<0.01);④中膜与内膜之间变化无显著性差异(P>0.05)。结果表明,血栓组血管壁肥大细胞浸润--外膜呈“聚集征”,这一血管壁细胞重塑现象与静脉血栓形成可能有密切的关系。提示静脉血栓的形成,可能会加重血管壁的缺氧,诱发肥大细胞在血管壁各层的重新分布,可谓一种血管壁自身的保护性反应。笔者可以推断,在下肢静脉曲张的发生、发展过程中,炎症和血栓形成相互作用,伴随血栓形成,大量的肥大细胞可通过外膜、中膜、内膜的滋养血管迁移并浸润到静脉壁,它符合炎症与血栓形成相互作用的规律性。由此可见,静脉血栓形成和慢性炎症可能是导致血管壁肥大细胞大量浸润的重要因素。
[1]Miller SS.Investigation and management of varicose veins[J].Ann R Coll Surg Engl,1974,55(5):245-252.
[2]Gibbons GH,Dzau VJ.The emerging concept of vascular remodeling[J].N Engl J Med,1994,330(20):1431-1438.
[3]Glowinski J,Glowinski S.Generation of reactive oxygen metabolites by the varicose vein wall[J].Eur J Vasc Endovasc Surg,2002,23(6):550-555.
[4]Wali MA,Eid RA.Intimal changes in varicose veins:an ultrastructural study[J].J Smooth Muscle Res,2002,38(3)63-74.
[5]Kendler M,Makrantonaki E,Tzelles T,et al.Elevated sex steroid hormones in great saphenous veins in men[J].J Vasc Surg,2010,51(3):639-646.
[6]Smith PDC,Thomas P,Scurr JH,et al.Cause of venous ulceration:a new hypothesis[J].Br Med J(Clin Res Ed),1988,296(6638):1726-1727.
[7]Borish L,Joseph BZ.Inflammation and the allergic response[J].Med Clin North Am,1992,76(4):765-787.
[8]Yamada T,Tomita S,Mori M,et al.Increased mast cell infiltration in varicose veins of the lower limbs:a possible role in the development of varices[J].Surgery,1996,119(5):494-497.
[9]Yamada T,Yamamoto H,Ogawa A,et al.Ultrastructural demonstration of mast cells in varicose veins of lower limbs:presence of mast cell-mediated mechanism[J].Cardiovascular Surgery,1997,38(5):443-446.
[10]Mekori YA,Metcalfe DD.Mast cell-T cell interactions[J].J Allergy Clin Immunol,1999,104(3):517-523.
[11]Kakkos SK,Zolota VG,Peristeropoulou P,et al.Increased mast cell infiltration in familial(a)varicose veins:Pathogenetic implications[J].Int Angi,2003,22(1):43-48.
[12]Myers DD,Wakefield TW.Inflammation-dependent thrombosis[J].Front Biosci,2005,10(9):2750-2757.
[13]李玉林.病理学[M].第6版.北京:人民卫生出版社,2004.51-57.
[14]Bergan JJ,Schmid-Schnbein GW,Smith PDC,et al.Chronic venous disease[J].N Engl J Med,2006,355(5):488-498.
[15]Sobreira ML,Yoshida WB,Lastória S.Superficil thrombophlebitis:epidemiology,physiopathology,diagnosis and treatment[J].J Vasc Bras,2008,7(2):131-143.
[16]Wakefield TW,Myers DD,Henke PK.Mechanisms of venous thrombosis and resolution[J].Arteriostero Thromb Vasc Biol,2008,28(3):387-391.
[17]Nosaka M,Ishida Y,Kimura A,et al.Time-dependent appearance of intrathrombus neutrophils and macrophages in a stasisinduced deep vein thrombosis model and its application to thrombus age determination[J].Int J Legal Med,2009,123(3):235-240.
[18]Sayer GL,Smith PDC.Immunocytochemical characterisation of the inflammatory cell infiltrate of varicose veins[J].Eur J Vasc Endovasc Surg,2004,28(11):479-483.
[19]Haviarová Z,Weismann P,Pavlíková D,et al.Mast cell infiltration in the wall of varicose veins[J].Acta Histochem,2002,104(4):357-360.
[20]褚海波,王国华,王 涛,等.大隐静脉曲张管壁肥大细胞浸润分布与定量研究[J].中华普通外科学文献(电子版),2010,4(2):20-21.

