通路相关不确定系数在化学品风险评定中的应用
龙再浩 马中春 陈小青
(宁波出入境检验检疫局 浙江宁波 315012)
1 前言
对外源化合物风险评定的重要目的是获得化合物的无显著健康危害的人体暴露水平。化合物风险评定方法取决于化合物的毒性效应,而毒性效应有非阈值效应和阈值效应。前者主要是通过剂量-反应关系,结合低剂量外推来定量评估暴露水平的人体健康危险;后者则是依据动物或人体试验中获得阈值(不出现健康危害的剂量),然后除以不确定/安全系数(UF)得到安全限量值。
2 不确定系数
最早引入UF概念的是美国FDA,它最初被用于确定食品添加剂和环境污染物的法定限量。Lehman和Fitzhugh(1954)最早提出UF概念,并建议将100倍作为缺省UF。一般认为不确定性主要来源有:从动物外推到人类之间物种间差异;人群内部的个体间差异。100倍UF可分为2个独立的10倍系数,分别用于表示物种间变异和个体间变异程度。每个10倍系数又可进一步细分为毒代学和毒效学变异,100.6(4)和 100.4(2.5)值分别代表物种间毒代学和毒效学差异,2个相同100.5(3.16)值代表个体间毒代学和毒效学上差异[1]。除了缺省系数外,UF还有通路相关不确定系数(PRUF)和化学特异性调节因子(CSAF)[2]。使用CSAF时需要化合物详尽的化学特异性毒代学和毒效学数据,但这类数据很少;但如果知道化合物的代谢通路时,则可使用PRUF作为缺省系数和CSAF间中间选择。
3 外源化合物的代谢通路
外源化合物体内代谢和消除过程包括I相反应、II相反应和肾脏排泄。I相反应包括氧化、还原和水解反应。II相反应主要是结合反应,包括葡糖醛酸结合、硫酸结合、甘氨酸结合、N-乙酰化(NAT)、甲基化。化合物代谢主要通过代谢酶来实现,其中参与 I相反应代谢酶主要有 CYP1A2、CYP2A6、CYP2C9、CYP2C19、CYP2D6、CYP2E1、CYP3A4、ADH 和 Hydrolysis。研究认为 CYP1A2、CYP2A6、CYP2E1、CYP3A4、乙醇脱氢酶、水解、葡萄糖醛酸结合、硫酸结合和甘氨酸结合等代谢消除途径被认为是单态性通路;而 CYP2C9、CYP2C19、CYP2D6和NAT被认为是多态性通路。代谢酶遗传多态性差异会使携带该酶多态性基因的个体由于酶表达数量、功能改变,从而导致人群中有少部分个体或表现出对外源化合物的代谢能力速率减慢,被称为慢代谢型(Poor Metabolizer,PM);或表现出代谢能力速率提高,被称为快代谢型(Extensive Metabolizer,EM)。
根据Renwick等对药物代谢数据的研究认为:缺省代谢系数(3.16)不能覆盖多态性通路的人体变异以及健康成年人和新生儿之间的差异。Dorne[1,3]等依据外源化合物在人体内代谢通路的类型,制定出覆盖不同人群/人群百分位的不确定系数,即 PRUF。
4 单态性代谢通路
健康成人单态性代谢通路研究表明,除了CYP3A4变异范围为46%,其他单态性代谢通路包括 CYP1A2、CYP2E1、ADH、水解、葡糖醛酸结合、甘氨酸结合、磺酸结合以及肾脏排泄个体间代谢变异范围为21% -32%[4-12]。根据健康成人单态性代谢通路的变异程度计算出相应代谢通路PRUF(见表1)均低于 3.16,其中除了 CYP3A4 为 2.7,其他单态性代谢通路 PRUF为1.6-2.2(本文中PRUF均为覆盖所在人群第99百分位)。这表明当健康成人暴露化合物属于单态性代谢时,缺省代谢系数在确保安全性方面是非常保守。
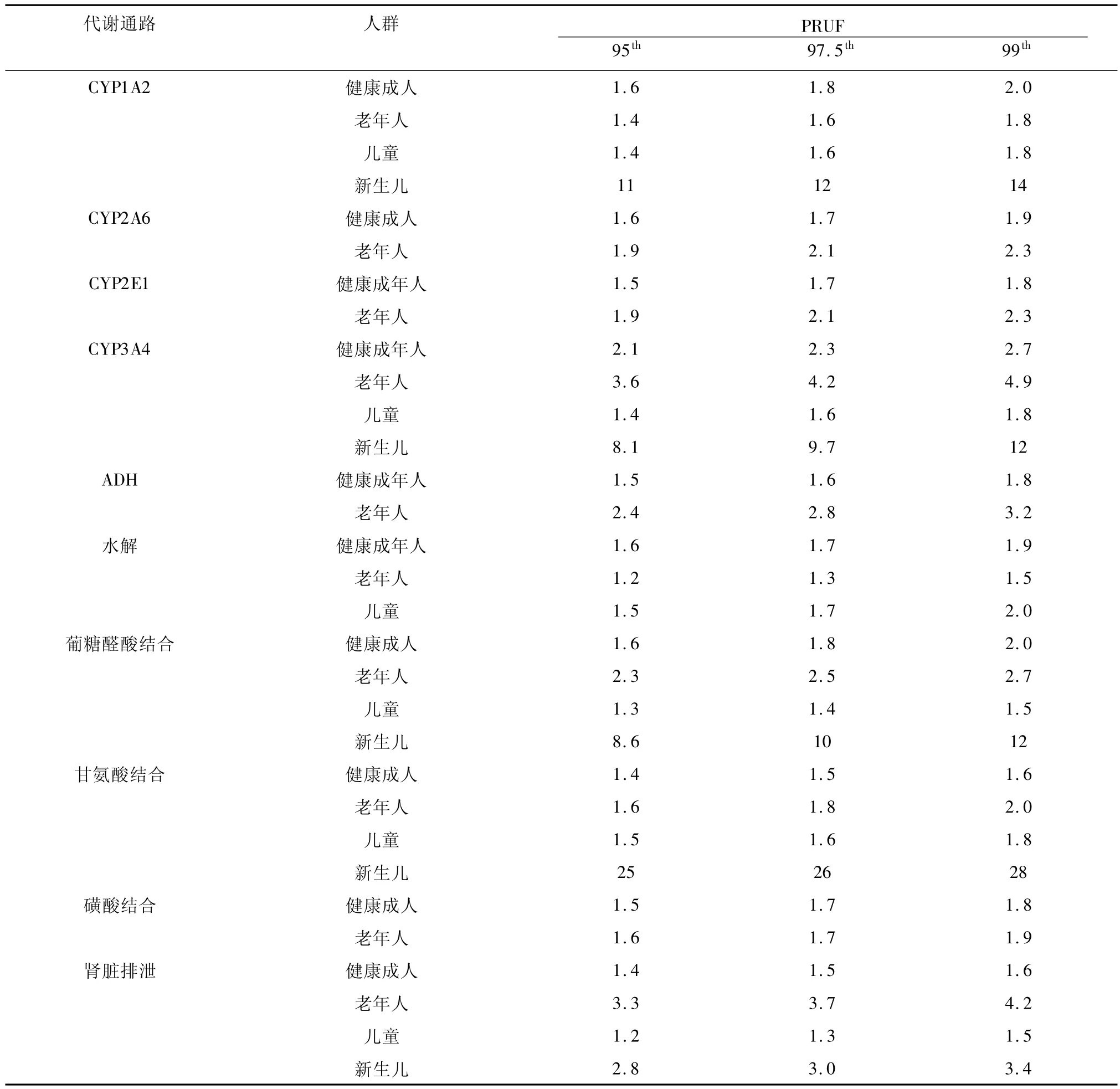
表1 单态性代谢通路的PRUF
在老年人单态性代谢通路中,除了CYP3A4和肾脏排泄分别为 4.9 和 4.2 外[8,10,11],其他大多数单态性代谢通路PRUF都低于3.16。造成老年人与成年人在单态性代谢上变异原因主要是由于年龄因素影响肝脏和肾脏功能。
在种族/民族单态性代谢通路中,大多数单态性代谢通路的 PRUF均低于3.16,但代谢途径CYP3A4 和水解除外[8,10],其中 CYP3A4 在非洲人(3.8)、南亚人(4.8)和墨西哥人(7.5);水解途径在亚洲人的PRUF为3.9。
新生儿虽然占人群比例不高,但新生儿阶段是每个人必经生命阶段,因此了解其代谢通路是非常重要。但新生儿化合物的代谢数据非常少,目前只对单态性通路CYP1A2、CYP3A4、葡糖醛酸结合、甘氨酸结合和肾脏排泄的不确定系数进行研究。研究表明这5种代谢通路新生儿PRUF都超过了3.16,分别为 14、12、12、28 和 3.4。推测认为新生儿PRUF系数高原因是因为新生儿体内代谢酶多数未成熟,导致代谢功能缺陷[5,6,8,10,11]。
5 多态性代谢通路
健康成人4种多态性代谢通路 CYP2D6、CYP2C9、CYP2C19和NA个体间变异性与UF关系研究表明:多态性通路PRUF(见表2)多数都大于3.16,这说明缺省代谢系数不能充分确保暴露于多态性通路代谢化合物的健康成人的安全。
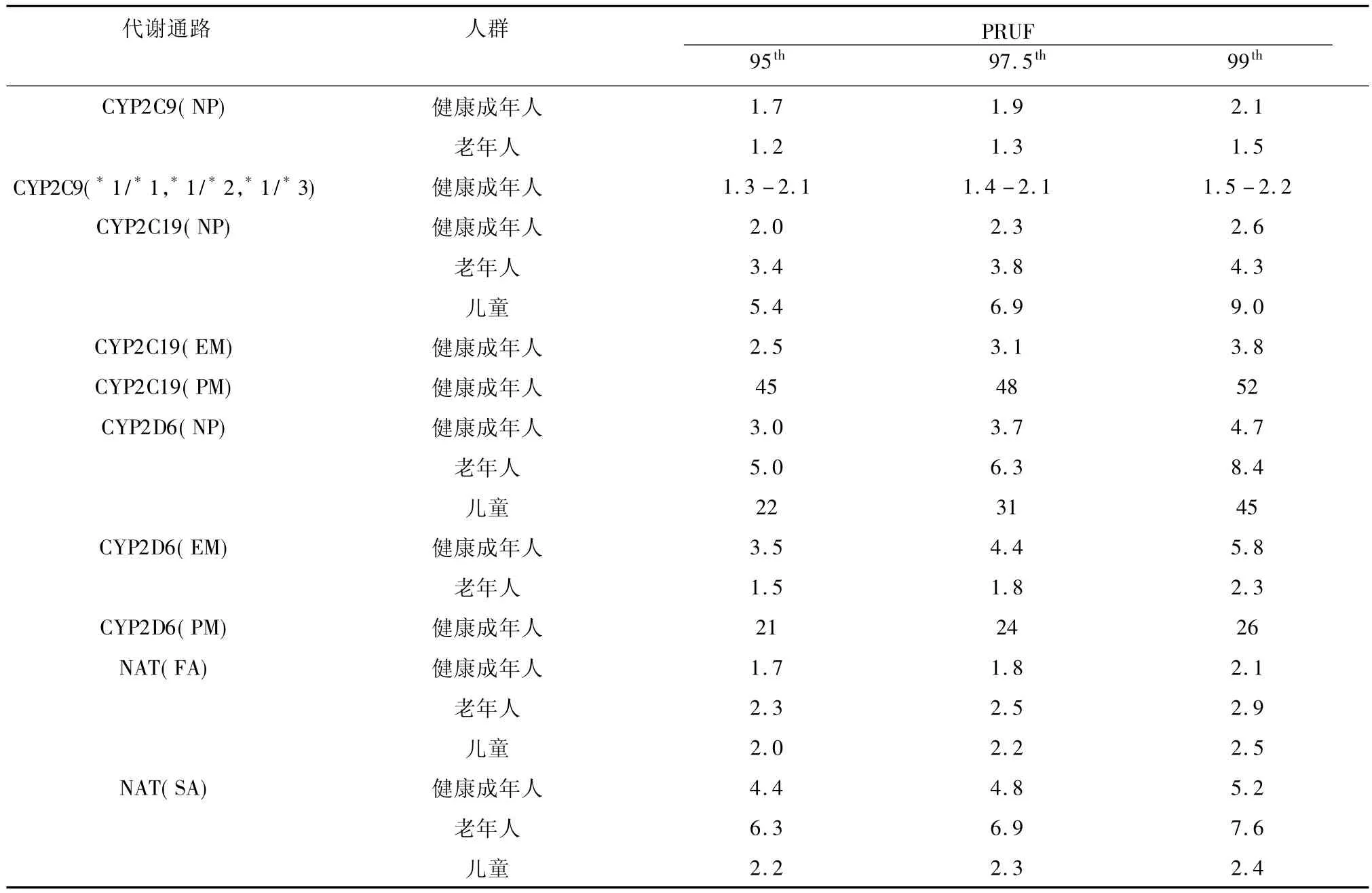
表2 多态性代谢通路的PRUF
多态性代谢通路会导致人群对同一种化合物的代谢能力发生较大变异,出现少数代谢能力/速率增强个体(称为EM或FA)或减弱个体(称为PM或SA)。因此,如果要覆盖PM(代谢通路CYP2D6和CYP2C19)和SA(代谢通路NAT)人群,则代谢通路CYP2D6、CYP2C19和 NAT PRUF分别为 26、52和5.2。研究发现EM人群通过通路 CYP2D6或CYP2C19对化合物的代谢程度与代谢通路PRUF之间存在指数关系,因此如果缺省代谢系数3.16要确保暴露于通过CYP2D6或CYP2C19代谢的化合物的PM人群安全性,则化合物在EM个体中被CYP2D6或CYP2C19代谢程度不超过25%。在代谢通路CYP2C9中,只有PM中CYP2C9*3/*3表型的 PFUF(6.5)超过 3.16[7,9,10],这与人群中代谢酶表型频率差异相关。
不同人群中代谢酶表型分布有明显的种族或地域差异,这是缺省代谢系数3.16不能覆盖多态性代谢通路大多数种族间代谢差异的主要原因。对于代谢通路CYP2D6,亚洲健康成人EM个体清除率高于一般健康成人EM个体,PM个体清除率与一般健康成人非表型个体(NP)之间无差异,因此对于代谢通路CYP2D6,亚洲EM和PM个体PRUF都低于3.16[7]。与 CYP2D6 代谢相反,对于代谢通路CYP2C19,亚洲健康成人EM个体高于一般健康成人EM个体,亚洲人出现PM频率(14% -21%)高于白种人(3%),并且一般健康成人EM和PM之间内剂量差异高于亚洲人,因此一般健康成人PM个体PRUF高于亚洲成人PM。在亚洲健康成年人也发现:EM个体通过代谢通路CYP2C19对化合物的代谢程度与UF之间有指数关系[9]。依据上述关系,假设缺省代谢系数3.16能覆盖亚洲PM个体,则PM个体暴露化合物应具备被EM个体通过CYP2C19代谢程度为15% -20%的特性。对于能被EM个体通过CYP2C19代谢比超过60%或以上的化合物,亚洲PM个体相应代谢通路PRUF为28,低于一般健康成人PM的PRUF(52)。
老年人与一般健康成人在多态性代谢通路的毒代学差异主要是年龄因素导致的肝功能降低。对于老年人,代谢通路 CYP2D6(NP)、CYP2C19(NP)和 NAT(SA)的 PRUF 分别为 8.4、4.3 和7.6[7,9]。目前还没有老年 PM 个体数据,但是考虑到老年人细胞色素P450酶活性降低,预计老年PM个体比一般健康成年PM的清除率低。
关于新生儿多态性代谢通路,目前只有代谢通路CYP2D6研究,而且只有2个新生儿PM个体代谢数据:新生儿表现出很高的内剂量(分别为成年人19和33倍)[7]。因此如果暴露于通过CYP2D6代谢的化合物,新生儿将是最敏感的人群。
儿童的多态性代谢通路研究表明:代谢通路CYP2D6和 CYP2C19的 PRUF都大于 3.16,通路NAT的PRUF小于3.16。与成人比较,儿童在通路CYP2D6毒代学上表现出非常高的内剂量和变异性(4倍和140%),因此儿童通路CYP2D6的PRUF需要 45 才能确保安全[7,9]。
6 应用PRUF时应注意的问题
(1)要知道化合物的体内主要代谢通路包括体内代谢数据和代谢酶/特异性同工酶。前者可在低剂量或痕量暴露水平下通过人体试验获得;后者可通过体外试验如肝微粒体酶、异源性表达酶和/或酶抑制剂来获得。也可以使用体外数据结合人体生理数据通过生理药物代谢动力学(PBPK)模型来预测[13-16]。
(2)要明确化合物具体代谢通路和代谢的毒理学后果。不同代谢通路所对应的不确定系数不同。对于单态性通路,缺省代谢系数3.16足够保守,能覆盖一般健康成人;但对于多态性通路(CYP2D6、CYP2C19和NAT),缺省代谢系数3.16不能充分覆盖一般健康成人。同时明确代谢毒理学意义非常重要,风险人群取决于代谢毒理学后果。如果母体化合物是近似毒物,则PM和SA个体则是高风险人群;相反,如果代谢产物是近似毒物,则EM和FA则是高风险人群。
(3)要确定被评估化合物所覆盖的人群类别(一般健康成人、老年人、儿童、新生儿或不同种族)。代谢通路在不同人群中PRUF不同,尤其要注意单态性通路 CYP3A4和多态性通路 CYP2D6、CYP2C19,这些代谢通路在多个人群/种族中PRUF大于3.16。此外要特别关注新生儿群体,它可能是所有人群中对外源化合物最敏感的群体。
(4)PRUF有不同人群百分位值(95th、97.5th和99th),风险评估者应根据实际需要进行选择,确保能既能充分但又合理保护暴露人群[17-18]。例如,对于多态性代谢的化合物,如果我们要求选择的PRUF覆盖PM第99百分位,并且PM占全部人口的1%,则风险评估覆盖了全部人口的99.99%,这样会导致过于苛刻的风险管理;但如果选择UF覆盖全部人口第99百分位,则剩下1%是PM,但PM个体需要限量值与第99百分位估计限量值可相差到一个数量级。
7 小结
在对化学品进行风险评估时,如果事先明确化合物代谢通路的类型,使用PRUF能减少化学品风险评定中不确定性,不仅能充分确保暴露人群的安全性,还能为风险评估者提供针对不同人群类别和人群百分比的相对精确UF。
[1]Dorne J L,Renwick A G.The refinement of uncertainty/safety factors in risk assessment by the incorporation of data on toxicokinetic variability in humans[J].Toxicology Sciences,2005,86(1):20 -26.
[2]WHO.International programme on chemical safety:chemicalspecific adjustment factors for interspecies differences and human variability guidance document for use of data in dose/concentration response assessment[J]. World Health Organization,Geneva,2005.
[3]Dorne J L,Amzal B.Meta-analysis of human toxicokinetic data:an innovative Bayesian approach and its application in human risk assessment[J].Toxicology letters,2008,180(s):89 -90.
[4]Dorne J L.Impact of inter-individual differences in drug metabolism and pharmacokinetics on safety evaluation[J].Fundam Clin Pharmacol,2004,18:609 -620.
[5]Dorne J L,Walkon K,Renwick A G.Human variability in gulcuronidation in relation to uncertainty factors for risk assessment[J].Food and chemical toxicology,2001,39:1153 -1173.
[6]Dorne J L,Walkon K,Renwick A G.Uncertainty factors for chemical risk assessment.Human variability in the pharmacokinetic of CYP1A2 probe substrates[J].Food and chemical toxicology,2001,39:681 -696.
[7]Dorne J L,Walkon K,Slob W,et al.Human variability in polymorphic CYP2D6 metabolism:is the kinetic default uncertainty factor adequate[J]Food and chemical toxicology,2002,40:1633-1656.
[8]Dorne J L,Walkon K,Renwick A G.Human variability in CYP3A4 metabolism and CYP3A4-related uncertainty factors for risk assessment[J].Food and chemical toxicology,2003,41:201-224.
[9]Dorne J L,Walkon K,Renwick A G.Polymorphic CYP2C19 and N-acetylation:human variability in kinetics and pathway-related uncertainty factors[J].Food and chemical toxicology,2003,41:225 -245.
[10]Dorne J L,Walkon K,Renwick A G.Human variability for metabolic pathway with limited data(CYP2A6,CYP2C9,CYP2E1,ADH,esterases,glycine dand sulphate conjugation) [J].Food and chemical toxicology,2004,42:397 -421.
[11]Dorne J L,Walkon K,Renwick A G.Human variability in the renal elimination of foreigh compounds and renal excretion-related uncertainty factors for risk assessment[J].Food and chemical toxicology,2004,42:275 -298.
[12]Dorne J L.Human variability in hepatic and renal elimination:implication for risk assessment[J].J.Appl.Toxicol,2007,27:411-420.
[13]Dorne J L,Skinner L,Frampton G K,et al.Human and environmental risk assessment of pharmaceuticals:differences,similarities,lessons from toxicology[J].Anal.Bioanal.Chem,2007,387:1259 -1268.
[14]Dorne J L,Papadopoulos A.Do uncertainty factors take into account toxicokinetic interations?Conclusions and recommendations from the sixth framework project Nomiracle[J].Toxicology letters,2008,180:s90.
[15]Dorne J L,Bordajandi L R,Amzal B,et al.Combining analytical techniques,exposure assessment and biological effects for risk assessment of chemical in food[J].Trac- trend Anal Chem,2009,28:695 -707.
[16]Dorne J L,Walkon K,Renwick A G.Human variability in xenobiotic metabolism and pathway-related uncertainty factors for chemical risk assessment:a review[J].Food and chemical toxicology,2005,43:203 -216.
[17]Dorne J L.Metabolism,variability and risk assessment[J].Toxicology,2010,268:156 -164.
[18]Ginsberg G,Hattis D,Sonawane B.Incorporating pharmacokinetic differences between children and adults in assessing childrens risks to environmental toxicants[J].Toxicology and Applied Pharmacology,2004,198:164 -183.

