液相色谱-质谱/质谱法测定牛奶和奶粉中地塞米松残留量
马育松 葛 娜 郭春海 段文仲 陈瑞春
(1.河北出入境检验检疫局 河北石家庄 050051;2.秦皇岛出入境检验检疫局)
1 前言
地塞米松(Dexamethasone,简写为DEX),学名9α -fluoro-11β,17α,21-trihydroxy-16α -methylpregna-1,4-diene-3,20 -dione,是人工合成的肾上腺皮质激素类药物。DEX纯品为白色或近乎白色的结晶性粉末,无嗅,味苦,几乎不溶于水,溶于甲醇。
DEX具有抗炎及抗过敏作用,能抑制结缔组织的增生,降低毛细血管壁和细胞膜的通透性,减少炎性渗出,并能抑制组织胺及其他毒性物质的形成与释放,还能促进蛋白质分解转变为糖,减少葡萄糖的利用,因而使血糖及肝糖原增加,尿中可出现糖尿,同时增加胃液分泌,促进食欲。它主要用于治疗各种炎症、严重感染及传染病、过敏性疾病、风湿病、休克、代谢疾病以及引产。但长期使用DEX,可出现水肿、低血钾、肌萎缩、骨质疏松、脱钙、病理性骨折、糖尿、幼畜生长停滞等[1]。因此,世界各国严格禁止DEX作为生长激素使用,同时普遍限制此药物用于动物源性食品中,并提出了严格的限量要求[2-4]。我国及欧盟规定牛奶中DEX最高残留限量(MRL)均为0.3 μg/kg;日本农业化学品残留物肯定列表制度中规定,DEX在牛奶中的 MRL为0.02 mg/kg。因此,为了保护人类健康,促进国际贸易发展,建立一种快速、准确的检测牛奶和奶粉中DEX残留量的分析方法非常必要。
目前,测定DEX的分析方法主要包括高效液相色谱法、液相色谱 -串联质谱法等[5,6]。本方法重点研究了牛奶和奶粉样品的前处理和检测条件,建立了用乙腈提取牛奶和奶粉中的DEX残留,C18固相萃取柱净化,配有大气压化学电离源的液相色谱-串联质谱仪测定的检测方法。该方法灵敏度高,选择性好,能够同时定性和定量。
2 材料与方法
2.1 材料
2.1.1 样品
实验用牛奶和奶粉样品均为市售产品。
2.1.2 试剂
甲醇、乙腈均为色谱纯;甲酸为优级纯;超纯水;0.1%甲酸溶液:移取1 mL甲酸于装有约800 mL水的1L容量瓶中,用水定容至刻度并混匀;DEX标准物质(CAS:50-05-2):纯度大于等于99%;C18 固相萃取柱(500 mg,3 mL);0.22 μm 有机系微孔滤膜。
2.1.3 标准溶液
DEX标准储备溶液:准确称取100 mgDEX标准物质,用甲醇溶解并定容至100 mL,配成浓度为1.0 mg/mL的标准储备液。储备液在2℃ -4℃保存,可用3个月;DEX标准工作溶液:吸取适量的DEX标准储备溶液,用甲醇配成1 μg/mL 和 0.1 μg/mL两种浓度的标准工作溶液。在2℃ -4℃保存,可用1周;DEX基质标准工作溶液:根据需要吸取适量的DEX标准工作溶液,用空白样品提取液稀释成适当浓度的基质标准工作溶液,临用前配制。
2.1.4 仪器与设备
LC-MSD-Trap-VL离子阱质谱仪(美国安捷伦公司):配有大气压化学电离源(APCI);涡旋混匀器(美国 SCIENTIFIC INDUSTRIES INC,VORTEX -GENIE 2);固相萃取装置(美国 SUPELCO,VISIPRERTM DL);真空泵(德国 ABM,ME2C):真空度应达到80kPa;离心机(美国SIGMA,4K15);旋转蒸发器(德国 Heidolph,LABOROTA 4000);氮气吹干仪(北京八方世纪科技有限责任公司,BF-2000)。
2.2 方法
2.2.1 提取
2.2.1.1 牛奶样品
称取10 g试样置于50 mL具塞塑料离心管中,加入20 mL乙腈,涡旋混匀1 min,以5000 r/min离心10 min。取上清液至梨形瓶中,用旋转蒸发器于45℃水浴上减压蒸发,将提取液浓缩至体积小于5 mL。
2.2.1.2 奶粉样品
称取2 g试样置于50 mL具塞塑料离心管中,加入10 mL水,涡旋混匀30 s。以下操作同牛奶样品。
2.2.2 净化
将提取液移至经3 mL乙腈和3 mL水预处理过的C18固相萃取柱中,用5 mL水洗涤梨形瓶和萃取柱,弃去全部流出液。在65 kPa的负压下,减压抽干1 min。用5 mL乙腈以≤3 mL/min流速洗脱,收集洗脱液于10 mL样品管中,在45℃水浴中用氮气吹干,用0.50 mL流动相溶解残渣,经0.22 μm滤膜过滤后供液相色谱-串联质谱仪测定。
2.2.3 测定
2.2.3.1 液相色谱条件
(1)色谱柱:Inertsil ODS -3 C18,5μm,150 mm×2.1mm(内径);
(2)流动相:乙腈+0.1%甲酸溶液(50+50);
(3)流速:200 μL/min;
(4)柱温:40 ℃;
(5)进样量:20 μL;
2.2.3.2 质谱条件
(1)离子源:大气压化学电离源(APCI);
(2)扫描方式:正离子扫描;
(3) 定性离子对(m/z):393.2/373.2;393.2/355.2;
(4)定量离子对(m/z):393.2/373.2。
(5)其他质谱参数:喷雾压力:60 psi;干燥气体流量:5 L/min;干燥气体温度:250℃;大气压化学电离源蒸发温度:250℃;电晕电流:4000 nA;毛细管电压:1500 V。
2.2.3.3 液相色谱 -串联质谱测定
2.2.3.3.1 定性测定
比较样品谱图中各组分定性离子的相对丰度与浓度接近的混合基质标准校准溶液谱图中对应的定性离子的相对丰度,偏差不超过表1规定的范围,则可判定为样品中存在对应的待测物。

表1 定性确证时相对离子丰度的最大允许误差
2.2.3.3.2 定量测定
在上述色谱条件下,用6个不同浓度的DEX基质标准工作溶液分别进样,以基质标准工作溶液浓度为横坐标,以峰面积为纵坐标,绘制标准工作曲线。用标准工作曲线对样品进行定量,样品溶液中DEX的响应值应在仪器测定的线性范围内。
3 结果与讨论
3.1 提取净化条件的优化
因为牛奶和奶粉样品的主要杂质为大量的蛋白,所以在选择前处理操作条件时需重点关注如何去除蛋白的干扰。在参考文献资料的基础上,对Carrez试剂、不同体积的甲醇和乙腈的提取效率和去蛋白效果进行了对比。实验结果显示,对于10g牛奶和2g奶粉样品,加入20mL乙腈涡旋提取后离心,去除蛋白效果良好且基本可将DEX提取完全。
为更好去除基质的干扰并提高检测方法的灵敏度,采用固相萃取净化的方式实现对样品提取液的净化和浓缩。在本方法的研究中,对C18固相萃取柱(500mg,3mL)的使用效果进行了实验。由于提取液中含有较多的乙腈,使提取液中的DEX残留不能保留在C18固相萃取柱,因此,采用在45℃下旋转蒸发的方法除去提取液中的乙腈。实验证明,该操作步骤能够有效去除乙腈且不会造成DEX残留的损失,并且经过2.2.2后,能够有效地实现对样品提取液的净化和浓缩。
3.2 质谱条件的优化
测定所用仪器为Agilent LC-MSD-Trap-VL离子阱型液相色谱质谱联用仪。首先采用注射泵直接进样方式,以300μL/h的流速将DEX标准溶液注入大气压化学电离源中,在正离子检测方式下对DEX进行一级质谱分析(Q1扫描),得到DEX的分子离子峰。然后对DEX的分子离子峰进行二级质谱分析(子离子扫描),得到碎片离子信息,获得DEX的二级质谱图,见图1。通过对分子离子碎裂振幅的参数进行优化,使分子离子与特征碎片离子对强度达到最优,再进一步优化干燥气体温度、大气压化学电离源蒸发温度、毛细管电压、透镜电压等参数,使DEX的离子化效率达到最佳。
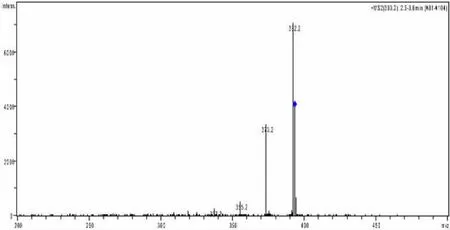
图1 DEX的二级质谱图
3.3 液相色谱条件
通过实验确定适当的液相色谱条件以取得较好的分离效果和较理想的峰形,采用该色谱条件进行检测,DEX的保留时间约3.4 min。DEX标准物质的选择离子流图见图2。
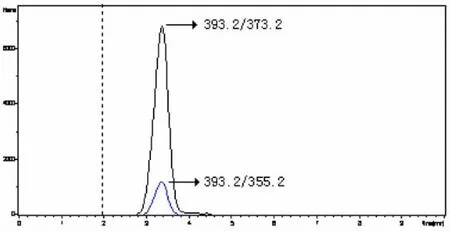
图2 DEX的选择离子流图(m/z 373.2;m/z 355.2)
3.4 线性范围
根据DEX的灵敏度,分别用牛奶和奶粉样品空白溶液配成 2.0 ng/mL、4.0 ng/mL、20.0ng/mL、100ng/mL、200ng/mL、400ng/mL 一系列基质标准工作溶液,在选定的色谱条件和质谱条件下进行测定,进样量20μL,外标法定量,峰面积对基质标准工作溶液中DEX的浓度作图,其线性范围、线性方程和线性相关系数见表2。
3.5 方法的回收率和精密度
用不含DEX的牛奶和奶粉样品进行添加回收率和精密度实验。样品中添加不同浓度标准DEX后,摇匀,使样品充分吸收,然后按本方法进行提取和净化,配备大气压化学电离源的液相色谱-串联质谱仪测定,其回收率和精密度见表3,牛奶和奶粉空白样品以及低限加标样品的选择离子流图见图3-6。从表中回收率及精密度数据可以看出,本方法回收率范围在65.0% -110.0%之间,4个水平相对标准偏差均在12.8%以内。

表2 DEX线性方程和相关系数

表3 DEX添加回收率(%)和精密度

(续表)
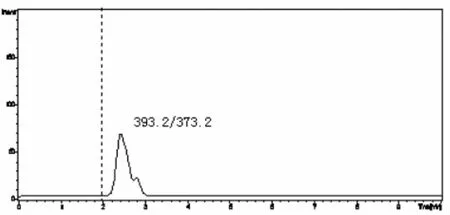
图3 牛奶空白样品的选择离子流图(m/z 373.2)
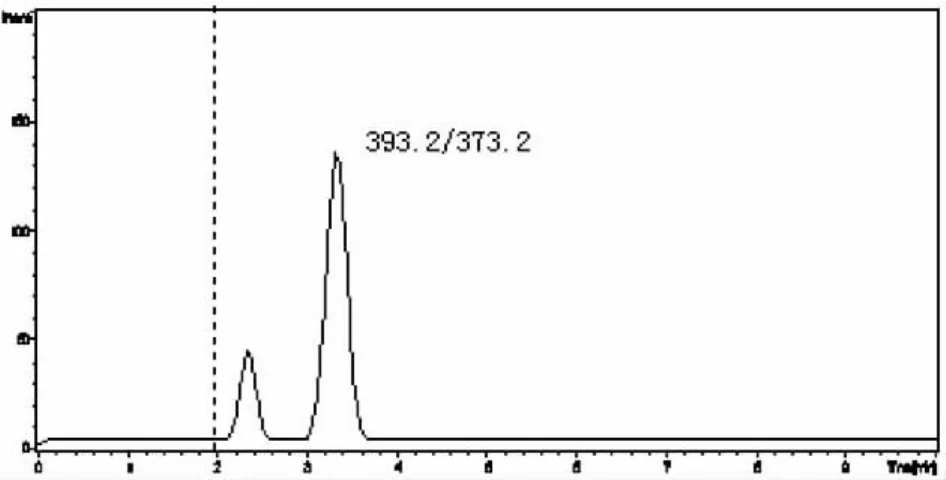
图4 牛奶加标样品(0.2 μg/kg)的选择离子流图(m/z 373.2)

图5 奶粉空白样品的选择离子流图(m/z 373.2)
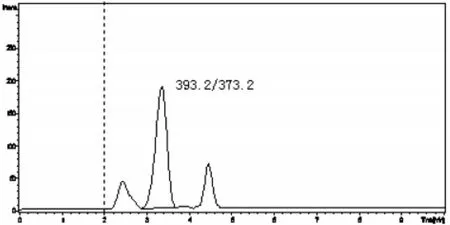
图6 奶粉加标样品(0.2 μg/kg)的选择离子流图(m/z 373.2)
4 小结
建立的测定牛奶和奶粉中DEX残留量的液相色谱质谱质谱方法,灵敏度高,准确度和精密度符合规范要求,能够满足目前国内外检测标准的需要。本方法采用配有大气压化学离子源的液相色谱-串联质谱仪作为检测手段,是基于文献调研的情况以及本实验室的实际条件。由于该仪器为离子肼型质谱仪,受其原理限制,检测结果灵敏度和重现性较目前更新型的三重四极杆型液相色谱质谱仪有一定差距。因此,如能利用三重四极杆型液相色谱质谱仪进行检测,本方法仍有较大的提升空间。
[1]阎继业.畜禽药物手册[M].北京:金盾出版社,2007.
[2]EEC Council Directive[Z]No.96/22.
[3]EEC Council Regulation[Z]No.2593/1999.
[4]林维宣.各国食品中农药兽药残留限量规定[M].大连:大连海事大学出版社,2003.
[5]DXM -SP07 Determination of Dexamethasone in bovine Muscle[S].
[6]GB/T20741-2006畜禽肉中地塞米松残留量的测定液相色谱:串联质谱法[S].

