饲料能量和维生素B6对乌鳢生长和蛋白质合成与调控的影响
吉林农业大学动物科技学院 王桂芹 李子平 牛小天
中国水产科学研究院淡水渔业研究中心 芦洪梅 韩宇田
农业部淡水鱼类遗传育种与养殖生物学重点开放实验室 赵朝阳
生长是生物体通过同化作用进行物质积累、细胞分裂或增殖的体积增大,动物真生长是结构、组织如肌肉、骨骼、器官的体积、蛋白质量的增加,所以生长多以体蛋白变化来表示(Perez,1995)。鱼类的生长实际上是通过蛋白质合成完成的,RNA/DNA与蛋白质合成、鱼类生长速度之间具有相关性,所以RNA/DNA比率能够迅速地反映鱼类当前营养状况的变化,从而在较短的时间内准确地评定饲料的营养价值。鱼类对蛋白质周转代谢受到酶、激素和基因的调控。硬骨鱼类的生长与其他脊椎动物一样,也受到脑-脑垂体-肝脏生长轴的调控。许多研究表明,饲料通过影响鱼类激素的分泌而调控生长,如饲料蛋白摄入数量和质量等(Gomez等,2004;Marti等,1996)。 但有关饲料能量和维生素B6对鱼类蛋白质合成与调控的影响报道较少(Eales等,1992)。本试验以乌鳢为试验对象,选取饲料能量和维生素B6两个重要的蛋白质代谢的调控因素,即探讨饲料能量和维生素B6分别与蛋白质的交互作用对乌鳢蛋白质合成与调控的影响,以期为进一步阐明蛋白质代谢的调控机制,为生产上优化乌鳢饲料配方,提高产量,降低成本提供试验依据。
1 材料与方法
1.1 试验饲料 以鱼粉为蛋白源,以鱼油、大豆油、糊精和面粉为能源、吡哆醇盐酸盐(Sigma)为维生素B6的来源(用前进行包膜处理)、纤维素为填充物配制半精制日粮。试验日粮为由3个蛋白水平(含34.7%、38.3%和41.8%可消化蛋白)和3个能量水平(14.5、16.0 MJ和17.5 MJ的可消化能)组合而成的9种配合饲料。试验配方及其营养组成如表1所示,其中L、M和H分别表示3个蛋白质水平,数字1、2、3分别表示3个能量水平。试验二共配制成由3个蛋白水平(34.7%、38.3%和 41.8%)和 3个维生素 B6水平(6、18 mg/kg和30 mg/kg饲料)组合而成的9种配合饲料。试验配方及其组成如表2所示,其中L、M和H分别代表3个蛋白质水平,数字1、2、3分别代表3个维生素B6水平。饲料经制粒 (1.5 mm),晒干后置于-4℃冰柜中保存、备用。
1.2 饲养管理 生长试验于2008年7月25日到2008年9月23日在安西水库池塘网箱(1 m×1 m×1 m)中进行,乌鳢鱼苗购于沈阳苏家屯,饲养于土池中2个月,试验前2 w挑选规格整齐1000尾鱼置于网箱中进行驯养,期间从冰鲜杂鱼逐渐过渡到配合饲料。待全部摄食配合饲料后,试验开始前先停食24 h,称重,随后从驯养鱼中每次随机取30尾鱼,每种饲料 3个重复,每个重复放养30尾鱼,持续饲养8 w。试验开始时从驯养鱼中随机取10尾称重。试验期间记录死鱼并称重,在试验结束前停食24 h,每个重复称重,计算特定生长率。
1.3 测定指标
1.3.1 DNA、RNA含量的测定 生长试验结束后,将鱼饥饿1 d,从每个饲料组中随机取乌鳢10尾,吸干体表水分,在每尾鱼的背鳍基部取白肌和肝胰脏作为一个样品,并于-20℃保存待测。具体方法如下:
标准曲线的测定: 配制浓度为 0、5、10、15、20 μg/mL和25 μg/mL的RNA标准液,浓度为 0.0、1.0、2.0、3.0、4.0、5.0、10.0 μg/mL 和 15.0 μg/mL DNA标准液。分别在260 nm和265 nm处测定RNA和DNA的吸收值(OD),RNA的标准曲线:y=0.0507x+0.0054 (R2=0.9997),DNA 的标准曲线:y=0.0177x+0.0006 (R2=0.9984),x 分别为 RNA 和DNA含量(μg/mL),y为RNA或DNA的OD值。
样品中核酸的测定:取0.5000~1.0000 g鱼白肌或肝胰脏,剪碎后置于玻璃匀浆器中,加入适量冷的0.01 mol/L柠檬酸三钠匀浆,制备RNA和DNA原液。同上测定其OD值,从标准曲线查得核酸的含量并计算。
1.3.2 IGF-I的测定 生长试验结束后,从每个饲料组中随机取乌鳢10尾,MS-222(100 mg/L)麻醉,用一次性医用注射器从尾静脉取血,肝素抗凝,4℃静置 24 h后,2500 r/min离心 10 min,分离血浆,-20℃保存备用。乌鳢血浆用酸醇处理,去除结合蛋白。取40 μL血清,加入360 μL酸醇液,混均,25℃放置30 min,10000转 4℃离心20 min,取上清0.2 mL,加入0.1 mLTris混均、离心,取上清液待测。乌鳢血清IGF-I含量采用IGF-I平衡饱和竞争放射免疫分析(RIA)法进行测定,试剂盒购自中国九鼎医学生物工程有限公司(中国,天津)。用放免γ测量仪进行计数,检测范围为1.25~100 ng/mL。
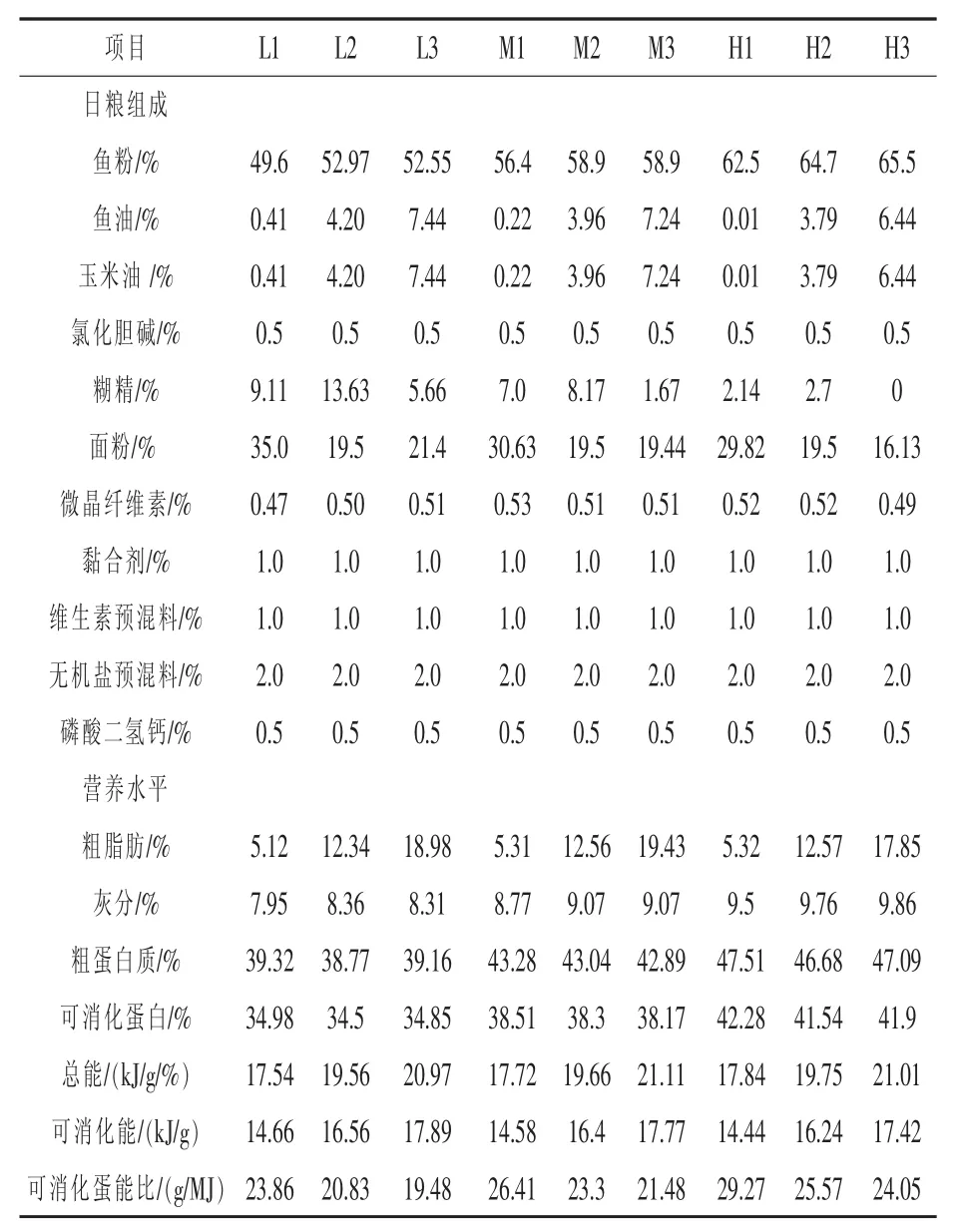
表1 试验日粮组成及营养水平(干质量)
1.4 数据处理 采用SPSS 16.0软件统计分析,用Duncan’s法进行多重比较。试验数据均以平均值±标准差表示。生长、核酸含量和血中IGF-I分别进行双变量相关分析。
2 结果
2.1 饲料能量与蛋白质的交互作用对乌鳢蛋白质合成与调控的影响 蛋白质和能量对乌鳢肌肉核酸和血中IGF-1含量的影响见表3。饲料蛋白质水平极显著影响乌鳢的RNA/DNA比率 (P<0.01),显著影响RNA含量(P<0.05)。在同一能量水平下,乌鳢的RNA/DNA比率及RNA含量均随饲料蛋白含量先升高后下降。能量水平极显著地影响乌鳢的RNA/DNA比率及RNA含量 (P<0.01)。在同一蛋白水平下,乌鳢的RNA/DNA比率及RNA含量均随饲料能量含量先升高后下降,蛋能比对乌鳢的RNA/DNA比率、RNA含量及DNA含量影响均不显著(P>0.05)。饲料蛋白质和能量水平显著影响乌鳢血清IGF-I的含量(P<0.05),IGF-I的含量均随饲料蛋白质和能量水平呈现先升高后降低的趋势。蛋能比对乌鳢的IGF-I的含量影响不显著(P>0.05)。核酸和血清中IGF-I与生长显著相关,相关系数分别是0.943*和0.876*。
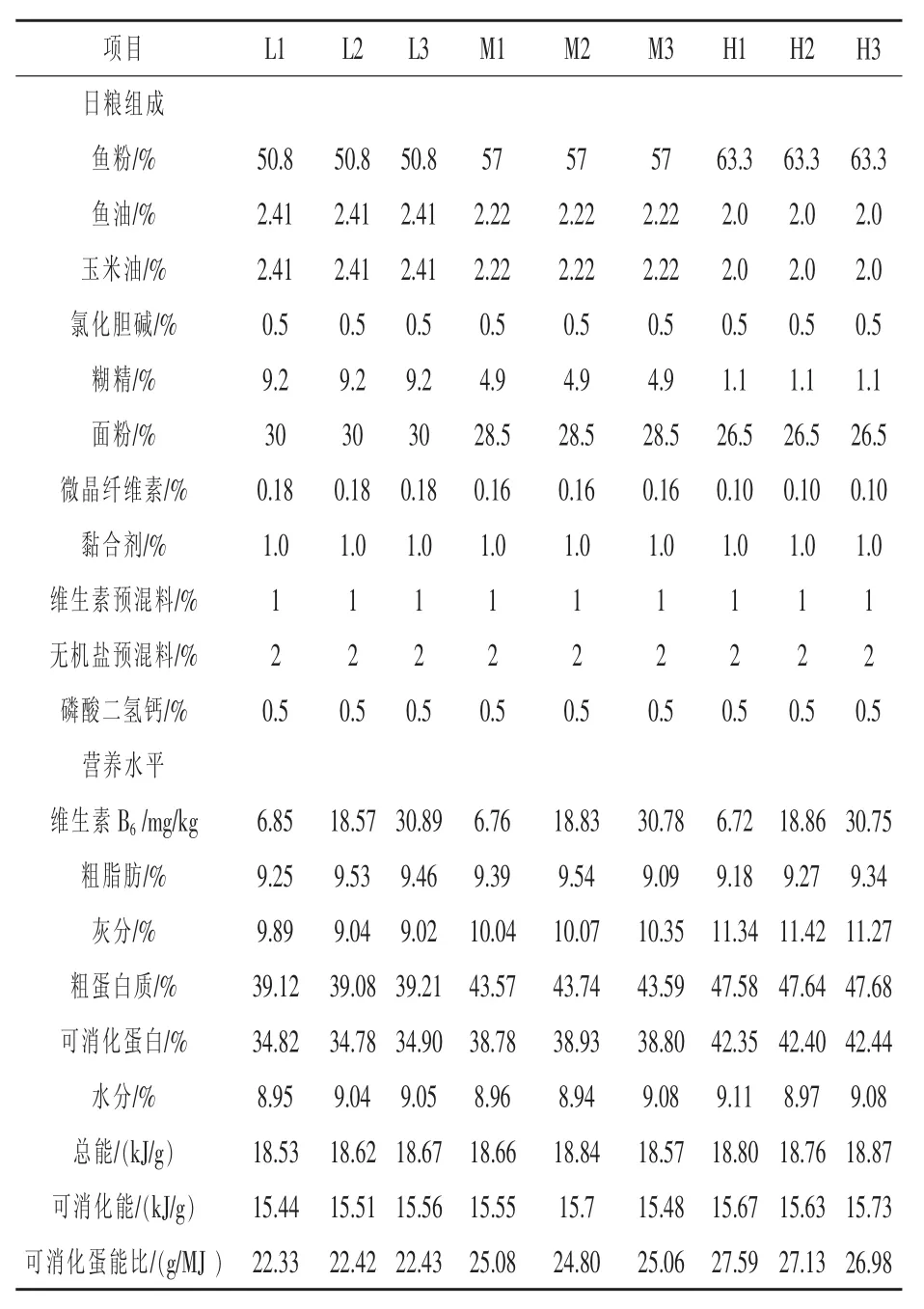
表2 试验饲料配方及其营养组成(干质量)
2.2 饲料中维生素B6与蛋白质的交互作用对乌鳢蛋白质合成与调控的影响 蛋白质与维生素B6对核酸含量和血中IGF-1的影响见表4。饲料蛋白质水平极显著影响乌鳢的RNA/DNA比率及RNA含量(P<0.01),随着蛋白质水平的增加,乌鳢的RNA/DNA比率及RNA含量呈先升高后稳定的趋势。维生素B6极显著影响乌鳢的RNA/DNA比率及RNA含量(P<0.01)。在低和中蛋白质水平下,随着维生素B6的添加,高剂量维生素B6组的RNA/DNA比率显著增加(P<0.05),高蛋白组维生素B6对乌鳢的RNA/DNA比率影响不显著(P>0.05)。在中和高蛋白水平下,随着维生素B6的添加,RNA含量有增加的趋势,但差异不显著(P>0.05),在低蛋白组,添加高维生素B6组的RNA含量显著增加(P<0.05),低添加量时与对照组差异不显著(P>0.05),饲料蛋白质和维生素B6水平及其交互作用对乌鳢的DNA含量均无显著影响(P>0.05)。饲料蛋白质水平极显著影响乌鳢血清IGF-I的含量 (P<0.01),除H3组外IGF-I的含量均随饲料蛋白质和维生素B6含量升高而升高,维生素B6及蛋白质与维生素B6交互作用对其影响不显著。核酸和血清中IGF-I与生长呈正相关,相关系数分别为0.886*和0.834*。
3 讨论

表3 饲料能量与蛋白质的交互作用对乌鳢生长、核酸与IGF-I含量的影晌
白肌是鱼类蛋白质合成用于沉积最高的组织,是表达鱼体生长最有代表性的组织。鱼类的生长主要是通过蛋白质的合成来实现的,真核生物细胞蛋白质合成是核酸数量和活性功能的体现(Higucra等,1999)。RNA/DNA 表示核糖体的数量或蛋白质的合成潜力或RNA的转录效率,亦是衡量组织蛋白质合成能力的指标,对翘嘴鲌(王桂芹等,2008)、虹鳟(Mathers 等,1993)、大菱鲆(Imsland等,2002)的研究表明,RNA/DNA不仅与鱼体的生长有关,也与鱼类的营养状况有关。本试验表明乌鳢肌肉的RNA/DNA与其生长正相关。鱼类对蛋白质周转代谢受到脑-脑垂体-肝脏生长轴的调控,生长激素的促生长效应主要是由IGF-I介导的,IGF-I是一种广谱性促细胞分裂素,能促进鸟氨酸脱氢酶的活性及细胞内DNA、RNA和蛋白质的生物合成,最终引起细胞的增殖与分化,促进蛋白质的合成和结缔组织及骨髓的产生(Tsai等,1995)。 大西洋鲑和尖吻鲈 (Anthony等,2004)、金头鲷(Perez等,1995)血浆 IGF-I浓度变化与生长正相关,本研究也得到同样的结果。表明肌肉核酸和血清IGF-I是衡量蛋白质合成和调控且反映鱼类生长速度的重要参数之一。
蛋白质合成能力和血IGF-I的分泌受到生长阶段、饲料营养状况的影响与调控。对虹鳟(Mathers等,1993)、大菱鲆(Imsland 等,2002)的研究表明,快速生长发育期的鱼类蛋白质合成能力可作为鱼类生长的衡量指标。研究表明,饲料蛋白质水平的增加促进白肌蛋白质合成能力和生长是通过增加RNA/DNA和IGF-I来实现的。对翘嘴鲌(王桂芹等,2008)、鲤鱼(Higucra 等,1998)的研究表明,饲料氨基酸的平衡程度对生长影响是通过蛋白质合成能力和IGF-I来调控的,但华益民和林浩然(2001)研究不同饲料蛋白水平对鲤鱼内分泌的影响时发现,不同蛋白质水平对IGF-ImRNA无显著影响,可能是因为IGF-I表达的调节是一个相对缓慢的过程,试验时间只有30 d的缘故。本试验表明蛋白质是调控RNA/DNA和IGF-I的合成的一个重要调节因子。关于饲料能量和维生素B6对鱼类RNA/DNA和IGF-I的影响未见报道。本试验适宜蛋能比(23.3 g/MJ)通过提高血中IGF-I的含量来调控蛋白质的合成,从而促进生长,这与对真鲷(Marti等,1996)和虹鳟(Eales等,1992)的研究结果一致,即适宜蛋能比能促进激素的分泌,从而促进生长。本试验说明可消化蛋白质水平在34.5%~42.0%时,饲料中增加维生素B6(18~30 mg/kg)的添加量,可促进蛋白质的合成,提高血中IGF-I的含量从而促进生长。这与在虹鳟(Smith等,1974)和罗非鱼(Liral等,1995)饵料中应添加足量的维生素B6,可提高蛋白质的沉积率研究结果一致。在饲料低蛋白质水平条件下,蛋白质中含氮化合物的代谢强度较低,对饲料中维生素B6的需求量也较低;在饲料高蛋白质水平下将增加机体对维生素B6的需要量,所以一定水平饲料蛋白质需要一定量的饲料维生素B6作为其代谢过程中辅酶的前体来促进生长。
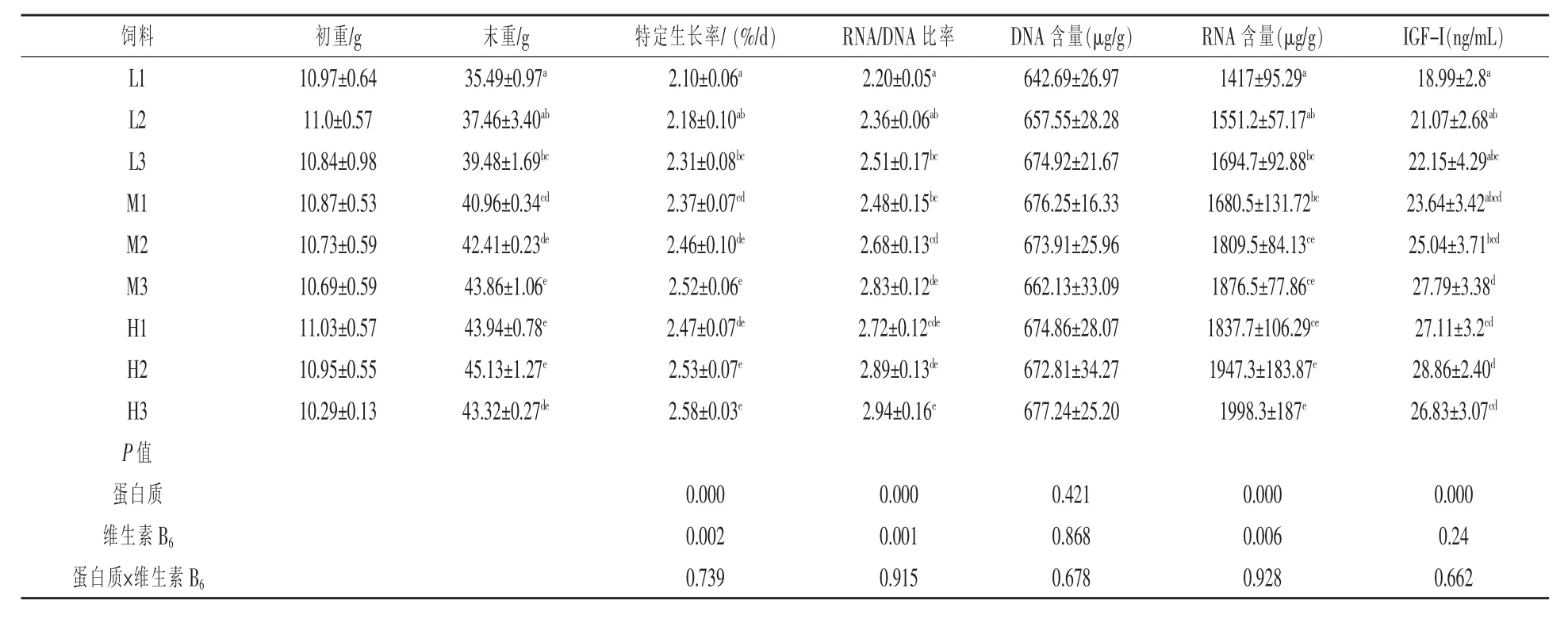
表4 饲料中维生素B6与蛋白质的交互作用对乌鳢生长、核酸与IGF-I含量的影晌
[1]华益民,林浩然.营养状况对幼年鲤鱼肝脏IGF-ImRNA表达的影响[J].动物学报,2001,47(1):94 ~ 100.
[2]王桂芹,周洪琪,陈建明,等.饲料蛋白对翘嘴鲌蛋白质合成能力的影响[J].南京农业大学学报,2008,31(2):149 ~ 153.
[3]Anthony R D,Christopher G B,Mattew P,et al.Correlation of plasma IGF-I concentrations and growth rate in aquacultured finfish:a tool for assessing the potential of new diets[J].Aquac,2004,236:583 ~ 592.
[4]Eales J G,Maclatcy D L,Higgs D A.The influence of dietary protein and calric content on thyroid function and hepatic thyrocine 5-monodeiodinase activity in rainbow trout,Oncorhynchus mykiss[J].Can J Zool,1992,70: 1526 ~ 1535.
[5]Gomez-Requeni M,Mingarro J A,Calduch-Giner F,et al.Protein growth performance,amino acid utilization and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead sea bream(Sparus aurata) [J].Aquac,2004,232:492 ~ 510.
[6]Higucra M,Garzon M C,Hidalgo,et al.Influence of temperature and dietary protein supplementation either with free or coated lysine on the fractional protein turnover rates in the white muscle of carp[J].Fish Physiol Biochem,1998,18:85 ~ 95.
[7]Higucra H,Akharbach M C,Hidalgo P.Liver and white muscle protein turnover rates in the European eel (Anguilla anguilla):effects of dietary protein quality[J].Aquac,1999,179:203 ~ 216.
[8]Imsland A K,Foss A,Bonga S W.Comparision of growth and RNA/DNA ratios in three populations of juvenile turbot reared at two salinities[J].J Fish Biol,2002,60:288 ~ 300.
[9]Liral C,Leamaster B R,Brock J A.Pyridoxine requirement of fingerling red hybrid tilapia grown in seawater[J].J Appl Aquac,1995,5(3):49 ~ 60.
[10]Marti-Palanca H,Martinez-Barbera J P,Pendon C,et al.Growth hormone as a function of age and dietary protein:energy ratio in a marine teleost,the gilhead sea bream(Sparus aurata)[J].Growth Regul,1996,6:253 ~ 259.
[11]Mathers E M,Houlihan D F,McCarthy I D.Rates of growth and protein synthesis correlated with nucleic acid content in fry of rainbow trout,Oncorhynchus mykiss:effects of age and temperature[J].J Fish Biol,1993,43:245~263.
[12]Perez-Sanchez J.Ration size and protein intake affect circulating growth hormone concentration,hepatic growth hormone binding and plasma insulin like growth factor-I immunoreactivity in a marine teleost,the gilthead sea bream[J].J Nutr,1995,125:546 ~ 552.
[13]Smith C E,Birn M,Halber J E.Biochemical,physiological and pathological changes in pyridoxine deficient rainbow trout (Oncorhynchus mykiss) [J].J Fish Res Bd Can,1974,31(1):1893 ~ 1898.
[14]Tsai O,Madsen S S,McCormick S D,et al.Endocrine control of cartilage in coho salmon:GH influence in vivo on the response to IGF-I in vitro[J].Zool Sci,1995,11: 299 ~ 303.
——白乌鳢

