水禽消化生理的研究进展
华南农业大学动物科学学院 朱勇文
鸭、鹅和鸡同属禽类,在消化和代谢上虽有相同之处,但其消化器官具有不同的解剖组织学结构,决定了它们在胃肠蠕动、食糜的排空速度以及消化酶的分泌和活性等消化生理方面存在差异,从而造成它们对糖类、脂类和蛋白质三大物质可能存在差异。
1 食糜排空
食糜在消化道的排空速度影响食物与酶及肠道微生物作用的时间,从而影响酶消化、微生物发酵及营养吸收。食糜排空时间受采食量、饲料成分、年龄以及品种等因素的影响。
樊红平(2005)发现,采食80 g料组鸭在0~16 h阶段平均排泄量和排泄能大于60 g和40 g组,说明总代谢能值随着采食量的升高而有所下降,此结果和Sibbald等(1975)对鸡的研究结果相反,和周华英(1991)研究鸭的结果一致。饲料中粗纤维(CF)含量和粗蛋白质(CP)含量都可促使滞留率上升。但在消化道中滞留率上升部位是不一样的。CF含量高的饲料,食道腺肌胃滞留率显著上升,高CP含量饲料,小肠滞留率明显增加。Mateos等(1982)认为,日粮添加脂肪后,食糜通过消化道的速度减慢。施用晖等(1993)对鸭研究发现,不同饲料原料的总的食糜流速:牛鞭草>麦麸>菜籽饼>豆粕>玉米,说明适量的粗纤维可以一定程度加速食糜的排空速度。周秀丽和王志跃(2004)研究发现,苜蓿草粉比例增加时,肉用仔鹅食糜流速随之加快。Goff等(2003)认为,饲粮纤维中未发酵的部分通过机械作用影响肠道的蠕动和食糜滞留时间,而可发酵部分则可能是通过其发酵产品来影响肠道蠕动和食糜流通速度。
另外有强饲相同重量而容重较小的饲料会引起嗉囊积食,延长消化道排空时间;雏禽消化道排空期较成年禽快;不同形状的同种饲料排空期也有所差异;环境温度也影响消化道残留内容物干物质量。
2 消化道pH值
水禽和鸡相似,消化道多呈酸性。pH值以肠内最高,肌胃和腺胃内最低。消化道pH值的高低取决于腺胃盐酸分泌量,在小肠里胆汁和胰液能中和消化道中的酸。肠后段由于微生物活动影响,酸性或碱性代谢产物的形成使得pH发生变化,产生的部分挥发性脂肪酸不能被及时的吸收和中和,进而导致酸性环境,水禽消化道的pH值的统计结果见表1。
消化道内酸度主要受神经和激素的调控,但随着日龄的增长,消化道酸度同时也受到日龄和采食环境等各种因素的影响。Winget等(1962)研究表明,家禽消化道的pH值呈波动性变化,肠道pH值随饥饿时间长短而呈曲线反应。Sturkie(1965)研究发现,不同日粮对家禽肠道pH并无明显的影响,而对肌胃pH有影响。孔祥玲等(2009)认为,颗粒日粮相对与粉状日粮能降低鹅肌胃内的pH值,Engberg等(2004)报道的谷物颗粒饲料能降低禽类肌胃内容物pH值。原因可能是谷物日粮在肌胃内停留时间增加,同时肌胃的收缩运动使大量内容物在肌胃内存积,进而增加腺胃分泌盐酸和胃蛋白酶。Florou-Paneri(2001)报道,家禽消化道中pH值一定程度上受日粮pH值的影响。艾晓杰(2003)研究表明在粗酶制剂作用下,雏鹅小肠食糜pH值下降。
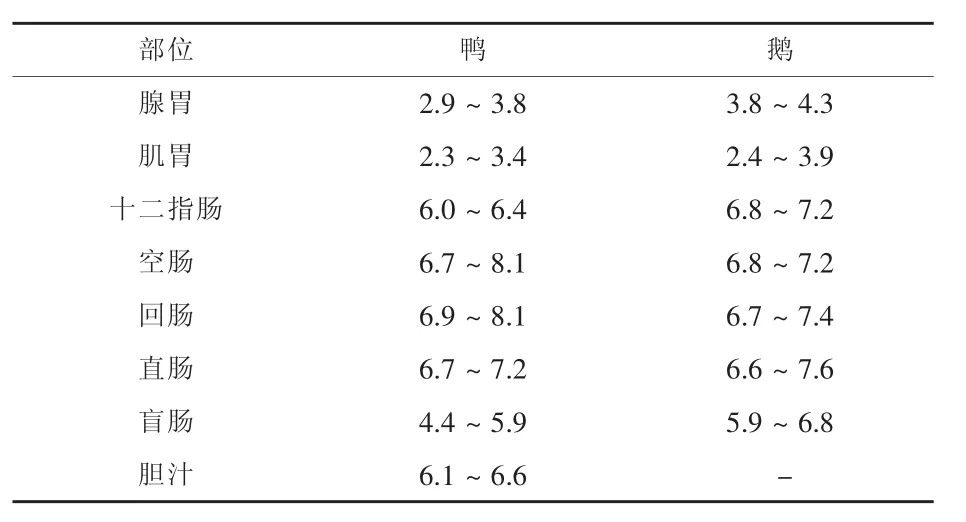
表1 鸭和鹅消化道不同部位的pH值比较
3 消化酶的分泌规律及活性变化
水禽和其他动物相似,小肠内的消化在整个消化过程中占有极其重要的地位。胰液中各种消化酶对小肠的消化发挥重要作用,但和鸡比较又存在一些不同点。鸡消化道中碳水化合物酶类活性高于鸭、鹅;樊红平(2006)指出,鸭胰腺组织中脂肪酶蛋白酶相对活性极显著高于鸡。鸭、鹅的胰腺比鸡发达,其胰蛋白酶的分泌能力比鸡强,活性都高于鸡(陈朝江,2005)。和鸡比较,鸭、鹅并没有表现出很强的规律性,这可能与日粮、品种环境等因素有关。
水禽在不同生长日龄呈现出不同的分泌规律。据黄庆洲(2002)试验,斑点肉小鸭小肠液中蛋白酶和淀粉酶活性随日龄增大而上升,15日龄显著升高;脂肪酶活性在5~15日龄显著降低,14~45日龄维持在较低水平。李昂等(2004)对雏番鸭的研究表明,肠道中脂肪酶、淀粉酶、胰蛋白酶和总蛋白酶的活性分别在10、14、17日龄达到峰值,从消化酶的发育规律显示,10~17日龄是番鸭消化酶发育的关键时期。邵彩梅和韩正康(1990)对四季鹅检测,腺胃中蛋白酶活力在6周龄达到最高,胰淀粉酶随日龄增加而直线上升。十二指肠中的淀粉酶活力在4周龄后稳定在成年水平,糜蛋白酶活力在6周龄时特别高,盲肠食糜各种脱氢酶到8~10周龄时才趋于稳定,而鸡消化道各种酶在3~4周达到了最峰值,从此看出,鹅消化道酶的发育较鸡、鸭慢。
水禽消化道中不同部位消化酶活性及分泌规律不一样,小肠中各种酶的活性决定了其对饲料营养物质的利用程度。俞伟辉等(2010)报道,4~12日龄北京雏鸭小肠内淀粉酶、胰蛋白酶、脂肪酶活性都是空肠和回肠活性高于十二指肠。艾晓杰(2001)研究发现,鹅小肠中的胃蛋白酶活性均表现为十二指肠 >空肠 >回肠,而淀粉酶、胰蛋白酶、纤维素酶、脂肪酶均是空回肠中的活性高于十二指肠,和鸡有相似的规律。
消化道中各种酶的活性受抗营养因子、添加剂、温度、以及疾病应激等外在因素的影响。在抗营养因子方面,Lin(2010)发现,果胶降低了鹅肠道胰蛋白酶的活性,增加食糜的黏度,降低消化道内酶与底物的扩散速度,从而影响消化酶的产生和活性。周巍和倪士澄(1991)发现,大豆中胰蛋白酶抑制因子对绍鸭胰蛋白酶活性有着显著抑制作用且敏感性高于鸡;单宁能明显降低其小肠内容物中胰蛋白酶、淀粉酶和总蛋白水解酶的活性。一般认为,适量的日粮纤维可刺激胃液、胆汁、胰液的分泌,而过高的日粮粗纤维含量则会降低纤维及其他营养物质的吸收利用率。不同日粮纤维来源,对消化酶活性的影响不同,苜蓿粉能提高鹅脂肪酶和蛋白酶的活性。研究表明,填饲应激可使鹅的胰腺的消化酶浓度下降。
4 微生物区系
水禽肠道细菌总数为106~108个/g,与猪、鸡(1011个/g)差别较大,而与兔盲肠内总菌数(107~108个/g)相似。在盲肠内双歧杆菌、乳酸杆菌和梭菌为优势菌群,而在鸡的盲肠中拟杆菌、真杆菌、双歧杆菌、消化球菌和梭状芽孢杆菌是最优势菌群,其次为乳酸杆菌。在正常情况下,正常菌群与机体二者之间形成相互依赖又相互制约的动态平衡微生态系,当这种平衡破坏,即能导致机体发病。
目前对猪和鸡的肠道微生物区的研究报道较多,但对水禽的研究还欠深入。一般来说,鸭、鹅的肠道微生物的主要栖息地为盲肠,故盲肠通常被看作是消化道中一个重要的发酵场所。但由于盲肠内食糜仅占整个消化道内容物的3.5%,且基本位于消化道末端,另外盲肠内容物被周期性的排空,仅有极少停留在盲肠72 h,不可能建立瘤胃中那样稳定的微生物区系和保持呈动态平衡的内环境。王志跃等(2004)研究表明,鹅能够消化利用一定量的粗纤维,主要为半纤维素。王恬等(1985)采用太湖鹅盲肠和直肠内容物进行体外厌氧培养,结果表明其中有纤维素分解菌存在,但数量不多。但邵彩梅和韩正康(1992)、周秀丽(2003)先后证明了鹅盲肠中存在纤维素分解酶,其中存在着较强的发酵。俞伟辉等(2009)研究发现,0~14日龄北京鸭雏鸭大肠杆菌数随着鸭日龄的增长而逐渐减少,乳酸杆菌则逐渐增加,说明肠道功能不断增强。
微生物群落的稳定性受年龄、环境、饲料的营养水平、添加剂以及疾病应激等方面的影响。日粮纤维对鹅肠道微生物群的影响主要是因为许多未消化的淀粉和非淀粉糖在盲肠内发酵,促进了盲肠微生物的生长,提高了微生物分泌的酶量。Hsu和Lu(1996)指出,鹅盲肠能够产生挥发性脂肪酸,降低肠道的pH,有利于肠道益生菌的生长。周俊等(2007)研究表明,低木聚糖、甘露寡糖等寡糖对肉鸭肠道主要菌群有重要影响,显著升高盲肠乳酸菌,抑制大肠杆菌,但对回肠影响不大。胡平等(2010)发现,整粒玉米日粮可以导致空肠细菌种类的下降和回肠细菌种类的增加,对十二指肠和盲肠微生物区系影响不明显。陈晓生等(2006)研究发现,抗菌肽能显著抑制肉鸭肠道大肠杆菌、乳酸杆菌,但总体效果有利于肠道微生物菌群平衡。
5 小结
水禽消化生理有其自身的特点,在食糜排空,消化道pH,消化酶活性以及微生物区系方面和鸡及其他动物相比,有较大的差异,从而在营养物质代谢方面也存在许多不同之处。所以在水禽代谢控制途径上,包括营养方面和非营养方面,都有待于进一步研究。
[1]艾晓杰,郑元林,韩正康.粗酶制剂对雏鹅小肠食糜粘度和pH的影响[J].中国畜牧杂志,2003,2:16 ~ 17.
[2]艾晓杰,韩正康.成年鹅胃肠道食糜理化特性和消化酶活性的分段比较[J].华中农业大学学报,2001,3.
[3]陈晓生,张辉华,周庆国,等.抗菌肽对肉鸭雏鸭期肠道主要微生物菌落的影响[J].兽药与饲料添加剂,2006,4:1 ~ 2.
[4]陈朝江.鸡、鸭、鹅消化生理的比较研究:[硕士学位论文][D].陕西:西北农林科技大学,2005.
[5]樊红平,侯水生,黄苇,等.鸡、鸭消化道pH和消化酶活的比较研究[J].畜牧兽医学报,2006,10:1009 ~ 1015.
[6]黄庆洲,陈平,蒋晓斌,等.斑点肉鸭小肠液中消化酶活性变化探讨[J].畜牧与兽医,2002,10:12 ~ 14.
[7]胡平,施寿荣,王志跃,等.采用变性梯度凝胶电泳技术研究不同形态玉米日粮对鹅肠道微生态区系的影响[J].动物营养学报,2010,22(1):169~175.
[8]孔祥玲,王志跃,杨海明.整粒玉米日粮对鹅生长性能及消化道的影响[J].中国家禽,2009,9:27 ~ 30.
[9]李昂,郑腾,王宏,等.雏番鸭胰腺和肠道消化酶活性变化规律研究[J].中国畜牧杂志,2004,7:16 ~ 19.
[10]邵彩梅,韩正康.四季鹅胃肠道发育及消化酶活力的年龄性变化[J].中国畜牧杂志,1990,1:16 ~ 19.
[11]邵彩梅,韩正康.鹅盲肠对纤维类成分消化的研究[J].南京农业大学学报,1992,4:86 ~ 89.
[12]施用晖,张慎容,乐国伟.鸭饲料代谢能测定方法的研究Ⅰ.鸭TME测定的消化道排空期和排泄物收集期 [J].四川农业大学学报,1993,3:377~387.
[13]王志跃,王健,赵万里,等.去盲肠鹅和未去盲肠鹅对含不同草粉日粮粗纤维组分代谢率的比较研究[J].中国畜牧杂志,2004,12:20~22.
[14]王恬.太湖鹅对红三叶、白三叶草利用的研究:[硕士学位论文][D].江苏南京南京农业大学.1985
[15]俞伟辉,陈振会,郭荣富.北京雏鸭小肠消化酶活性变化规律研究[J].黑龙江畜牧兽医,2010,1:78 ~ 80.
[16]俞伟辉,王永奇,郭荣富,等.北京雏鸭盲肠主要菌群变化规律的研究[J].饲料博览,2009,5:10 ~ 12.
[17]周华英,陈可容,张慎容.鸭真代谢能测定条件的研究[J].四川农业大学学报,1991,3:452 ~ 457.
[18]周秀丽,王志跃.肉用仔鹅对饲料纤维的利用[J].饲料博览,2003,1:25~28
[19]周俊,王蓉,朱汉静.低聚木糖对肉鸭空肠菌群的影响[J].饲料研究,2007,6:59 ~ 61.
[20]周巍,倪士澄.胰蛋白酶抑制物对绍鸭生长、消化酶活性、胰腺组织和氨基酸利用的影响[J].饲料博览,1991,4:2 ~ 5.
[21]周巍,倪士澄.单宁对绍鸭消化酶活性和氨基酸利用的影响[J].饲料博览,1990,2:7 ~ 10.
[22]Engberg R M,Hedemann M S,Steenfeldt S,et al.Influence of whole wheat and xylanase on broiler performance and microbial composition and activity in the digestive tract[J].Poultry Science,2004,83(5):925 ~ 938.
[23]Florou-Paneri P,Christaki E,Botsoglou N A.Performance of broilers and the hydrogen ion concentration in their digestive tract following feeding of diets with different buffering capacities[J].Archiv fuer Gefluegelkunde,2001,65(5):236 ~ 240.
[24]Goff G,Noblet J,Cherbut C.Intrinsic ability of the faecal microbial florato ferment dietary fibre at different growth stages of pigs[J].livestock Production Science,2003,81(5):75 ~ 87.
[25]HsuJ C,Lu T W.Effect of different of dietary ber on growing performance and nutrients digestibility in geese[J].Animal Feed Science Technology,1996,54:233 ~ 236.
[26]Lin P H.Effects of different sources of dietary non-starch polysaccharides on the growth performance,development of digestive tract and activities of pancreatic enzymes in goslings[J].British Poultry Science,2010,51 (2):270 ~277.
[27]Mateos G G,Sell J L,Eastwood J A.Rate of food passage(transittime)as influenced by level of supplemental fat[J].Poultry Science,1982,61:94 ~ 100.
[28]Sibbald I R.The effect of level of feed intake on metabolizable energy values measured with adultroosters[J].Poultry Science,1975,54(6):1990 ~ 1997.
[29]Sturkie P D.Avian Physiology[M].Ithaca,N Y:Cornell University Press,1965.
[30]Winget.禽类生理学[M].北京:科学出版社,1962.209.

