癌胚抗原化学发光免疫定量分析方法的建立
冯艳铭,夏晓燕,潘新娟,宋 琳
癌胚抗原(CEA)为最常用的肿瘤标志物之一,癌胚抗原最初发现于成人结肠癌组织中,1965 年由Gold 首先报道。CEA 是一种结构复杂的可溶性糖蛋白,分子量约为200 000,胚胎期主要存在于胎儿的胃肠管、胰腺和肝脏,出生后组织内含量很低;胃肠道恶性肿瘤时可见血清CEA 升高,在乳腺癌肺癌及其他恶性肿瘤患者的血清中也有升高;因此,CEA 是一种广谱肿瘤标志物,虽然不能作为诊断某种恶性肿瘤的特异性指标,但在恶性肿瘤的鉴别诊断、病情监测、疗效评价等方面,仍有重要临床价值。血清CEA 升高主要见于结肠直肠癌、胰腺癌、胃癌、肝癌、肺癌、乳腺癌等,其他恶性肿瘤也有不同程度的高表达。CEA 连续随访检测,可用于恶性肿瘤手术后的疗效观察及预后判断,也可用于对化疗病人的疗效评价。一般情况下,病情好转时血清CEA 浓度下降,病情恶化时升高。肠道憩室炎、直肠息肉、结肠炎、肝硬化、肝炎和肺部疾病也有不同程度的升高,但阳性的百分率较低。另外,98%的非吸烟健康人血清CEA <5 μg/L,吸烟者中约有3.9%的人CEA>5 μg/L。正常人血清CEA 含量在0 ~5 μg/L 之间,CEA 正常值一般低于5 μg/L。本文根据化学发光免疫分析法的原理建立并研制了癌胚抗原化学发光定量测定试剂盒[1],现将结果报道如下。
1 材料与方法
1.1 主要材料与仪器 抗CEA 单抗腹水购自OEM公司;CEA 多克隆抗体为自制;CEA 纯品抗原购自Fitzgeral 公司;碱性磷酸酶(ALP)由华美生物工程公司提供;化学发光底物CSPD及增强剂SapphireII 购自PE 公司;过碘酸钠(NaIO4)、硼氢化钠(NaBH4)、乙二醇、2,4-二硝基氟苯(DNFB)均购自Sigma 公司;Sephadex G-200 凝胶柱层析购自LKB 公司,DE-52 离子交换柱购自Sigma 公司,聚苯乙烯塑料白色不透明微孔板购自深圳金灿华;Luminescent 化学发光仪(芬兰雷勃);洗板机(Bio-Rad);CEA 国家标准品购自中国药品生物制品检定所。
1.2 标本来源 标本均为血清,清亮无溶血,-20℃冻存。分别为健康体检门诊的成年男性200份,成年女性(非妊娠女性)200 份,青少年200 份,老年人标本200 份,其中男女比例为1∶1;临床标本100 份为陕西省人民医院放免科采集的肿瘤或疑似患者血清。
1.3 方法
1.3.1 CEA 单克隆抗体的纯化 抗CEA 单抗腹水用500 g/L 的饱和硫酸铵沉淀,再溶解透析后DE-52 换柱纯化,分部收集,测定蛋白浓度。蛋白浓度应在4 ~10 g/L 之间,无菌过滤,加1g/L NaN3后分装,-20℃存放。
1.3.2 CEA 多抗血清制备与纯化 纯品CEA 免疫健康雄性山羊,首次剂量0.5 mg/只。4 周后加强免疫,剂量减半,共加强免疫3 次。耳静脉采血测定效价,双扩散效价>1∶128 的羊,进行心脏采血,分离血清,羊抗CEA 血清按照1.3.1 方法进行纯化。
1.3.3 碱性磷酸酶标记抗体的制备 采用改良过碘酸钠-乙二醇法[2,3]进行标记,将获得的IgG-ALP用含100 g/L 小牛血清的0.05 mol/L (pH7.6)TBS缓冲液按1∶1000 稀释成工作液,保存于-20℃。
1.3.4 CEA 校准品制备 用系列国家标准品标定CEA 纯品抗原后,用CEA 校准品稀释液稀释成含量分别为0、2.5、10、40、160、640 ng/mL 系列浓度,用国家标准品做定量曲线进行校准品浓度测定、相关性分析,建立定量标准品。
1.3.5 化学发光系统的优化 由不同浓度的SapphireII 增强剂和CSPD 组成底物工作液,进行化学发光值(RLU)测定,进行底物工作液的优化。
1.3.6 固相化抗体微孔板的制备 将抗CEA 单抗用0.05 mol/L 碳酸盐缓冲液(pH9.6)稀释成2.0、5.0、8. 0、10. 0、13. 0、15. 0 μg/mL 的包被浓度,按100 μL/孔的量加入包被板中,37℃包被2 h,再用含1%酪蛋白的0.01 mol/L PBS(pH7.4)37℃封闭2 h后晾干备用[4],确定包被选择最佳包被抗体工作浓度。
1.3.7 正常人参考血清的确定 用优化好的CEA化学发光定量试剂对800 份健康人标本进行浓度测定,进行统计学分析,计算+1.64s,确定血清医学参考值范围。
1.3.8 化学发光免疫检测 样品或标准品于相应孔分别加25 μL 后,每孔再各加抗CEA-ALP 75 μL,在振荡器上混匀1 min,置37℃恒温反应60 min。洗掉游离成分,加入底物工作液50 μL,ALP 催化底物脱磷酸酯,并发出463 nm 的可见光,第10 分钟后测定各加样品孔的发光值RLU,并将数据用化学发光检测仪定量软件Luminoskan ascent version 2.4.1 进行定量分析。
2 结果
2.1 底物工作液的优化 CSPD 浓度为0.8、0.6、0.4、0.2、0.1 mmol/L,SapphireII 浓度为2.0、1.5、1.0、0.5、0.25 g/L,用碱性磷酸酶1∶1 000 在10 min 进行化学发光测定,记录不同增强剂和CSPD 浓度的发光值,分别做出CSPD 浓度-RLU 的曲线和SapphireIIRLU 的曲线(图1、2)。分析上述数据可得出以下结论:CSPD 在0.4 mmol/L 以下时,RLU 随CSPD 浓度的变化而成比例变化,在0.4 mmol/L 时达到平台,可能是底物浓度在0.4 mmol/L 时使酶达到饱和。增强剂SapphireII 浓度对RLU 的变化,在1.5 g/L 时达到最大RLU,随着增强剂浓度的增加RLU 达到平台期,确定底物工作液配制的浓度为:0.4 mmol/L 的CSPD,增强剂SapphireII 浓度为1.5 g/L。
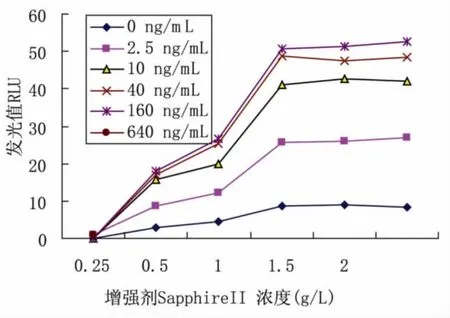
图1 不同浓度的增强剂SapphireII 的RLU 的曲线

图2 不同浓度的底物CSPD 的RLU 的曲线
2.2 包被抗体浓度和酶标记抗体浓度的确定 根据不同包被抗体浓度测定定量标准品的发光值,分别做出不同浓度包被抗体-RLU 的曲线(图3)。包被浓度低时试剂的整体发光值也低,随着包被浓度的升高发光值也相应升高,在10 μg/mL 时,发光值达到一个平台期(此时灵敏度达到一个平台期),选择标准曲线接近于直线时的包被浓度(10 μg/mL)为最佳。

图3 不同包被浓度对定量标准品RLU 的变化曲线
2.3 最低检出量 平行测定20 孔零值校准品血清,计算零值校准品RLU 平均值(x)及标准差(s),以+2s 为测定值代入标准曲线方程中,求出其对应的浓度值,所对应的浓度值即为最低检出量为0.5 ng/mL。
2.4 特异性检测 分别测定与AFP(3 μg/mL)、铁蛋白(10 μg/mL)、人血清蛋白(200 g/L)、人丙种球蛋白(200 g/L)的交叉反应率,分别为≤0.015%、≤0.034%、≤4.5 ×10-8、≤5.0 ×10-8。
2.5 精密度 测定CEA 浓度为48.8 ~73.2 ng/mL的质控血清,重复检测3 次,每次重复20 孔,进行精密度测定,计算批内、批间平均变异系数分别为8.6%、7.5%。
2.6 正常人血清CEA 医学参考值的确定 对800份健康人血清检测进行统计,其中有96.1%的健康人血清小于5.0 μg/L,参考值范围为单侧只有上限而无下限,按照95% 单侧上限参考值范围为+1.64s,同时参考放免检测结果和目前公认的正常值范围,本检测方法的正常人血清应小于5.0 μg/L。
2.7 准确度 取3 份临床样本分别加入5 ng/mL、20 ng/mL、50 ng/mL 浓度的血清样品测试样品的加入回收率,对3 份临床样本分别进行90%、60%、30%稀释计算稀释回收率,结果显示:加入平均回收率为97.4%,平均稀释回收率为101.8%。
2.8 与进口试剂的比较 与Bayer ACS:180全自动化学发光系统的CEA 试剂共同对100 份临床标本进行检测,二者所得的数值进行分析,其相关性有统计学意义(见图4),LumiassayTM=0.95 ×ACS:180+0.7789(n=100),(r=0.968,P <0.001)。

图4 化学发光免疫测定试剂
3 讨论
化学发光免疫分析方法作为一种高选择、高灵敏度检测方法被广泛应用在临床检测和药物分析[5]。根据发光体系应用于免疫分析中的方式不同[6],可分为:直接标记发光物质的免疫技术、酶催化化学发光免疫分析、电化学发光免疫分析3 种。本研究采用酶催化法,以酶标记抗体或抗原等生物活性物质,酶的底物是发光剂,免疫反应复合物的酶作用于底物,产生光信号,测定发光信号的强度。癌胚抗原(CEA)为最常用的肿瘤标志物之一,其定量检测的方法主要有放射免疫法、酶联免疫法、时间分辨荧光免疫法和化学发光免疫法,各具特点。
本研究建立的癌胚抗原(CEA)化学发光免疫定量分析方法,采用自行设计CEA 多抗血清制备和纯化工艺,采用改良过碘酸钠-乙二醇法对CEA 多抗进行ALP 标记,较传统的戊二醛交联法标记效率要高,灵敏度、特异性都较好;采用金刚烷衍生物及其增强剂作为发光底物系统[7],其酶解速度快,达到最大光信号时间短,且发光信号强、持续时间长,信噪比高,通过优化增强剂的浓度能使发光强度增强102~105倍;可测定浓度线性范围宽,样品无需稀释即可检测。由于化学发光具有荧光的特异性,同时不需要激发光,从而避免了荧光分析中激发光杂散光的影响,有很高的灵敏度,该方法最低检出量为0.5 ng/mL。与Zhuang[7]等合成一种新型双吖啶化合物DMDSBA 用于标记抗-CEA 抗体建立了一种新的夹心化学发光免疫方法,测定人血清中CEA 的线性范围为1.0 ~100 ng/mL、检测限为0.53 ng/mL 是一致的。该方法克服了传统的放射免疫法带来的环境污染和健康危害,操作简单,检测自动化程度高,其敏感性、特异性、线性范围、精密度、回收率均能满足常规临床检测要求,并采用开放式反应系统,因此可与大多数的化学发光检测仪器配套使用,适宜在临床推广应用。
[1]贺艳峰,张家明,郭小英,等. 化学发光法检测肿瘤标志物[J].化学通报,2005,68:135-146.
[2]冯艳铭,马俊芬,吴飚,等.甲胎蛋白化学发光免疫定量分析方法的建立[J]. 第四军医大学学报,2007,28(14):1291-1293.
[3]Lin J,Yan F,Hu X,et al.Chemiluminescent immunosensor for CA19-9 based on antigen immobilization on a cross-linked chitosan membrane[J].Immunol Method,2004,291(1-2):165-174.
[4]Chen D,Kaplan LA.Performance of a new-generation chemiluminescent assay for hepatitis B surface antigen[J].Clin Chem,2006,52:1592-1598.
[5]尹东光,贺佑丰,刘一兵,等.几种主要化学发光物质的发光性能及其化学发光免疫分析体系[J]. 标记免疫分析与临床,2002,9(4):225-229.
[6]Jie hua LIN,Wei QU,Shusheng ZHANG. Electrochemical immunosensor for carcinoembryonic antigen based on antigen immobilization in gold nanoparticles modified chitosan membrane[J].Anal Sci,2007,23(9):1059-1063.
[7]Hui-sheng Zhuang,Jin-ling Huang,Guonan Chen. Synthesis of a new biacridine and its using as the chemiluminescent probe for immunoassay of carcinoembryonic antigen[J]. Anal Chim Acta,2004,512(2):347-353.

