酶解大豆粉蛋白条件优化研究
窦 屾, 任文雅, 杨春霞, 于广鑫, 徐 瑾, 廖永红
大豆的营养价值很高,它含有40%左右的蛋白质、多种维生素和矿物质,大豆蛋白经水解生成很多具有生理活性的多肽,并且这些多肽被应用到各种功能性食品和保健品中,广受人们的亲睐[1-3].制备大豆多肽的方法多为酶解法.文献表明,单酶酶解大豆蛋白的水解度较低且反应的时间长,双酶复合酶解不仅可以提高水解度、缩短反应时间而且能够产生很多容易被人体消化和吸收的低分子肽[1,4-5].目前,多用碱性蛋白酶Alcalase和木瓜蛋白酶对大豆蛋白进行酶解,这是由于它们的最适pH值和温度都比较接近而且来源广泛、价格较低、适合工业化生产.大部分酶解大豆的相关研究都是以成本较高的大豆分离蛋白(SPI)或大豆浓缩蛋白为底物(蛋白含量在70%以上),很少有以廉价全脂大豆粉作为直接反应底物的.然而,考虑到这两类底物中蛋白组成大体相同,并且全脂大豆粉比大豆分离蛋白成本低廉.因此,本研究采用碱性蛋白酶Alcalase和木瓜蛋白酶双酶法水解全脂大豆粉,力求获得具有较高水解度的酶解全脂大豆粉的方法.
1 材料与仪器
1.1 材料和试剂
全脂大豆粉,市场购得;碱性蛋白酶Alcalase(经实验测定酶活力为108 000 U/mL)、木瓜蛋白酶(经实验测定酶活力为85 600 U/mL),均购自Novozymes公司;其余试剂均为分析纯.
1.2 主要仪器
DSHZ-300型多用途水浴恒温振荡器,江苏太仓市实验设备厂;PHS-3C型pH计,成都世纪方舟科技仪器有限公司;电子分析天平;凯式定氮仪.
2 实验方法
2.1 总氮含量的测定
取1 g全脂大豆粉应用凯氏定氮法[6]测定其中氮含量.将全脂大豆粉充分研磨后置于称量瓶中,放105℃烘箱内烘烤1 h,每隔30 min称重直到重量不变为止.放入消化管中进行充分的消化、蒸馏后用盐酸标准溶液滴定.样品中蛋白质含量按式(1)计算.

式(1)中,X为全脂大豆粉中蛋白的质量分数,g/100 g;V1为试样消耗盐酸标准溶液体积,mL;V2为试剂空白消耗盐酸标准溶液体积,mL;c为盐酸标准溶液浓度,mol/L;m为试样质量,g,本实验取1 g;F为氮转换为蛋白质系数,本实验中取5.71.
2.2 水解度的测定
应用pH stat法[7],通过加碱来调整反应过程中的pH值,使得蛋白酶始终在固定pH值下水解蛋白质,最后通过计算加碱量来计算水解度.水解度(DH)按式(2)计算.

式(2)中,B为酶解过程中所消耗的碱量,mL;Nb为碱液的浓度,mol/L;α为氨基的解离度;Mp酶解液中蛋白质的质量,g;htot为单位质量原料蛋白质肽键当量数,本实验中取7.21
α氨基的解离度可以由式(3)计算.

式(3)中,pH值为酶解时溶液的pH值;pK为NH3+的解离常数,本实验取7.0.
2.3 全脂大豆粉酶解条件的确定
根据大豆蛋白水解的相关文献[4-5]以及反应用酶的最适条件,选取底物浓度、pH值、温度和酶浓度进行单因素实验,并依据文献选取相应的实验水平.
2.3.1底物浓度对水解的影响实验
配制5份底物体积分数分别为1%,2%,3%,4%,5%的溶液,在pH值、温度和加酶量相同的条件下反应240 min.反应过程中持续加入NaOH溶液使得溶液的pH值保持恒定,按照2.2中方法测定DH值.
2.3.2pH值对水解的影响实验
配制5份底物浓度和加酶量相同的溶液,分别调节pH值到7.0,7.5,8.0,8.5,9.0,在相同温度下酶解240 min.按照2.2中方法测定溶液DH值.
2.3.3温度对水解的影响实验
将底物浓度、加酶量和pH值都相同的溶液在45,50,55,60,65℃下酶解240 min,按照2.2中方法测定DH值.
2.3.4酶浓度对水解的影响实验
1)总加酶量的确定.向底物浓度和pH值相同的5份溶液加入复合酶(两种酶活力比为1∶1)1 125,1 625,2 175,2 700,3 265 U/g,在相同温度下反应240 min.按照2.2中方法测定DH值.
2)复合酶比例的确定.按照复合酶酶活力比(碱性蛋白酶Alcalase与木瓜蛋白酶之比为1∶1,1∶2,2∶1,2∶3,3∶2)加入 2 700 U/g 的酶到底物浓度和pH值都相同的溶液中,在相同温度下反应240 min.按照2.2中方法测定DH值.
2.3.5酶解工艺的优化
利用2.3.1至2.3.4得到的各个因素的最适范围,对反应温度(A)、pH值(B)、底物体积分数(C)和总加酶量(D)四个因素进行L9(34)正交试验,通过测定DH确定最佳的水解条件,因素水平表见表1.
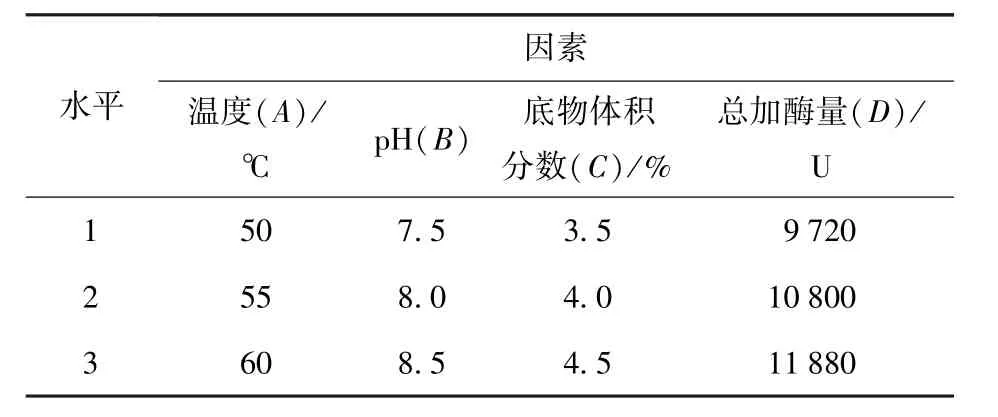
表1 L9(34)正交试验因素水平表Tab.1 Factors and levels of L9(34)orthogonal experiment
2.4 酶解促进剂添加条件的确定
根据文献[1,7]选取对碱性蛋白酶Alcalase和木瓜蛋白酶活性都有明显促进作用的促进剂Mn2+、Ca2+和半胱氨酸(Cys),应用单因素实验确定出最佳酶解促进剂及最适浓度.
2.4.1促进剂的筛选
配制4份底物溶液,一份为空白,其余3份溶液分别加入 MnCl2、CaCl2和 Cys使得 Mn2+、Ca2+和 Cys浓度达到4 mmol/L,在正交试验得到的最优酶解条件下反应240 min,按照2.2中方法测定DH值.
2.4.2最佳促进剂的浓度筛选
将MnCl2加入到5份底物溶液中,使得Mn2+的浓度分别为2,3,4,5,6 mmol/L,在正交试验得到的最优酶解条件下反应240 min,按照2.2中方法测定DH值.
2.5 酶解时间的确定
按照正交试验得到的最优条件和最佳促进剂的条件对底物溶液进行酶解,反应时间240 min.每隔30 min加入NaOH维持溶液pH值恒定,按照2.2中方法测定DH值.
3 结果与讨论
3.1 全脂大豆粉中蛋白质含量测定结果
按2.1中方法对市售全脂大豆粉中的蛋白质含量进行测定,测得其蛋白质含量为32.13%,与文献[1]中报道的大豆中蛋白质含量一致.
3.2 单因素对水解的影响
3.2.1底物浓度对水解的影响
5份底物溶液在pH值为8.0,55℃下加入碱性蛋白酶Alcalase和木瓜蛋白酶酶活力比为1∶1的复合酶12 000 U,按照2.3.1方法进行反应,实验结果见图1.
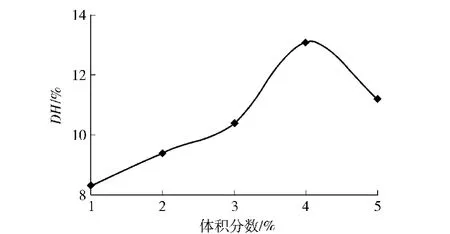
图1 底物体积分数对DH的影响Fig.1 Effect of substrate concentration on DH
由图1可知,底物体积分数为1%时DH值仅为8.3%,随着底物体积分数的升高,DH值亦随之增加;底物体积分数为4%时,DH值达到最高为13.1%,比底物体积分数1%高出4.8%.然而随着底物浓度继续增大,DH值反而减小.这种变化规律是由于底物较少的时候酶与底物结合生成酶反应复合物较少,不利于反应的进行;随着底物浓度的增加,酶可以充分和底物相接触从而提高了反应速率.但是底物浓度过高会使得底物的溶解性变差,出现互相聚合的现象阻止了酶与底物相接触降低了反应的速率.因此确定最佳底物浓度为4%.
3.2.2pH值对水解的影响
向配好的5份4%底物溶液中分别加入酶活力比为1∶1的双酶2 700 U/g,在55℃下按照2.3.2中方法进行实验,实验结果见图2.

图2 pH值对DH的影响Fig.2 Effect of pH on DH
由图2可以看出,pH值为7.0时DH值为12.8%,随着pH值的上升,DH值一直升高,在pH值为8.0时,DH值达到最高为13.9%,而随着pH值的继续升高DH值反而下降,在pH值为9.0时,DH值比pH值为7.0的低了3.7%.这是因为酶作为一种具有催化作用的生物活性物质与环境中的pH值密切相关,pH值会影响酶分子的空间构象和酶分子与底物结合的状态,从而影响酶促反应的速率.因此确定反应的最佳pH值为8.0.
3.2.3温度对水解的影响
向底物体积分数为4%的溶液中加入酶活力比为1∶1的双酶2 700 U/g,溶液的初始pH值为8.0,按照2.3.3中方法进行实验,实验结果见图3.
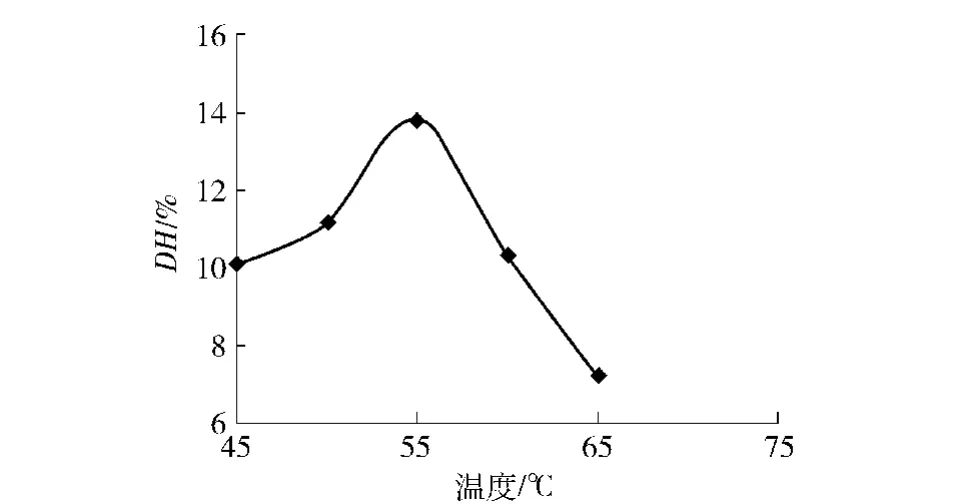
图3 温度对DH的影响Fig.3 Effect of temperature on DH
从图3可以看出,DH值在一开始随着温度的上升而逐渐上升,在55℃时DH值达到最高为13.8%,比45℃时的DH值高出3.7%.而在55℃之后DH值却随着温度的上升而逐渐下降,65℃时DH值仅为7.2%.这是由于温度对酶解反应的影响是非常大的,随着温度的上升酶促反应的速率会跟着上升,但是在到达最适温度之后继续升温会使得酶活损失加大,从而抑制酶与底物结合的能力,降低反应速率.因此确定反应的最适温度为55℃.
3.2.4酶浓度对水解的影响
1)总加酶量对水解的影响.将底物体积分数为4%、pH值为8.0的溶液在55℃下,按照2.3.4中1)进行反应,结果如图4.

图4 加酶量对DH的影响Fig.4 Effect of enzyme dosage on DH
从图4中可以看出,随着加酶量的增大,酶分子可以和更多的底物结合,酶促反应的速率也在增大.不过当DH值达到12.6%,即加酶量为2 700 U/g时反应速率趋于平缓,DH值变化不大,3 265 U/g时的DH值仅比2 700 U/g时高出0.2%.所以,本次实验中最适总的加酶量为2 700 U/g.
2)碱性蛋白酶Alcalase与木瓜蛋白酶复合比例对水解的影响.将底物体积分数为4%、pH值为8.0的溶液在55℃下,按照2.3.4中2)进行反应,结果见图5.

图5 复合酶酶活力比对DH的影响Fig.5 Effect of compound enzyme ratio on DH
从图5中可以看出,复合酶活力比在碱性蛋白酶Alcalase与木瓜蛋白酶之比为2∶1时DH值最高,为14.4%,因此选取此比例作为最佳水解比例.在后续的正交试验中用此复合酶比例进行实验.
3.3 复合酶水解全脂大豆粉的正交试验
按照2.3.5方法对全脂大豆粉酶解条件进行L9(34)正交试验优化,以DH为指标,利用极差分析确定各个因素水平的最佳组合.正交试验结果见表2.
通过极差分析可知,表2中各个因素对实验的影响为A>B>C>D,即温度对DH的影响最大,酶的总浓度对于实验影响的最小.极差分析得到的最优组合与直观最优组合不一致,前者是A3B3C3D3,后者为A3B2C1D3.将极差分析得到的最优组合和直观最优组合做进一步的实验比较,表明极差分析最优组合比直观最优组合酶解结果要好.即在温度60℃、pH值 8.5、底物体积分数 4.5%、总加酶量11 880 U的条件下全脂大豆粉DH值最高为16.3%.

表2 L9(34)正交试验结果分析Tab.2 Analysis of results of orthogonal experiment
3.4 酶解促进剂对水解的影响
3.4.13种促进剂的筛选
底物溶液在温度60℃、pH值8.5、底物体积分数4.5%、总加酶量11 880 U时,按照2.4.1进行实验,确定最佳酶解促进剂.实验结果见图6.
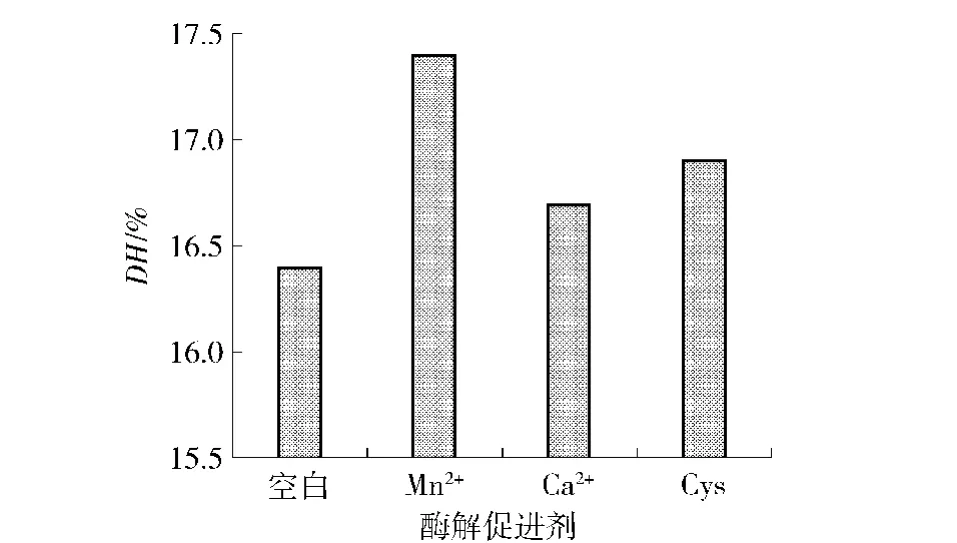
图6 3种促进剂对DH值的影响Fig.6 Effect of three accelerants on DH
从图6中可以看出,Mn2+、Ca2+和 Cys对复合酶酶解全脂大豆粉都有促进作用,其中Mn2+的促进效果最明显,DH值能达到17.4%.这可能是由于Mn2+能够更好的激活酶分子中的催化基团使得酶对底物的亲和力更强.
3.4.2Mn2+最佳浓度的筛选
溶液在温度60℃、pH值8.5、底物体积分数4.5%、总加酶量11 880 U时,按照2.4.2进行实验,确定Mn2+的浓度.实验结果见图7.

图7 Mn2+浓度对DH值的影响Fig.7 Effect of the concentration of Mn2+on DH
从图7中可以看出,Mn2+浓度在5 mmol/L的时候DH值达到最高,然后曲线趋于平稳.综合考虑选择5 mmol/L Mn2+为酶解全脂大豆粉促进剂的最佳浓度.
3.5 酶解时间对水解的影响
将含有5 mmol/L Mn2+的溶液在温度60℃、pH值8.5、底物体积分数4.5%、总加酶量11 880 U的条件下,按照2.5进行实验,确定最佳酶解促进剂.实验结果见图8.

图8 酶解时间对DH值的影响Fig.8 Effect of enzymatic time on DH
从图8中可以看出,随着反应时间的延长DH值呈上升趋势,在180 min时DH值达到17.8%,比最初的30 min高出7.5%,而当反应时间超过180 min时DH值变化并不明显,因此选择180 min为酶解的最佳时间.
4 结 论
本实验应用廉价全脂大豆粉做原料,利用碱性蛋白酶Alcalase和木瓜蛋白酶复合进行酶解,得到了具有较高水解度的酶解工艺,使得全脂大豆粉能够更好的应用到多肽的工业化生产中.本实验的酶解全脂大豆粉最佳条件是底物体积分数4.5%、pH值8.5、温度60℃、复合酶加酶量(碱性蛋白酶Alcalase∶木瓜蛋白酶活力之比为2∶1)2 640 U/g、添加5 mmol/L Mn2+酶解180 min.与杜翠荣等[8]报道的碱性蛋白酶Alcalase和木瓜蛋白酶的酶解结果相比,本实验酶解时间比文献中要短3h,DH值要高5%.然而与酶解大豆分离蛋白的文献相比本实验的DH值较低,这可能因为全脂大豆粉中还有其他物质如油脂、金属元素、维生素等,这些物质可能会对蛋白质形成包裹进而阻止酶与底物充分接触,抑制DH值的升高.如果用本实验的酶解工艺酶解纯度较高的大豆蛋白可能会得到很高的DH值,但这还需要进一步实验验证.

