采用荧光探针测定五氯酚
姚英华,李娟秀,陈贝贝,蔡青云*
(1.湖南益阳龙州中学,湖南益阳431000)
(2.湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
0 引言
五氯酚(pentachlorophenol,PCP,C6Cl5OH)是一易电离、难溶于水的氯代芳香族有机污染物,曾被广泛用作杀菌剂、除草剂、杀虫剂和木材防腐剂。通常条件下,五氯酚难氧化,难水解,难挥发。这也是我国红壤资源退化的重要原因之一。另外,五氯酚有蓄积作用,在高有机质含量的酸性土壤或沉积物上具有很高的吸附性,强烈地吸附在土壤中,可被植物吸收通过生物富集而进入食物链,产生生物毒性。美国环境保护署(USEPA)把五氯酚划分为B2(一种潜在的致癌物质),在毒理学中属中等毒性。五氯酚对水生生物的半致死量(LD 50)一般为 0.32~0.77 mg/L,对小鼠和大鼠的经口半致死量(LD 50)分别为36~177 mg/kg和 25~175 mg/kg。
因此,发展能快速、灵敏地检测五氯酚的方法就尤为迫切。目前,五氯酚的检测主要是基于液相-质谱或气相-质谱的联用技术[1~3]。这些方法稳定灵敏,但是耗时,并且需要复杂的前处理技术进行有效的富集分离以适应环境中痕量样品的检测。基于五氯酚的电化学氧化而建立的电化学分析方法,由于其高氧化电位 (700~900 mV),使得其测定受到环境样品中电活性杂质的干扰[4~5]。基于酶的传感分析可用于五氯酚的现场快速检测,但是酶传感器的检测限不能令人满意[6]。免疫分析法可以用于大量样品的筛查,对杀虫剂的检测限可达到1 μg/L水平。荧光分析具有很高的灵敏度。但对于惰性的五氯酚,必须进行荧光标记才能测定。
荧光素在蓝光或紫外线照射下,发出绿色荧光。溶液的pH值不仅影响荧光素的吸收光谱,同时更显著地影响其激发光谱和发射光谱[7],在不同的酸度下,荧光素具有不同的最大吸收波长、不同的最大激发波长和荧光发射波长。
该文基于荧光素的荧光光谱对pH的敏感性,提出了一种间接荧光法检测五氯酚的方法。无需对五氯酚进行荧光标记,简化了检测过程。
1 实验部分
1.1 试剂与仪器
试剂:荧光素和五氯酚,购于J&K化学试剂有限公司(北京,中国);苯酚、一氯酚和二氯酚,购于美国Aldrich-Sigma公司;磷酸二氢钾,磷酸氢二钠,氢氧化钠和盐酸购于杰辉生物科技有限公司(长沙,中国)。实验中先配置浓度为0.001 mol/L五氯酚和0.001 mol/L的荧光素的DMF溶液,于4℃环境中储存备用,在实验过程中用超纯水稀释至所需浓度。整个实验过程中所用水由Millipore公司Synergy UV纯水系统制备,电阻率值为18.2 MΩ·cm。实验中所有试剂均为分析纯。
仪器:Delta 320型pH计 (梅特勒-托利多仪器,上海有限公司);超声仪(上海科导超声仪器有限公司);汞灯(500 W)用来提供紫外光,采用红外滤光片滤去红外光,以免温度上升。光照计(Ophir,Israel)用于测量照射在反应容器上的紫外光的光强;荧光分光光度计(PerkinElmer,LS45)。
1.2 荧光检测五氯酚
在体积为4mL的透明石英小容器中,加入1mL一定浓度的五氯酚的水溶液 (由五氯酚的DMF溶液加入到水中稀释而成),盖上盖子,防止受光照射而造成溶液挥发损失。光照前,充氮气15 min以除去溶液中的溶解氧,防止氧与五氯酚发生副反应,干扰检测。同时开启汞灯预热0.5 h,以得到稳定的光照。将反应容器与汞灯放置在同一水平线上,通过调整汞灯和盛有样品的容器的距离,获得不同强度的光照,光照强度由光照计测量。在汞灯和样品间,紧靠汞灯处放置一块红外光滤光片。在光强为50 mW/cm2UV的汞灯下照射2.5 h后,向反应液中加入一定浓度的荧光素 (由荧光素的DMF加入到水中稀释而成),搅拌均匀。在400 nm激发下,测定460 nm到580 nm间的荧光光谱。狭缝宽度10 nm。以510 nm处的发射峰作为定量的标准峰。所有的试验均在室温下进行。
2 结果与讨论
2.1 测定条件优化
在紫外光光照下,五氯酚会被转化为一些低毒性物质,如CO2,H+,Cl-等物质[8],致使溶液的pH值降低。而荧光素是一种对溶液的pH值变化敏感的荧光试剂。当溶液pH值改变时,荧光素的荧光强度以及发射光谱都会发生改变。所以通过监测荧光素的荧光强度的变化,可以间接测定五氯酚。图1为荧光素的荧光强度随溶液pH值的变化。在pH<6的酸性溶液里,荧光素的荧光强度对pH变化十分敏感。荧光素的荧光强度在中性和弱碱性时达到最大值,对pH的敏感性较低。
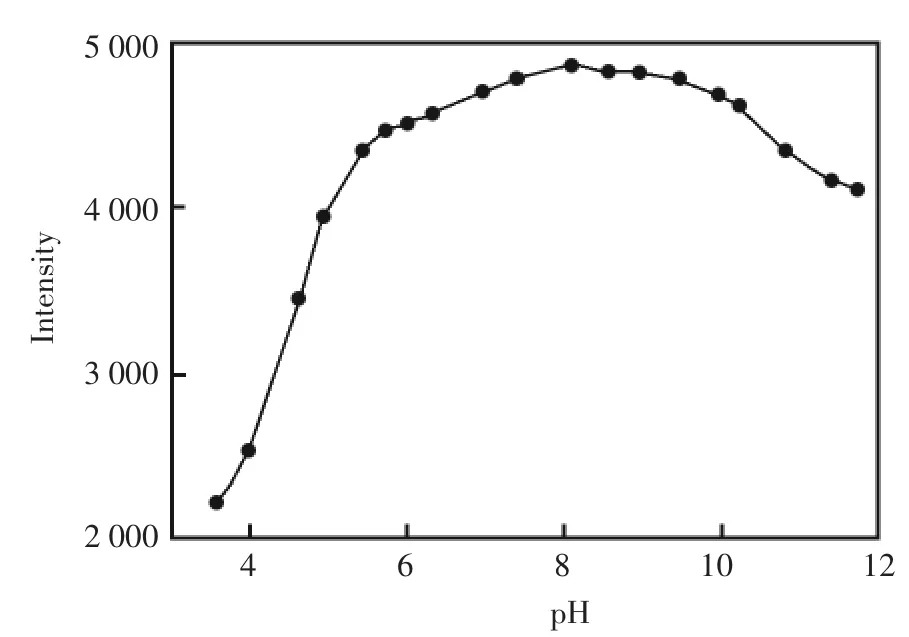
图1 pH对荧光素荧光强度的影响Fig.1 The effect of pH on the fluorescence intensity of fluorescein
可见测试溶液为酸性时,可获得高灵敏度。而溶液的最终pH是在初始pH的基础上取决于五氯酚的降解,即决定于溶液的初始pH和五氯酚的浓度。保持五氯酚的浓度为5.0×10-6mol/L,在溶液初始pH值为2~12的范围里,在50 mW/cm2的汞灯 下照射 2.5 h后, 测定了加入 1.0×10-5mol/L的荧光素后荧光强度随pH的变化(图2)。可见荧光强度的相对变化即ΔI/I0(ΔI=I0-I,I0和I分别是溶液为光照前和光照后溶液的荧光强度)受溶液初始pH值影响很大,在pH4.75时,得到最大响应。初始pH值不仅决定最终反应液的pH,从而影响荧光素的荧光强度,而且影响五氯酚的光解效率。五氯酚是一种弱酸[9],pKa为4.7,在碱性溶液中溶解度比酸性溶液中大,光解效率也相对要大些。两厢作用的结果,在pH4.75时响应灵敏度最大。
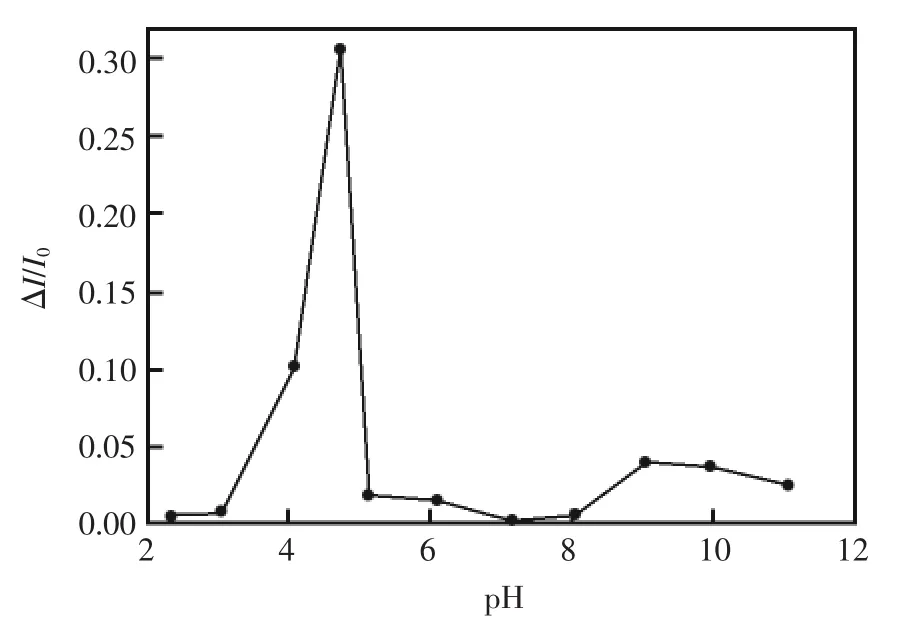
图2 溶液的初始pH对荧光素检测响应的影响Fig.2 The influence of initial pH of the solution on the fluorescence intensity.The fluorescence spectra was collected after exposing a 5.0×10-6mol/L PCP solution with different pH to 50 mW/cm2UV for 2.5 h,then adding 1.0×10-5mol/L fluorescein
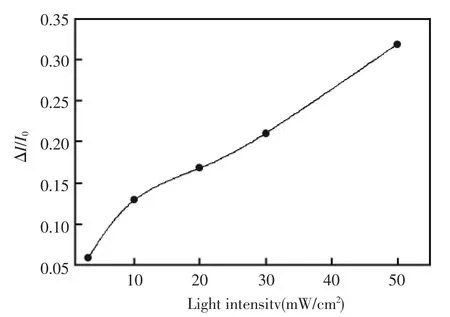
图3 光照强度对响应的影响Fig.3 The influence of light intensity on the fluorescence intensity.The fluorescence spectra was collected after exposing a pH4.75 solution containing 5.0 ×10-6mol/L PCP to UV with different intensity for 2.5 h,then adding 1.0×10-5 mol/L fluorescein
在固定溶液的初始pH后,溶液的最终pH取决于五氯酚的降解,即受光照时间和光强的影响。图3显示了荧光强度的相对变化(ΔI/I0)随光强的增加而增大。当光强从0增加到50 mW/cm2时,ΔI/I0从5%增加到32%。由于500 W的汞灯能提供的最大光强为50 mW/cm2,在实验中选择了500 W汞灯的最大光强50 mW/cm2。图4显示了荧光强度的相对变化(ΔI/I0)随光照时间的变化。 在光照时间为 0.5 到 2.5 h 的范围内,ΔI/I随光照时间的增加而显著增加,而在光照时间为2.5 到 3.0 h 的范围内,随着时间的增加,ΔI/I0增加放缓了。为节省测定时间,选择了2.5 h的光照时间。
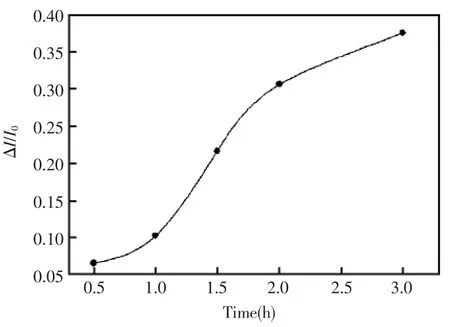
图4 光照时间对响应的影响Fig.4 The influence of illumination time on the fluorescence intensity.The fluorescence spectra was collected after exposing a pH4.75 solution containing 5.0×10-6mol/L PCP to 50 mW/cm2UV for different time,then adding 1.0×10-5mol/L fluorescein
荧光素浓度也是影响荧光强度的一个因素。图5显示了荧光素的浓度对荧光强度的影响。当荧光素的浓度从 1.0×10-7增加到 1.0×10-5mol/L,荧光强度的相对变化即ΔI/I0相应地从5.26%增加到16.09%。这说明荧光素的浓度越大,同等条件下其响应就越大。由于受荧光素在水中溶解性的限制,选择了荧光素在水中的最大溶解度1.0×10-5mol/L。
2.2 五氯酚测定
在以上所优化的条件下,测定了荧光强度随五氯酚浓度的变化。如图6所示,随着五氯酚浓度的增加,荧光素的荧光强度减小。荧光强度的相对变化ΔI/I0与五氯酚浓度的对数在5.0×10-4~5.0×10-9mol/L范围成线性关系,相关系数为0.99。 按三倍噪音计算所得的检测限为 2.0×10-9mol/L。所得到的检测限低于或与已见报道的数值相当。比如:Codognoto等[5]采用钻石电极电化学检测五氯酚,检测限为 5.5 μg/L(3.0×10-8mol/L);Wu等[10]采用基于纳米TiO2/十六烷基磷酸盐的电化学传感器检测五氯酚,检测限为1.0×10-8mol/L;Patricia Noguera等[11]采用酶联免疫法检测五氯酚,检测限为0.1 ng/mL(5.6×10-11mol/L)。
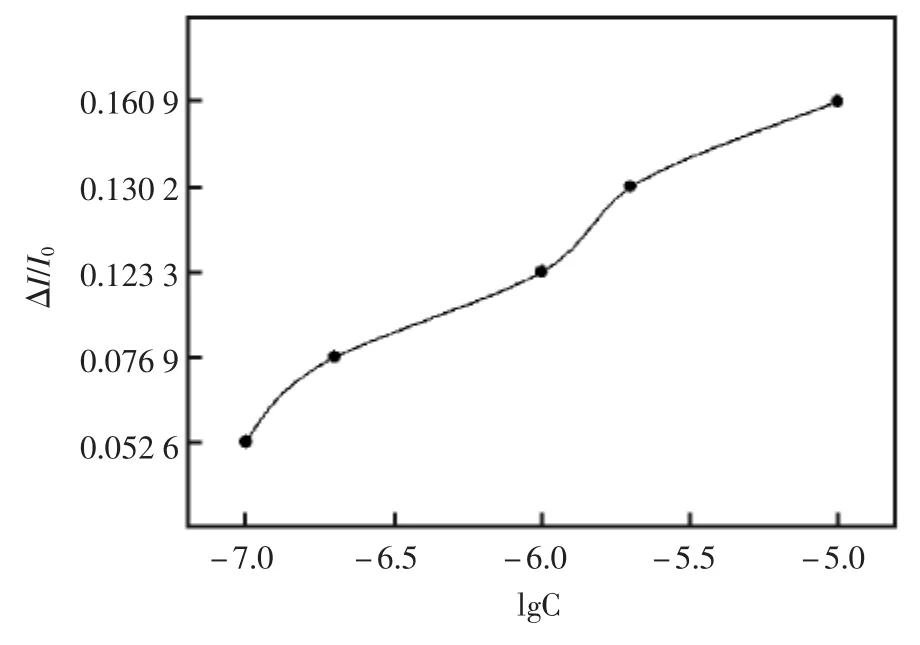
图5 荧光素浓度对响应的影响Fig.5 The influence of fluorescein concentration on the fluorescence intensity.The Fluorescence spectra was collected after exposing a pH4.75 solution containing 5.0×10-6mol/L PCP to 50 mW/cm2UV for 2.5 h,then adding different concentrations of fluorescein
对该方法的重复性进行了考察。浓度为5.0×10-7mol/L的五氯酚溶液,初始pH值4.75,置于光强为50 mW/cm2的汞灯下照射2.5 h。光照后,往溶液中加入浓度为1.0×10-5mol/L的荧光素,记录荧光素的荧光强度的变化。相同的测试每天进行一次,一共进行10 d。对十次的测试结果进行分析,得到相对标准偏差为5.3%。由此可知,该方法的稳定性和重复性较好。
2.3 干扰检测
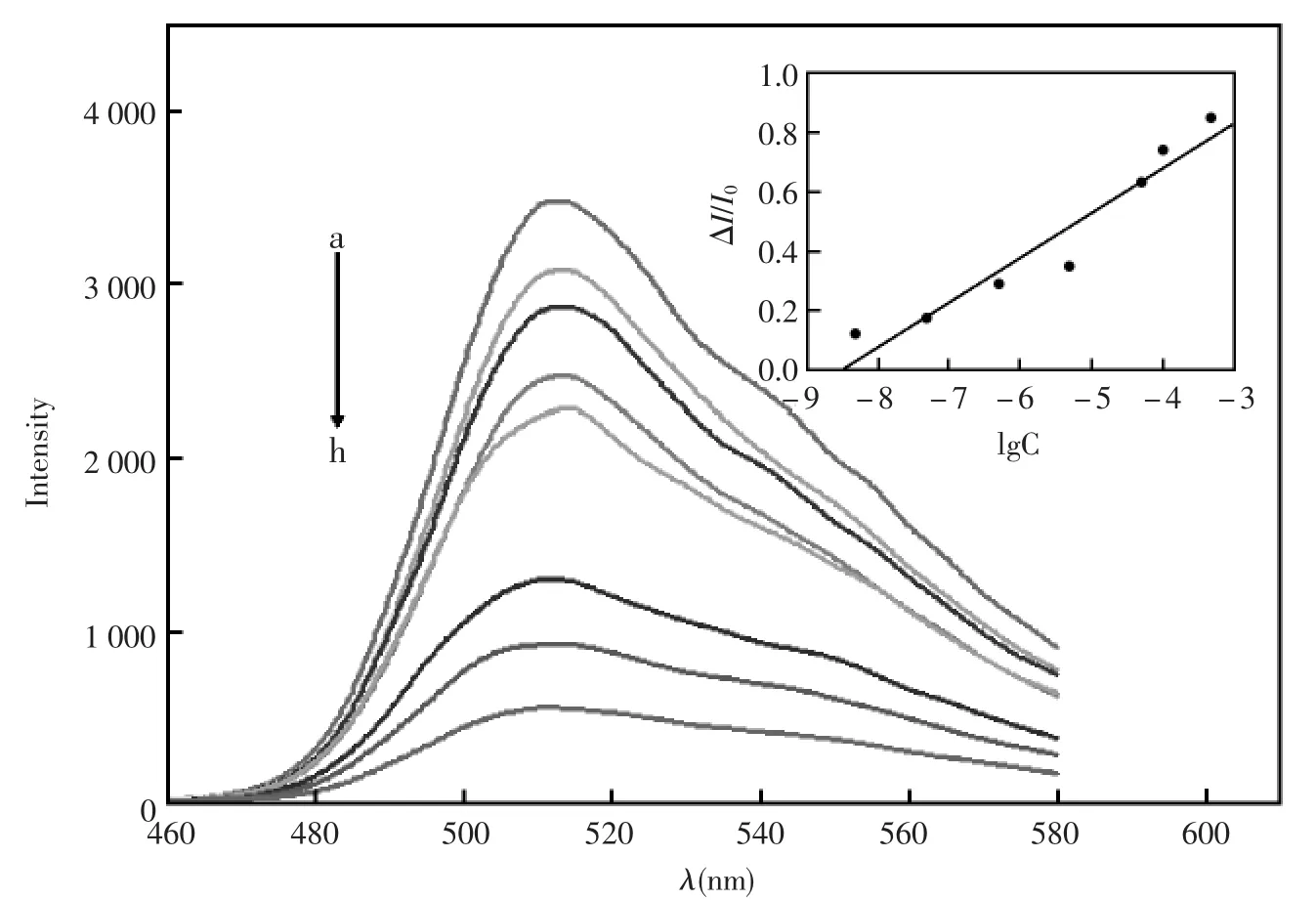
图6 荧光强度与五氯酚浓度的关系五氯酚浓度分别为(mol/L):(a)0,(b)5×10-9,(c)5×10-8,(d)5×10-7,(e)5×10-6,(f)5×10-5,(g)1.0×10-4,(h)5×10-4;插图 为五氯酚的校正曲线Fig.6 Relationship between PCP concentration and fluorescence intensity.The PCP concentrations(mol/L)are:(a)0;(b)5×10-9;(c)5×10-8;(d)5×10-7;(e)5×10-6;(f)5×10-5;(g)1.0×10-4;(h)5×10-4.The insert is the calibration curve for PCP detection
为了考察该方法对五氯酚检测的选择性,选择了五氯酚的类似物苯酚、一氯酚和二氯酚进行了干扰分析。浓度为5.0×10-7mol/L的苯酚、一氯酚和二氯酚的磷酸盐缓冲溶液 (pH为4.75),分别在50 mW/cm2汞灯光照2.5 h后,加入浓度为1.0×10-5mol/L的荧光素,记录荧光素的荧光变化。结果如表1所示,响应分别为苯酚:2.76%,一氯酚:7.79%,二氯酚:9.13%,五氯酚:35.84%。响应随苯环上氯取代数目增加而增加。对五氯酚有选择性的响应。主要原因是五氯酚本身比较容易光解,光解导致的pH值改变与氯的数目有关。氯数目越多,pH下降越大。苯酚最不易光解,响应最小。结果表明:只有那些在光照过程中会改变溶液pH值的物质,才会对检测产生干扰。

表1 间接荧光法检测五氯酚的干扰分析Tab.1 The interferences to the indirect fluorescence analysis of PCP
2.4 水样分析
最后考察了该方法对实际水样分析的可行性。分别采集了自来水、岳麓山上的泉水和湘江的江水,用孔径为0.22 μm的纤维素膜过滤后,取50mL水样加热蒸发浓缩到1mL,没有检出五氯酚。然后在上述水样中加入浓度为5×10-5mol/L的五氯酚,测得回收率分别为:94.0%(自来水),89.8%(泉水),和 119.5%(江水)。
3 小结
基于五氯酚紫外光照降解导致溶液pH改变的特点,通过指示剂荧光素的荧光变化来指示溶液pH值的变化,建立了对五氯酚的间接荧光分析法。该法的线性范围 5.0×10-4~5.0×10-9mol/L,检测限为 2.0×10-9mol/L(S/N=3)。该方法非常简单,亦无需复杂的荧光标记反应,检测的灵敏度也得到了进一步的提高。
[1]Sarrion M N,Santos F J,Galceran M T.Determination of chlorophenols by solid-phase microextraction and liquid chromatography with electrochemical detection[J].Journal of Chromatography A,2002,947(2):155~165.
[2]Cai Y Q,Cai Y E,Mou S F,et al.Multi-walled carbon nanotubes as a solid-phase extraction adsorbent for the determination of chlorophenols in environmental water samples[J].Journal of Chromatography A,2005,1081(2):245~247.
[3]Muna G W,Quaiserova′-Mocko V,Swain G M.Chlorinated Phenol Analysis Using Off-Line Solid-Phase Extraction and Capillary Electrophoresis Coupled with Amperometric Detection and a Boron-Doped Diamond Microelectrode[J].Analytical Chemistry,2005,77(22-23):6 542~6 548.
[4]Anandhakumar S,handrasekaran M,Noel M.Anodic oxidation of chlorophenols in micelles and microemulsions on glassy carbon electrode:the medium effect on electroanalysis and electrochemical detoxi fi cation[J].Journal of Applied Electrochemistry,2010,40:303~310.
[5]Codognoto L,Machado S A S,Avaca L A.Electrochemical Determination and Removal of Pentachlorophenol at Diamond Electrodes[J].Portugaliae Electrochimica Acta,2005,23:225~246.
[6]Saby C,Male K B,Luong J H T.A Combined Chemical and Electrochemical Approach Using Bis(trifluoroacetoxy)iodobenzene and Glucose Oxidase for the Detection of Chlorinated Phenols[J].Analytical Chemistry,1997,69(21):4 324~4 330.
[7]Wu M M,Llopis J,Adams S,et al.Organelle pH studies using targeted avidin and fluorescein-biotin[J].Chemisrey and Biology,2000,7(3):197~209.
[8]Barbeni M,Morello M,Pramauro E,et al.Sunlight photodegradation of 2,4,5-trichlorophenoxy-acetic acid and 2,4,5,trichlorophenol on TiO2Identification of intermediates and degradation pathway[J].Chemosphere,1987,16(6):1 165~1 179.
[9]Pecchi G,Reyes P,Sanhueza P, et al.Photocatalytic degradation of pentachlorophenol on TiO2sol-gel catalysts[J].Chemosphere,2001,43(2):141~146.
[10]Wu Y H.Nano-TiO2/dihexadecylphosphate based electrochemical sensor for sensitive determination of pentachlorophenol[J].Sensors and Actuators B,2009,137(1):180~184.
[11]Noguera P,Maquieira Á,Puchades R,et al.Development of an enzyme-linked immunosorbent assay for pentachlorophenol[J].Analytica Chimica Acta,2002,460(2):279~288.

