基于葡萄糖氧化酶-空壳钯修饰的新型葡萄糖传感器
齐骏飞,杨卉彦,胡 赢,黄杉生
(上海师范大学生命与环境科学学院,上海200234)
0 引言
人体血液中的各种化学成分一直是评价人体健康状况的重要信息。而血糖水平则是衡量新陈代谢能力和糖尿病临床诊断的重要指标。糖尿病是我国的第三大高发病,对人体有巨大的危害[1]。如何控制和治疗糖尿病已经成为一项重要的任务。是否患有糖尿病,主要根据患者血液中葡萄糖的浓度水平来判断。目前,测试血糖浓度的方法有三种:显色法、葡萄糖传感器及荧光法。三种方法各有优点,其中葡萄糖传感器具有仪器装置简单,选择性和灵敏度高、检测快速、使用方便等优点,在葡萄糖的定量检测方面显示出来独特的优越性,所以葡萄糖传感器的研究备受人们关注[2]。其中,酶生物传感器因为快响应,高敏感,特异性和高选择性而被广泛关注。
近年来,由于纳米材料在电学、光学、电磁性、催化等方面独特的性能,在纳米传感器、纳米电子器件以及催化剂等领域具有巨大的应用潜力[3~7]。其中纳米粒子,如铂纳米粒子[8~10]、铜纳米粒子[11]等表现出了对过氧化氢(H2O2)良好的催化性能并被广泛的应用于传感器的制备。同时,合成一些形貌可控的纳米材料越来越受人们的关注。通过控制实验条件,可以制备各种形貌不同的纳米材料,如纳米纤维,纳米齿轮,纳米盘以及如树枝、星星或泡沫形状的各种纳米材料[12~13]。但是很少有文献报道采用空壳钯作为敏感元件制备传感器。空壳材料代表了一类新型的催化性能良好的纳米材料[14],由于它的空壳腔体,空壳纳米粒子可以在溶液中高度分散;而且它的比表面积大,暴露的活性位点多,所以能够有效的提高它催化性能。另一个优势是在催化过程中,空壳的腔体可以形成一个微小的反应器,充分与被催化的物质接触,从而增强它的催化性能。到目前为止,有很多的葡萄糖传感器都是通过葡萄糖氧化酶催化葡萄糖产生过氧化氢,而过氧化氢在电极上产生电信号来进行葡萄糖浓度监测的[15]。所以,降低过氧化氢在电极上氧化或还原的过电位就成了很多研究关注的焦点。而在电极上过氧化氢发生氧化或还原一般都是在较高的电位条件下进行的,这样会导致许多干扰物质,如:尿酸、抗坏血酸等等,这样容易对葡萄糖的检测造成干扰[16],而采用一种能够对过氧化氢具有良好催化还原性能的材料就可以较好的解决这个问题。
该文利用空壳钯纳米粒子对过氧化氢具有良好的催化还原性能,能够有效的降低过氧化氢在电极上还原的过电位的特性,将空壳钯纳米粒子和葡萄糖氧化酶(GOD)修饰在玻碳电极(GC)表面,构建了新型的葡萄糖传感器(GOD/hollow Pd/GC)。以循环伏安等方法研究了传感器的电化学响应特性,表明该电极能够有效的用于葡萄糖的检测。
1 实验部分
1.1 试剂和仪器
四丁基溴化膦(Bu4PBr)购于百灵威;壳聚糖(Chits)、氯化钯(PdCl2)、戊二醛购于国药集团上海 分 公 司 ; 葡 萄 糖 氧 化 酶 (GOD)、Na2HPO4、NaH2PO4、H2O2购于生活试剂公司;磷酸盐缓冲液 (PBS) 由 0.1 mol/L Na2HPO4和 0.1 mol/L NaH2PO4配制。实验中所用试剂均为分析纯,实验用水为二次蒸馏水。
电化学工作站(CHI 760C,上海辰华公司);实验中采用三电极体系,修饰电极为工作电极,铂丝电极为对电极,饱和甘汞电极为参比电极(SCE);循环伏安法(CV)、电化学阻抗谱图(EIS)在CHI 760C电化学工作站 (上海辰华仪器公司,中国)上进行,采用三电极体系;透射电子显微镜(TEM,JEM-2010,日本)。所有的实验条件均在室温下进行。
1.2 传感器的制备
1.2.1 空壳钯纳米粒子的制备
空壳钯纳米粒子的制备根据Li等报道的方法进行[17],并在其基础上进行了一定的改进。在温度25℃时,将320mL含10 mmol/L的Bu4PBr水溶液与16mL 10 mmol/L的PdCl2水溶液混合,混合液置于500mL的反应容器内,不停地搅拌约4 min,在强力搅拌过程中将一定量的新制备好的KBH4溶液快速加入到上述溶液中,溶液的颜色从桔黄色变成亮黑色,随着搅拌的进行,逐渐变成黑色的悬浊液,继续搅拌30 min左右,将产物离心分离,分别用超纯水和乙醇反复洗涤,得到空壳钯纳米球,最后将空壳钯纳米粒子储存在乙醇溶液中备用。
1.2.2 修饰电极的制备
玻碳电极分别用 1.0、0.3、0.05 mm 的氧化铝粉末抛光,直至产生一个光亮、平滑的表面,然后将电极分别置于1∶1的硝酸、无水乙醇、超纯水中超声清洗3 min,得到干净的玻碳电极,用氮气吹干后备用。称取1 mg的空壳钯纳米颗粒将其溶于0.5%的壳聚糖溶液中,混合液超声30 min,得到混合均匀分散的电极修饰液,移取8 μL 1 mg/mL的hollow Pd-chit混合液滴涂在处理干净的玻碳电极表面,在干燥器中室温晾干;将5 mg GOD 溶解于 1mL 0.1 mol/L PBS(pH=7.0)的PBS中得到葡萄糖氧化酶的溶液浓度为5 mg/mL,然后将5 mg/mL葡萄糖 氧 化 酶溶液 50 μL,5 mg/mL牛血清蛋白溶液50 μL,25 mg/mL戊二醛溶液50 μL充分混合后,取混合液8 μL滴涂到修饰了空壳钯纳米粒子的玻碳电极上,将修饰好的电极放在冰箱中保持4℃干燥过夜,即得到修饰电极GOD/hollow Pd/GC。修饰电极不用时保存在 4 ℃下 0.1 mol/L 的 PBS(pH=7.0)中。
2 结果与讨论
2.1 空壳钯纳米粒子的TEM表征
以TEM对空壳钯纳米粒子的形貌进行了表征。图1为空壳钯纳米粒子的TEM图,由图中表明,所制备的空壳钯纳米粒子直径在50~100 nm之间,且分散程度较好。

图1 空壳钯纳米粒子的TEM图Fig.1 TEM images of hollow Pd
2.2 修饰电极的电化学阻抗谱图
电化学阻抗谱图(EIS)是一种最常用、高灵敏度的界面研究技术,被广泛用于修饰电极的界面特性分析。半圆的直径,也就是电子转移阻抗Ret,可用来描述电极的界面性质。图2显示了不同修饰层电极在 10 mmol/L Fe(CN)63-/4-和 0.1 mol/L KNO3溶液中的电化学阻抗谱图,各曲线分别代表裸玻碳电极(GC),hollow Pd/GCE 和 GOD/hollow Pd/GCE层层修饰的电极。由图可知,裸的GC(曲线a)抗图是一个半圆,当修饰了空壳钯纳米粒子后,曲线b的半圆的直径明显变小,这归功于空壳纳米粒子具有能够作为微小的导电中心,从而使得电子转移更加容易,这个现象说明修饰了空壳钯纳米粒子后电极的电子传递性能增加;曲线c是修饰了葡萄糖氧化酶后的电化学阻抗曲线,由图可以看出曲线c的半圆的直径明显变大,这是因为电极表面修饰的酶阻碍了Fe(CN)63-/4-在电极表面的电子传递过程。通过电化学阻抗谱图的表征,可以看到空壳钯能够增强电极表面的电子传导能力;通过各修饰层阻抗曲线的变化,表明电极的修饰是成功的。
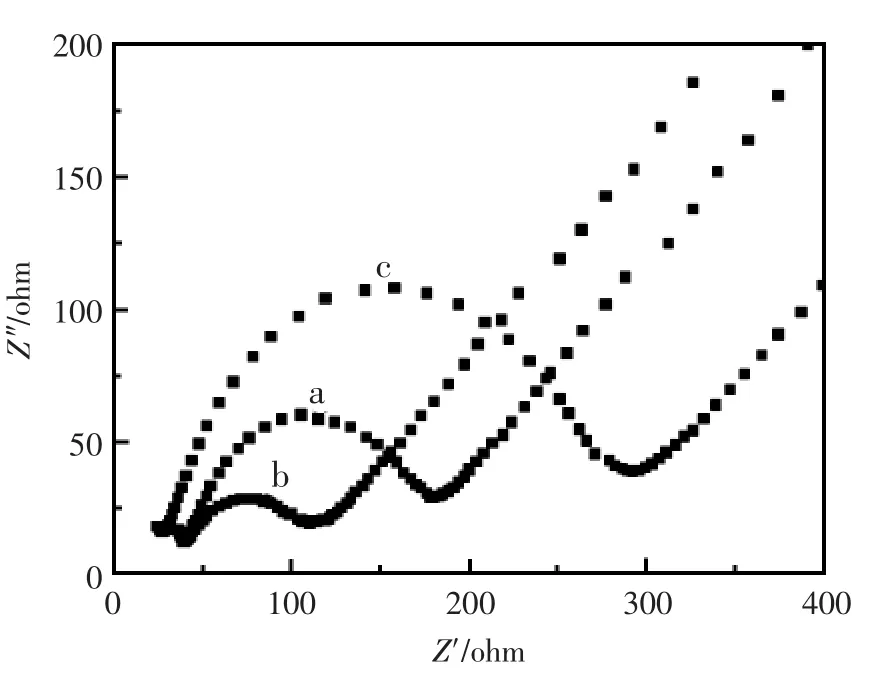
图2 不同修饰层电极的阻抗谱图(a)裸 GC;(b)hollow Pd/GC;(c)GOD/hollow Pd/GCFig.2 The EIS images of different layers modified electrode
2.3 空壳钯纳米粒子对H2O2的催化还原表征
在许多研究中,基于葡萄糖氧化酶制备的葡萄糖传感器所产生的电信号很多都是由中间产物H2O2所产生的。修饰电极与底液接触后,溶液中的葡萄糖分子扩散到电极的表面,在氧存在条件下葡萄糖分子被GOD催化氧化成葡萄糖酸内酯,同时生成H2O2,H2O2被氧化或还原,从而在电路中产生响应电流,如反应式(1),(2)所示。因此可以通过检测H2O2在电极上产生的响应电流来测定葡萄糖的浓度[18~20]。
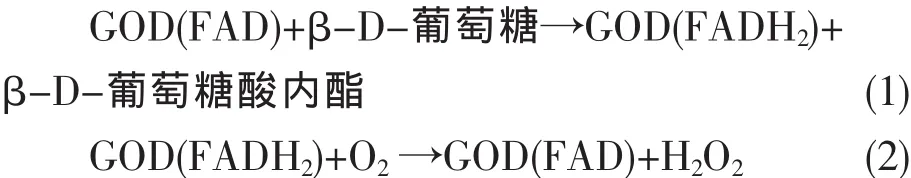
众所周知,H2O2在裸的玻碳电极上也可以发生氧化或还原,但是氧化或还原的电位均较高,从而引起较大的背景电流和较多干扰物质的影响。此外,利用过氧化氢在电极上氧化产生电信号进行检测时,许多还原性的干扰物,如:尿酸、抗坏血酸等也容易被氧化从而产生较大的干扰电流。所以,选择一种新型的催化材料能够催化过氧化氢还原从而降低过氧化氢在电极上还原的过电位,可以有效的解决上述两个问题。为了探讨hollow Pd对H2O2的催化还原作用,以循环伏安法对其进行了研究。图3显示hollow Pd/GC和裸 GC(内插图 )在不含 H2O2(曲线 a)和含有H2O2(曲线b)溶液中的循环伏安曲线。由内插图 可以看到,在裸GC上H2O2的还原要在-0.6 V后才能发生,而且响应电流很小;然而,在修饰电极hollow Pd/GC 上, 自-0.2 V 开始,H2O2就可以发生还原反应,而且产生的响应电流明显增大。这些现象都归因于空壳钯纳米粒子对过氧化氢具有良好的催化还原性能,有效的降低了过氧化氢还原的过电位,同时增大了响应电流。所以,选择空壳钯催化葡萄糖氧化的中间产物H2O2,可以通过检测过氧化氢产生的电信号,来得到响应电流与葡萄糖浓度之间的关系,该传感器有效的降低了还原的过电位,排除了干扰,提高了电流响应。
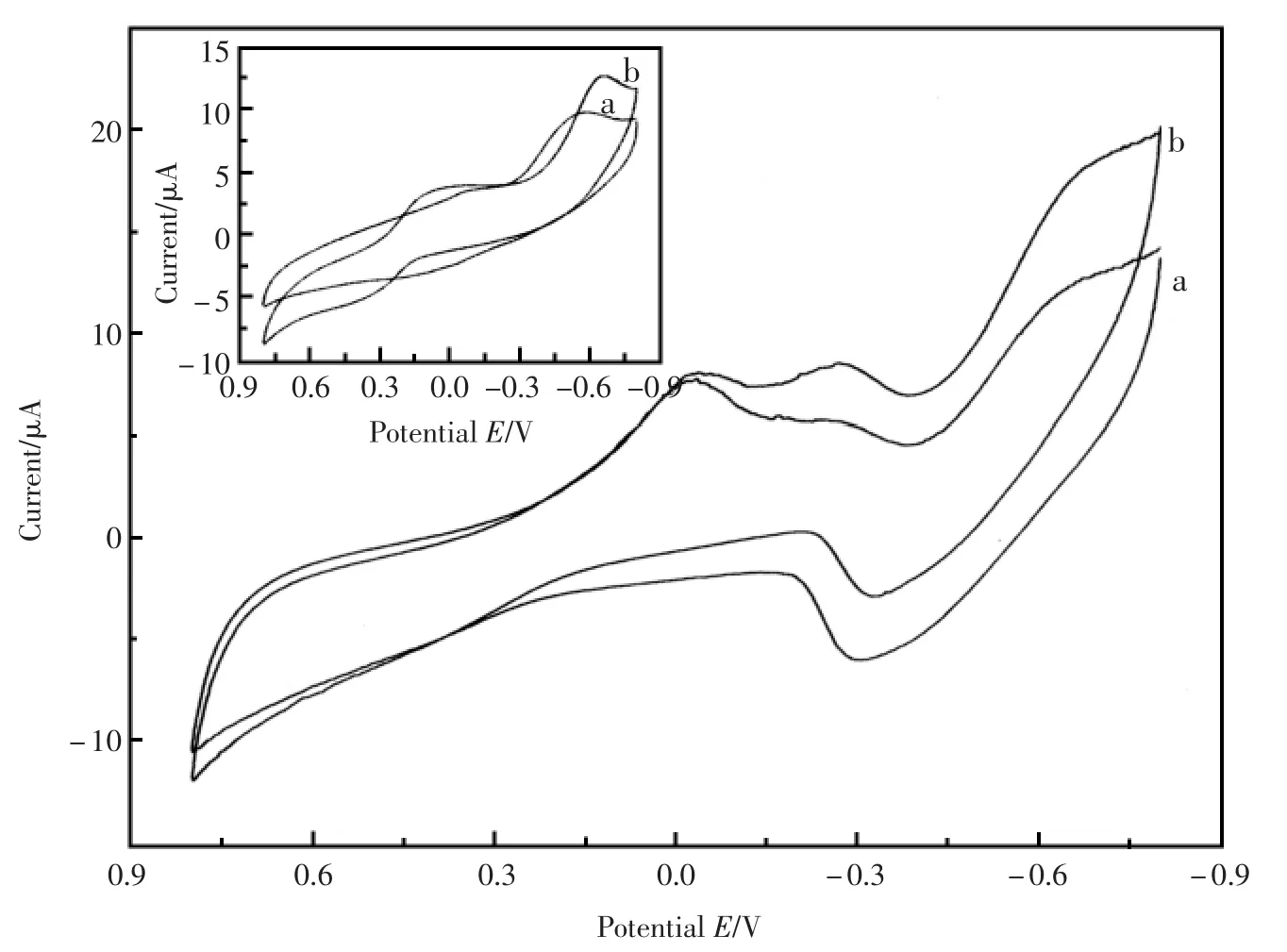
图3 不同修饰层电极裸GC(内插图 )和hollow Pd/GC在不含H2O2(a)和含有H2O2(b)时的循环伏安图,底液为 0.1 mol/L PBS(pH=7.0);扫描速度:100 mV/sFig.3 The cyclic voltammograms of every layer modified electrodes in 0.1 mol/L PBS(pH=7.0)without(a)and with(b)H2O2;Scan rate:100 mV/s
2.4 实验最佳条件的选择
2.4.1 pH的选择
因为酶的活性受到溶液酸碱性的影响,所以实验中考察了pH值对传感器响应电流的影响。图4为不同pH与响应电流之间的关系,由图4中可以看出,当底液的pH值小于7时,响应电流随着pH的增大而增大;当pH值等于7时,响应电流达到最大值,此时葡萄糖氧化酶的活性最好;而当pH值大于7时,随着pH值的增大,响应电流反而变小,这是因为酸性或碱性过强都会使得酶的活性下降。因此,在该实验中,选择pH值等于7.0的PBS作为测试底液。
2.4.2 温度的选择
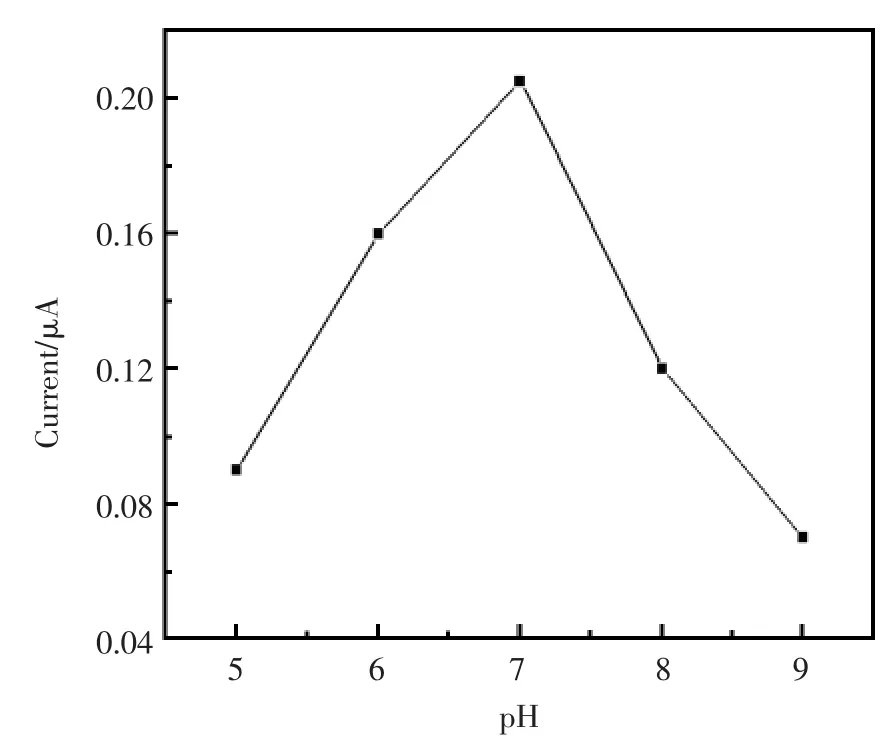
图4 不同pH对传感器响应电流的影响Fig.4 Effect of pH on the current response of modified electrode
温度的变化将影响酶的活性和酶的催化速率,该实验考察了在10℃~50℃范围内响应电流和温度之间的关系。图5 显示修饰电极产生的响应电流和不同温度之间的关系曲线图。从图中可见,在10℃~35℃范围内响应电流随着温度的升高而增大,但是当温度超过35℃时,响应电流急剧减小,这可能是由于温度过高会导致酶的活性降低而引起的。考虑到酶电极的使用寿命和电极灵敏度等因素,实验中选择30℃作为实验温度。
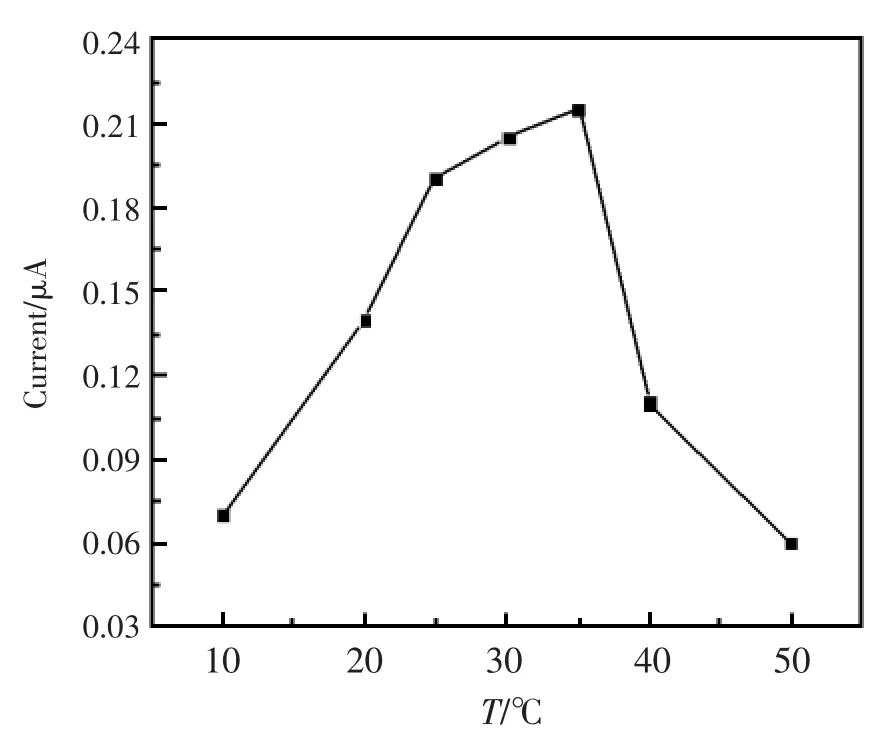
图5 温度对传感器响应电流的影响Fig.5 Effect of temperature on the current response of modified electrode
2.4.3 工作电位的选择
该葡萄糖传感器是基于空壳钯催化还原过氧化氢产生电信号来进行检测的,实验采用计时电流法测定葡萄糖。过氧化氢在hollow Pd/GC上的还原从-0.2 V开始,所以考察了不同电位对响应电流的影响(图6)。从图6可见,在-0.30 V和-0.35 V电位处,响应电流接近最大值,但是电位较低时产生的背景电流干扰较小,所以实验中选择-0.30 V作为工作电位。
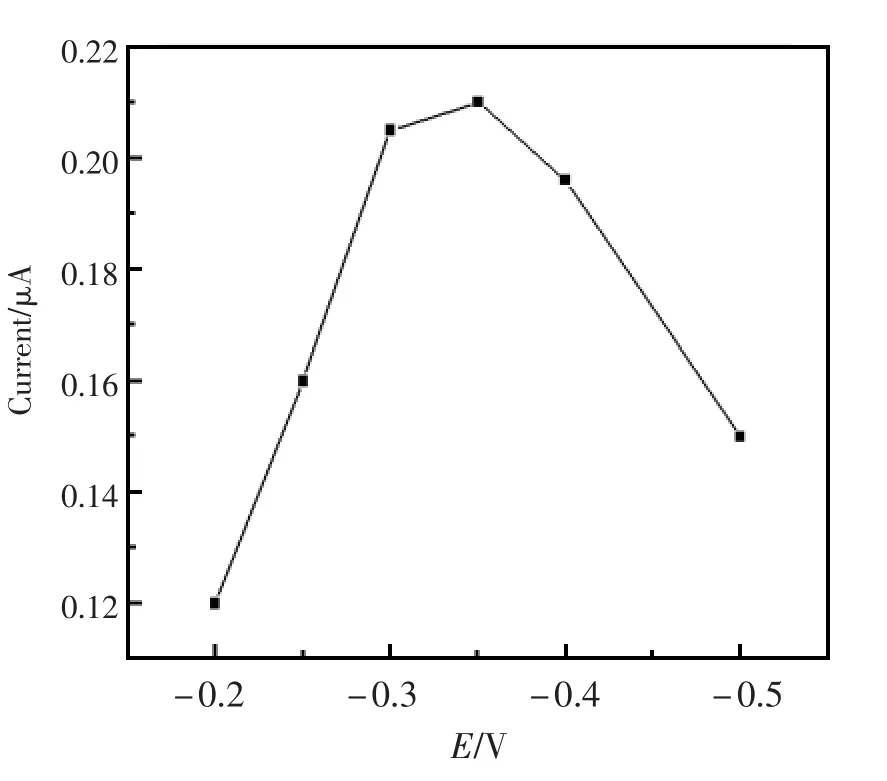
图6 不同工作电位对响应电流的影响Fig.6 Effect of the working potential on the current response of modified electrode
2.5 葡萄糖在传感器的电化学响应
图7为在0.1 mol/L PBS(pH=7.0)溶液中,葡萄糖在GOD/hollow Pd/GC上计时电流响应图(内插图 是相应的线性校准曲线)。从图中可以看出,在 2.5×10-5mol/L 到 2.7×10-3mol/L 的范围内传感器线性响应良好,线性相关方程为:I(μA)=1.095+2.023c(mmol/L),相关系数为 0.999 9。最低检测限为 10 μmol/L(三倍信噪比)。

图7 葡萄糖在GOD/hollow Pd/GC的计时电流响应曲线;底液:0.1 mol/L的PBS(pH=7.0),葡萄糖加入的浓度梯度为0.1 mmol/L,工作电位:-0.3 VFig.7 Current-time response obtained by successive addition of 0.1 mmol/L glucose into the test solution at GOD/hollow Pd/GC.The applied potential was-0.3 V,solution:0.1 mol/L PBS(pH=7.0)
实验考察了传感器的重现性、稳定性及抗干扰性。在 5mL 0.1 mol/L 的 PBS(pH=7.0)的溶液中加入2.0×10-6mol/L葡萄糖溶液,连续测定8次,得到相对标准偏差为4.3%,说明该传感器具有较好的重现性。把该传感器保存在4℃PBS(pH=7.0)中,两个星期后,传感器的响应信号为初始信号的90%左右,说明该传感器具有较好的稳定性。维持葡萄糖的浓度为0.1 mmol/L,实验考察了传感器的抗干扰性,对可能造成干扰的物质,如:尿酸、抗坏血酸、L-半胱氨酸等进行了干扰测定,数据显示几乎没有干扰。这归功于该葡萄糖传感器的工作电位是负电位,而这些干扰物质属于还原性的物质,所以在此工作电位下不会发生还原反应而产生干扰。
2.6 实际样品的测定
取市售的葡萄糖注射液作为实验测定的实际样品,对其进行稀释,取3份稀释后的葡萄糖注射液,分别向3份实际样品中加入1.0 mmol/L的葡萄糖标准溶液,进行回收率的测定。结果如表1所示,该方法测定的回收率为 96.8%~103.1%。说明该方法制备的葡萄糖传感器为测定葡萄糖实际含量提供了一种较为准确的方法。
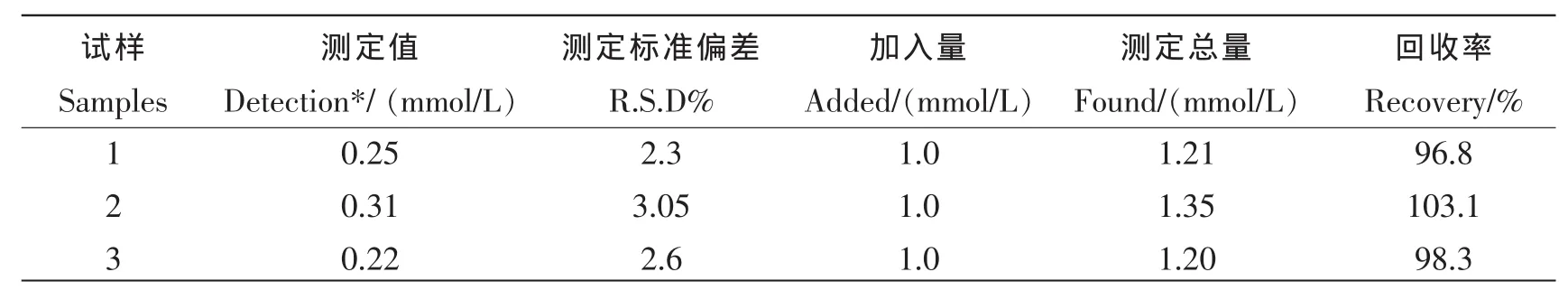
表1 样品的检测(n=3)Tab.1 Determination results of samples(n=3)
3 结论
该文报道了一种新型的葡萄糖生物传感器。该传感器是通过在玻碳电极表面修饰空壳钯,然后再固定葡萄糖氧化酶来制备的。利用空壳钯可以催化还原过氧化氢,通过测定酶反应产生的过氧化氢来测定葡萄糖。实验表明,空壳钯对过氧化氢具有良好的催化还原作用,通过计时电流法表明在一定浓度范围内响应电流与葡萄糖的浓度成较好的线性关系。此外,该传感器还具有稳定性好,抗干扰能力强等特点,为检测葡萄糖提供了一种简单有效的方法。
[1]Turner A P F,Pickup J C.Diabetes-mellitus-biosensors for research and management[J].Biosensors,1985,1:85~115.
[2]Tkac J,Vostiar I Gemeiner P,Sturdik E.Monitoring of ethanol during fermentation using a microbial biosensor with enhanced selectivity[J].Bioelectrochemistry,2002,56(1-2):127~129.
[3]Chen H M,He J H,Zhang C B,et al.Self-assembly of novel mesoporous manganese oxide nanostructures and their application in oxidative decomposition of formaldehyde[J].Journal of Physical Chemistry C,2007,111(49):18 033~18 038.
[4]Cheng F Y,Zhao J Z,Song W,et al.Facile controlled synthesis of MnO2nanostructures of novel shapes and their application in batteries[J].Inorganic Chemistry,2006,45(5):2 038~2 044.
[5]Murakami T,Ajima K,Miyawaki J,et al.Drug-loaded carbon nanohorns:adsorption and release of dexamethason in vitro[J].Molecular Pharmaceutics,2004,1(6):399~405.
[6]Kinsella J M,Lvanisevic A.Enzymatic clipping of DNA wires coated with magnetic nanoparticles[J].Journal of the American Chemical Society,2005,127(10):3 276~3 277.
[7]Maxwell D J,Taylor J R,Nie S.Self-assembled nanoparticle probes for recognition and detection of biomolecules[J].Journal of the American Chemical Society,2002,124(32):9 606~9 612.
[8]Chu X,Duan D,Shen G,et al.Amperometricglucose biosensor based on electrodeposition ofplatinum nanoparticles onto covalently immobilized carbonnanotube electrode[J].Talanta,2007,71:2 040~2 047.
[9]Qu F,Yang M,Shen G,et al.Electrochemical biosensing utilizingsynergicaction ofcarbon nanotubesand platinum nanowires prepared by template synthesis[J].Biosens.Bioelectron.,2007,22:1 749~1 755.
[10]Cui H,Ye J,Zhang W,et al.Selective and sensitive electrochemical detection of glucose in neutral solution using platinum-lead alloy nanoparticle/carbon nanotube nanocomposites[J].Anal.Chim.Acta,2007,594:175~183.
[11]Vijayalakshmi A,Karthikeyan R,Berchmans Sheela.Nonenzymatic Reduction of Hydrogen Peroxide Produced during the Bioelectrocatalysis of Glucose Oxidase on Urchin-like Nanofibrillar Structures of Cu on Au Substrates[J].J.Phys.Chem.C,2010,114(50):22 159~22 164.
[12]Ah C S,Yun Y J,Park H J,et al.Size-controlled synthesis of machinable single crystalline gold nanoplates[J].Chemistry of Materials,2005,17(22):5 558~5 561.
[13]Song Y,Steen W A,Pena D,et al.Foamlike nanostructures created from dendritic platinum shees on liposomes[J].Chemistry of Materials,2006,18(9):2 335~2 346.
[14]Liang H P,Lawrence S N,Wan L J,et al.Controllable Synthesis of Hollow Hierarchical Palladium Nanostructures with Enhanced Activity for Proton/Hydrogen Sensing[J].J.Phys.Chem.C, 2008,112:338~344.
[15]Sulak M T,Gokdogan O,Gulce A,et al.Amperometric glucose biosensor based on gold-deposited polyvinylferrocene film on Pt electrode[J].Biosens.Bioelectron.,2006,21:1 719~1 726.
[16]Wu B Y,Hua S H,Yin F,et al.Amperometric glucose biosensor based on layer-by-layer assembly of multilayer films composed of chitosan,gold nanoparticles and glucose oxidase modified Pt electrode[J].Biosens.Bioelectron.,2007,22:838~844.
[17]Li H,Liu H,Xie S H,et al.Vesicle-Assisted Assembly of Mesoporous Ce-Doped Pd Nanospheres with a Hollow Chamber and Enhanced Catalytic Efficiency[J].Adv.Funct.Mater.,2008,18:3 235~3 241.
[18]Ricci F,Palleschi G.Sensor and biosensor preparation,optimisation and applications of Prussian Blue modified electrodes[J].Biosens.Bioelectron.,2005,21:389 ~407.
[19]Zhang D,Zhang K,Yao Y L,et al.Multilayer Assembly of Prussian Blue Nanoclusters and Enzyme-Immobilized Poly(toluidine blue)Films and Its Application in Glucose Biosensor Construction[J].Langmuir,2004,20:7 303 ~7 301.
[20]Marystela F,Pablo A F,Osvaldo N O,et al.Enzymemediated amperometric biosensors prepared with the Layer-by-Layer(LbL)adsorption technique[J].Biosens.Bioelectron.,2004,19:1 611~1 615.

