Dnd1基因RNAi慢病毒载体的构建与鉴定
李顺东 ,于 淼 ,张 勇 ,邓 来 ,谭宇婷 ,程 洁 ,彭小宁
(1.长沙市第三医院,湖南 长沙 410005,2.湖南师范大学医学院,3.中南大学湘雅二医院,湖南 长沙410006)
小鼠Dnd1基因第一个睾丸生殖细胞瘤(TGCT)易感基因,研究表明Dnd1基因在进化中具有保守性[1],因此Dnd1一定具有重要的生物学功能。近年来,尽管国际同行相继发现Dnd1与Apobec3相互作用[2],Dnd1参与 miRNAs的活性调控[3],但该基因在睾丸生殖细胞瘤发生中的调控作用及其分子机制仍不清楚。我们实验室首次发现过表达Dnd1抑制细胞增殖和诱导细胞周期G1期阻滞[4],为了反向证明这一重要的体外生物学功能,我们构建Dnd1基因RNAi慢病毒载体,以期在哺乳动物细胞中高效、稳定表达,从而为深入研究Dnd1细胞分子机制奠定基础。
1 材料和方法
1.1 材料
慢病毒载体系统购自上海吉凯基因化学技术有限公司,包括pGCSIL-GFP载体,pHelper 1.0载体和 pHelper 2.0载体,pGCSIL-GFP载体含有能持续表达小RNA的元件,同时能表达荧光蛋白,pHelper 1.0载体和pHelper 2.0载体含有病毒包装所必须的元件。E.coli DH5α感受态细胞为本实验室保存;PCR试剂盒购自promega公司,引物由上海吉凯基因技术有限公司合成,Taq DNA聚合酶为TaKaRa产品;质粒重组所用限制性内切酶Age I和 EcoR I,连接酶T4 DNA ligase为 NEB公司产品;琼脂糖凝胶购自赛百盛公司;DNA抽提试剂盒购自QIAGEN公司;DMEM低糖培养基干粉购自Gibco公司,标准小牛血清为杭州四季青生物工程材料有限公司产品;包装细胞293T购自上海吉凯基因化学技术有限公司。其他试剂均购自上海生物工程公司和北京鼎国公司。
1.2 方法
1.2.1 Dnd1基因干扰序列的设计
根据小鼠Dnd1基因mRNA序列 (BC034897),按照siRNA设计原则用Ambion公司的设计软件,设计4条Dnd1的siRNA序列见表1。并用Blast软件与小鼠基因组比对,保证设计序列唯一性。Dnd1 Oligo DNA序列按 5'_lingker_sense_loop_antisense_lingker_3'设计 (5'_lingker为Age I酶切位点,3'_lingker为 EcoR I酶切位点)。病毒载体构建框架见表2。上海吉凯基因技术公司合成Dnd1 Oligo DNA。
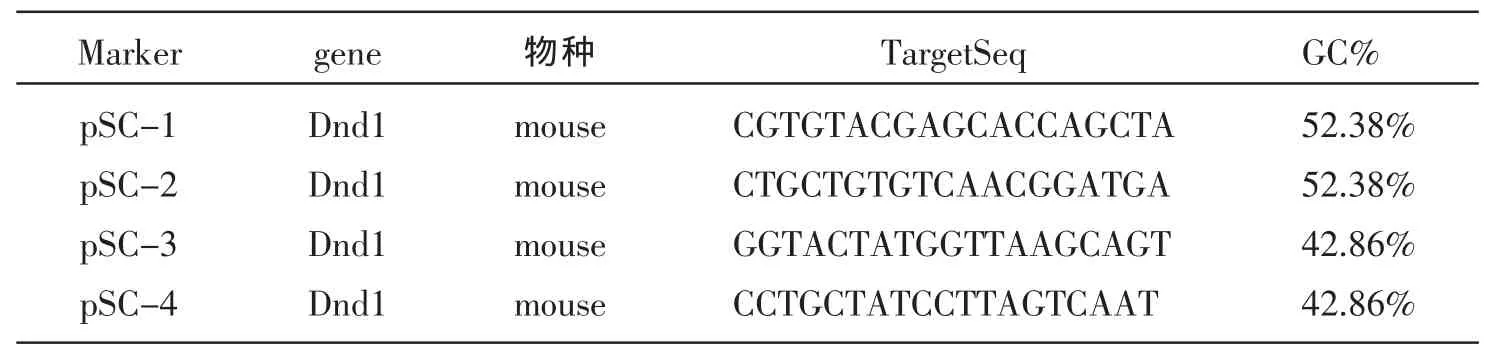
表1 小鼠Dnd1特异siRNA序列
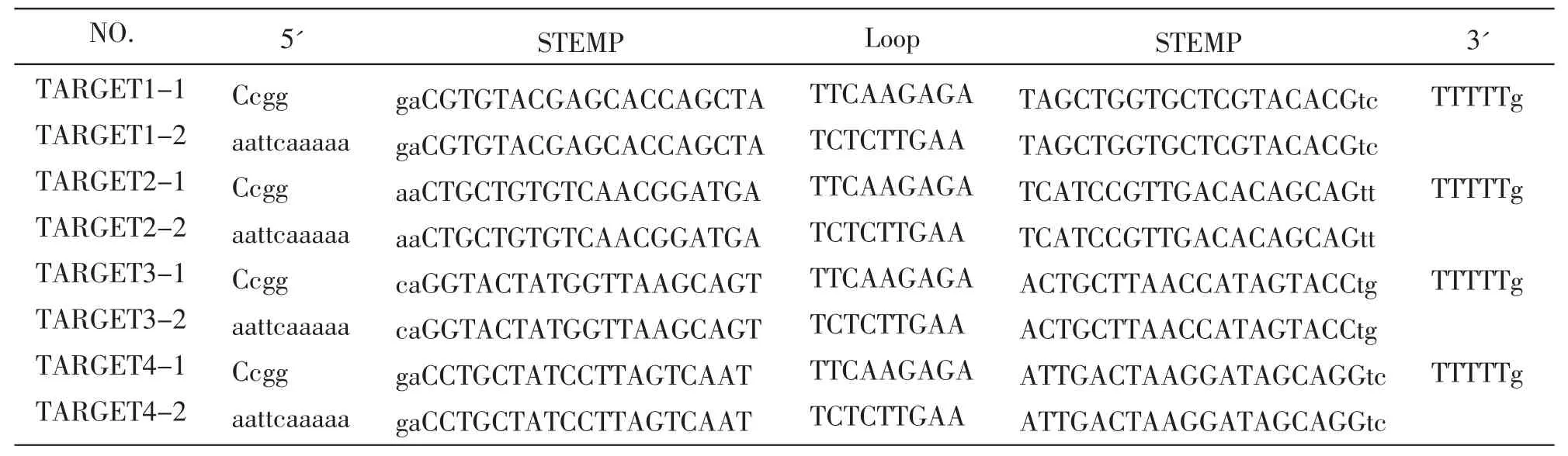
表2 小鼠Dnd1sh RNA病毒载体构建框架
1.2.2 Dnd1 sh RNA慢病毒载体的构建
1.2.2.1 Oligo DNA退火与线性化pGCSIL-GFP载体:退火反应体系为 Oligo DNA(sense)(1μg/μL)5 μL,Oligo DNA(antisense)(1μg/μL)5 μL,5×Universal Buffer 20 μL,ddH2O 70 μL。 混匀,9O ℃ 4 min,70℃ 10 min,缓慢冷却至室温。12%非变性聚丙烯凝胶电泳(PAGE)凝胶检测双链 Oligo DNA形成效率。使用Age I和EcoR I进行酶切消化pGCSIL-GFP载体:酶切反应体系:纯化的DNA质粒(1μg/μL)2 μL,10×buffer 5 μL,100×BSA 0.5μL,Age I(10 U/μL)1μL,EcoR I(10 U/μL)1μL,H2O 40.5μL。将上述混合的反应物置于37℃,1 h。
1.2.2.2 退火双链Oligo DNA与线性pGCSIL-GFP载体连接:线性化 的pGCSIL-GFP质粒黏性末端方便双链核苷酸的定向插入,编码sh RNA的双链核苷酸连接到pGCSIL-GFP质粒上,生成含RNAi盒 (人U6启动子+双链核苷酸+GF P标记)的pGCSIL-GFP慢病毒载体。
连接反应体系:酶切回收的载体DNA(100 ng/μL)1μL,退火的双链 DNA(100 ng/μL)1?L,10×T4噬菌体DNA连接酶缓冲液1μL,T4噬菌体DNA连接酶 1μL,dd H2O 7μL。 于 4℃ 12 h时连接反应制备克隆连接液,准备转化。
1.2.2.3 连接产物转化宿主菌 E.coli DH5a:将已转化的感受态细胞转移至含Amp抗性的S0B琼脂培养基上,37℃ 培养16 h。pGCSIL-GFP载体上所携带的抗性基因可使转化的宿主菌在含Amp抗性SOB琼脂培养基上生长。
1.2.3 PCR鉴定及DNA测序鉴定
PCR鉴定策略见图1。阳性克隆上游引物:5'-CCTATTTCCCATGATTCCTTCATA-3',下游引物:5'-GTAATACGGTTATCCACGCG-3'。 PCR条件:94 ℃,30 s;94 ℃,30 s;60 ℃,30 s;72℃,30 s;30个循环;72℃,6 min。挑选阳性克隆送上海吉凯基因技术公司测序。

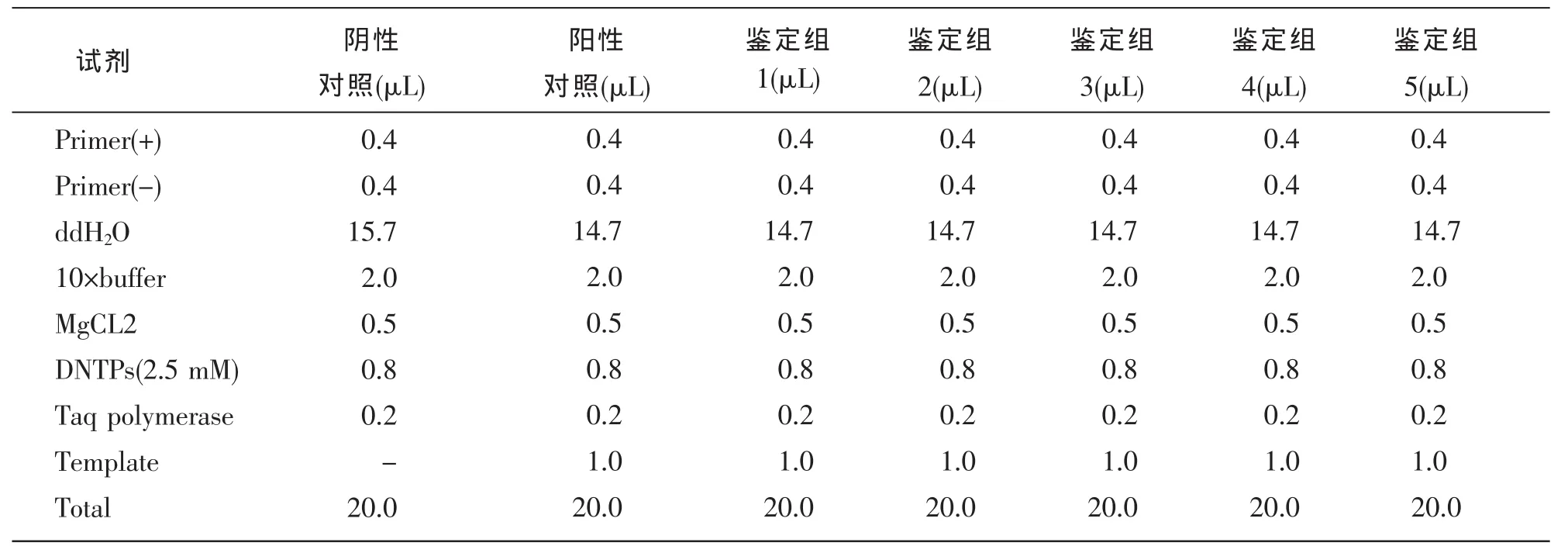
表3 PCR反应体系
2 结果
2.1 Dnd1 sh RNA慢病毒载体阳性克隆的 PCR鉴定
构建好的分别含Dnd1 sh RNA的pGCSILGFP载体的阳性克隆行 PCR鉴定 (图 2示TARGET2),结果提示,靶序列和U6启动子、GFP连接生成pGCSIL-GFP/U6 RNAi盒;生成正确的入门克隆。连接入vshRNA片段的阳性克隆PCR片段大小为:343bp(从载体中切掉24bp);没有连接入vshRNA片段的空载体克隆PCR片段大小为:306 bp。挑选阳性克隆送测序。 菌落PCR Template:在连接转化产物长出菌克隆表面沾一下,溶于10μL LB,混匀取1μL作为模板;阴性对照:排除系统中外源核酸污染导致假阳性结果。
2.2Dnd1sh RNA慢病毒载体阳性克隆DNA测序鉴定

选取阳性克隆菌落测序分析,结果显示,插入片段序列 TARGET1,TARGET2,TARGET3, TARGET4无核苷酸突变,插入位置正确(图3示TARGET2)。

3 讨论
Dnd1基因在进化中具有保守性,说明一定具有重要的生物学功能,然而迄今为止,对Dnd1的体外生物学功能了解甚少。我们前期研究发现Dnd1过表达抑制细胞增殖、诱导细胞周期G1期阻滞和抑制AP-1的转录活性这些重要的细胞学功能[4]。因此,反向证明这些生物学功能十分必要。
RNAi的特异性和强有力的基因表达抑制效果使其成为基因功能研究的得力工具。由于si RNA(Dicer酶切或化学合成)作用的短暂性,在哺乳动物的RNAi应用中受到限制。为克服这一缺陷,多个研究小组设计了载体介导的RNAi系统,通过RNA多聚酶Ⅲ启动转录产生 sh RNA实现 RNAi。只要把这种sh RNA表达结构导人细胞,即可实现对特定基因表达的抑制[5]。来源于人类免疫缺陷病毒-1(HIV-1)的慢病毒载体为近年开发新的病毒载体,慢病毒能感染非分裂期细胞,感染效率高、免疫反应性低,最主要是能在体外稳定转染,与宿主基因组发生整合而实现长期稳定表达。因此,慢病毒载体作为si RNA的携带者,不但具备特异性地使基因表达沉默的能力,而且充分发挥了慢病毒载体自身所具备的优势,是抑制基因表达的理想载体。
我们采用吉凯基因提供的Lentivirus为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒[6,7]。本研究中慢病毒载体系统由pGCSIL-GFP载体、pHelper 1.0载体和pHelper 2.0载体三质粒组成。pHelper 1.0载体中含有HIV病毒的gag基因,编码病毒主要的结构蛋白;pol基因,编码病毒特异性的酶;rev基因,编码调节gag和pol基因表达的调节因子。pHelper 2.0载体中含有单纯疱疹病毒来源的VSV-G基因,提供病毒包装所需要的包膜蛋白[8.9]。故该慢病毒载体系统安全、方便、可调控目的基因表达,为基因功能研究的重要工具之一 。本实验经过PCR筛选阳性克隆及测序鉴定,证明Dnd1 shRNA正确插入pGCSIL-GFP载体,表明成功构建了Dnd1基因RNAi慢病毒载体,这为进一步从分子水平研究 Dnd1的细胞学功能建立了重要基础。
[1]Youngren KK,Covene D,Peng XN,et al.The Ter mutate on in the dead end gene causes germ cell loss and testicular germ cell tumours[J].Nature,2005,435(7040):360-364.
[2]Bhattacharya C,Aggarwal S,Kumar M,et al.Mouse apolipoprotein B editing complex 3 (APOBEC3)is expressed in germ cells and interacts with Dead-end(DND1)[J].PLOS One,2008,3(5):e2315.
[3]Kedde M,Strasser MJ,Boldajipour B,et al.RNA-Binding Protein Dnd1 Inhibits MicroRNA Access to Target mRNA[J].Cell,2007,131(7):1273-1286.
[4]张菁,丁小凤,罗畅,等.Dnd1的蛋白亚细胞定位及其对HeLa细胞增殖的抑制作用 [J].中国生物化学与分子生物学报,2009,25(1):37-43.
[5]宋现让,迟伟玲,魏玲,等.慢病毒 sh RNA表达载体介导人肿瘤细胞基因稳定沉默的影响因素[J].中国生物工程杂志,2007,27(2):19-23.
[6]Naldini L,Bl?mer U,Gallay P,et al.In Vivo Gene Delivery and Stable Transduction of Nondividing Cells by a Lentiviral Vector[J].Science,1996,272(5259):263-267
[7]Cockrell AS,Tal Kafri.Gene delivery by lentivirus vectors[J].Mol Biotechnol,2007,36(3):184-204.
[8]Bukrinsky MI,Haggerty S,Dempsey MP,et al.A nuclear localization signal within HIV-1 matrix protein that governs infection of non-dividing cells[J].Nature,1993,365(6447):666-669.
[9]Miyoshi H,Smith KA,Mosier DE,et al.Transduction of Human CD34+Cells That Mediate Long-Term Engraftment of NOD/SCID Mice by HIV Vectors[J].Science,1999,283(5402):682-686.

