外源性胰岛素对2型糖尿病的骨密度和骨代谢指标的影响
朱江,孙伟
(安徽淮北市人民医院内分泌科,235000)
2型糖尿病患者(DM)发生骨质疏松症(OP)的风险是否增加,其间是否存在关联,2型糖尿病是否是骨质疏松的影响因素以及使用胰岛素对骨质疏松有无帮助尚存在较多争议。在临床上,诊断骨量减少、骨质疏松虽常用DEXA、QCT等定量方法测定骨密度(BMD),但其只能显示局部骨质情况,而不能反映正在进行的骨代谢活动,不能全面了解疾病骨代谢变化,常需要联合生化指标进行检测了解骨代谢的状况。本文主要观察外源胰岛素的使用对2型糖尿病患者骨密度与骨代谢指标的影响,以了解胰岛素治疗预防骨质疏松有无帮助。
1 对象与方法
1.1 对象
1.1.1 健康对照组 43例为2006年1月至2010年9月在本地区工作和生活10年以上的健康人群,年龄≥50岁,排除内分泌代谢病 、肝肾疾病 、类风湿病、肠胃切除、严重缺氧、长期卧床、中风以及服用糖皮质激素、性激素、甲状腺激素等影响骨代谢的因素,无脊柱、髋部、腕部骨折,肝肾功能正常。男性21例,平均(62.1±4.2)岁;女性 22例,平均(61.0±6.0)岁。女性绝经3~18年。
1.1.2 T2DM组与胰岛素组 随机选择75例在本地区工作生活10年以上的门诊及住院中老年T2DM病人,其中39例患者使用口服降糖药控制血糖(口服药物组),36例患者采用胰岛素控制血糖3年以上(胰岛素组),年龄均 ≥50岁,按 1999年WHO专家委员会公布的新诊断标准,诊断为T2DM。尿白蛋白<300 mg/24 h。除外其他内分泌疾病、肝肾疾病、风湿病、肠胃切除、严重缺氧、长期卧床、服用糖皮质激素、甲状腺激素及性激素,无脊柱、髋部、腕部骨折,肝、肾功能正常。男性37例,平均(61.0 ±5.0)岁;女性 38 例,平均(60.0 ± 3.0)岁。病程6个月 ~31年,中位数12年。女性绝经2~20年。
1.2 方法
1.2.1 研究方法 记录所有研究对象饮食习惯(牛奶及咖啡饮用量),服药史、运动及日照时间,既往病史,绝经年龄(女性),服药史,测身高、体质量,计算体质量指数(BMI)。(2)均采用西门子螺旋CT及随机专用软件测量腰椎及其松质骨BMD,结果表示为单位体积的骨矿含量(BMD,mg/cm3)。(3)所有入选者空腹抽取肘静脉血两份(抗凝和不抗凝各一份),对照组口服75 g葡萄糖2 h后抽血,T2DM组口服100 g馒头2 h后抽血。静置1 h后常温离心,取血清置于 -30℃冰箱待测。(4)所有研究对象于抽血当日留取清晨第2次尿液于清洁小瓶中,避光保存于-30℃冰箱待测。
1.2.2 实验室检测 用放免法测骨钙素(BGP)、胰岛素和c肽(CP),酶法测量总碱性磷酸酶(ALP),化学法测量血钙(Ca)、磷(P),用氧化酶法测空腹血糖(FPG)和单抗体克隆法测HbAlc,酶法测尿肌酐(Cr)、化学法测定尿Ca,计算 Ca/Cr比值。
1.3 统计学处理 应用 SPSS11.5统计分析软件进行统计,各组数据均符合正态分布,经方差齐性检验显示方差齐。组间均数比较用F检验,率的比较用χ2检验。应用多元相关分析探讨骨密度与患者糖尿病病程、体质量指数(BMI)、血糖、血脂的关系。
2 结果
2.1 各组BMD值比较 与健康对照组相比,胰岛素组和口服药物组男性和女性BMD差异无统计学意义;与口服药物组比较,胰岛素组男性和女性BMD明显增高,男性骨松质与骨密质平均值(149.3 ±36.6)mg/cm3,女性骨松质与骨密质平均值(146.3 ±30.6)mg/cm3,见表 1。
2.2 糖尿病患者BMD有关因素分析 以BMD为因变量,BMI、运动及日照时间、饮食习惯 、绝经年限、糖尿病病程、HbA1c、血脂为自变量进行多因素回归分析,上述因素对BMD的影响均差异无统计学意义(P >0.05)。
2.3 各组空腹血糖、胰岛素、C肽和糖化血红蛋白比较 与对照组比较,口服药物组组和胰岛素组的血糖、糖化血红蛋白和餐后2小时C肽明显增高;胰岛素组的餐后2小时胰岛素水平显著高于口服药物组和健康对照组(P<0.01);口服药物组和胰岛素组的血糖、糖化血红蛋白相比无明显差异,见表2。
2.4 各组骨代谢生化指标 三组血钙、血磷、总碱性磷酸酶和尿钙/肌酐比值的比较无差异,口服药物组和胰岛素组的骨钙素明显高于对照组;胰岛素组骨钙素显著高于口服药物组,见表3。
3 讨论
从发病机制上看,持续高血糖在糖尿病性骨质疏松的发生中占有重要地位[1]。长期高血糖可刺激破骨细胞,并能引起钙磷代谢紊乱,PTH反馈性增加,使溶骨作用增强,增加骨质疏松发生的风险[2]。本研究经相关分析后显示,2型糖尿病患者骨量变化与糖尿病病程、FPG、HbAlc无相关性,这可能与所选择的糖尿病患者基本上是血糖得到良好控制,具有较好医疗条件的中老年患者,从而未显示出血糖与BMD的相关性。另外,也提示通过长期稳定的控制血糖,有助减小高血糖对骨代谢的不良影响,从而有利于防止骨量下降。
在糖尿病引起骨质疏松的发病机制中,胰岛素是一个重要影响因素[3]。成骨细胞表面存在胰岛素受体,胰岛素与其受体结合可促进骨细胞内氨基酸蓄积,刺激骨胶原合成和核苷酸形成,对于维持骨量、防止骨量丢失有重要作用[4]。目前认为胰岛素具有促进骨形成、防止骨丢失作用。2型糖尿病患者胰岛素缺乏,成骨细胞数目减少、活性下降,并抑制成骨细胞合成骨钙素和骨胶原;且破骨细胞活性增加,软骨吸收增加,骨形成减少,影响骨折愈合。本研究中糖尿病组患者均在医生指导下服用降糖药物,与健康对照组比较,骨密度没有变化,而胰岛素组患者骨密度较高,这可能与胰岛素治疗延缓了胰岛功能的衰竭,且外源性胰岛素治疗本身可有利保持一定的血胰岛素浓度,对骨代谢产生保护作用。骨钙素(BGP)是一种由非增殖期成骨细胞合成分泌的非胶原蛋白,主要沉积于骨基质中,其主要生理作用是参与调节骨转换过程,维持骨的矿化速率。胰岛素可以促进1-25双羟维生素D3[1-25(OH)2D3]的合成,而1-25(OH)2D3能促进成骨细胞合成及分泌骨钙素。在我们的结果中,胰岛素组骨钙素明显高于糖尿病组和对照组,提示外源胰岛素对骨形成有一定帮助。
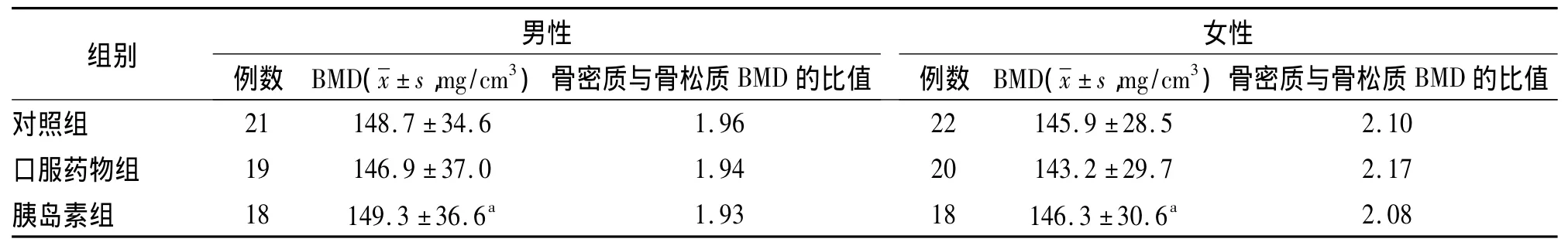
表1 各组骨密度的比较(QCT法)
表2 各组 FPG、Ins、CP水平的比较)
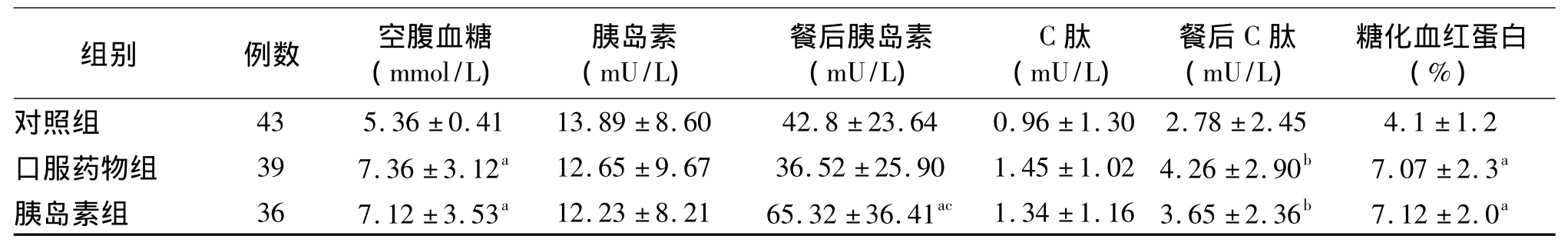
表2 各组 FPG、Ins、CP水平的比较)
注:与对照组比较,a P <0.01,b P <0.05;胰岛素组与口服药物组比较,c P <0.01
对照组 43 5.36 ±0.41 13.89 ±8.60 42.8 ±23.64 0.96 ±1.30 2.78 ±2.45 4.1 ±1.2口服药物组 39 7.36 ±3.12a 12.65 ±9.67 36.52 ±25.90 1.45 ±1.02 4.26 ±2.90b 7.07 ±2.3a胰岛素组 36 7.12 ±3.53a 12.23 ±8.21 65.32 ±36.41ac 1.34 ±1.16 3.65 ±2.36b 7.12 ±2.0a
表3 各组的生化指标的比较()
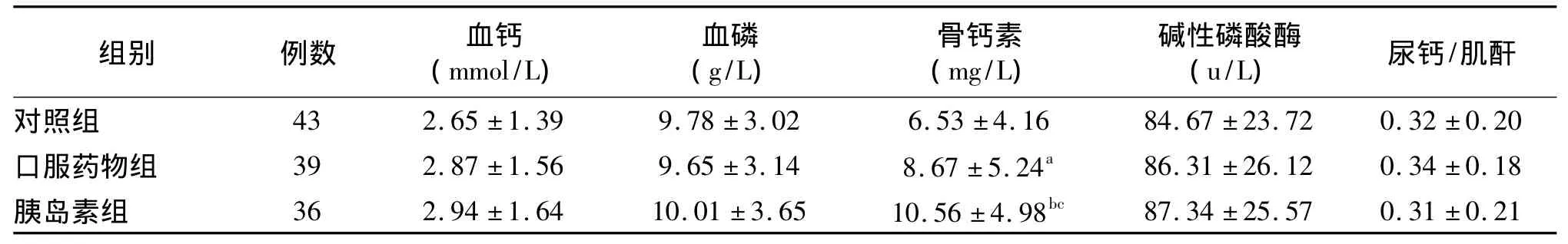
表3 各组的生化指标的比较()
注:与对照组比较,a P <0.05,b P <0.0l;胰岛素组与口服药物组比较,c P <0.05
对照组 43 2.65 ±1.39 9.78 ±3.02 6.53 ±4.16 84.67 ±23.72 0.32 ±0.20口服药物组 39 2.87 ±1.56 9.65 ±3.14 8.67 ±5.24a 86.31 ±26.12 0.34 ±0.18胰岛素组 36 2.94 ±1.64 10.01 ±3.65 10.56 ±4.98bc 87.34 ±25.57 0.31 ±0.21
糖尿病患者血清Ca、P水平一般在正常范围,本研究亦显示糖尿病组与健康对照组相比差异无统计学意义,与文献报道基本一致[5],提示血糖控制良好的T2DM患者与正常人群一样具有较好的钙磷调节功能。另外,也可能在选择糖尿病病例时,排除了有糖尿病肾损害的病人,故未显示出血清钙磷的异常。
总之,2型糖尿病患者骨密度变化的影响因素较多,外源性胰岛素治疗可能对骨密度起到了保护作用,其更多机制有待进一步探索。
[1]Verhaeghe J,van Herck E,Visser WJ,et a1.Bone and mineral metabolism in BB rats with long-term diabetes:decreased bone turnover and osteoporosis[J].Diabetes,1990,39(4):477-482.
[2]Maseitelli L,Pezzetta F.Diabetes and osteoporosis fractures[J].CMAJ,2007,117(11):1391.
[3]Gunczler P,Lanes R,Paoli M,et a1.Decreased bone mineral density and bone formation markers shortly after diagnosis of clinical type 1 diabetes mellitus[J].J Pediatr Endoerinol Metab,2001,14(5):525-528.
[4]Gandhi A,Beam HA,O’Connor JP,et a1.The effects of local insulin delivery on diabetic fracture healing[J].Bone,2005,37(4):482-490.
[5]Follak N,Kloting I,Merk H.Influence of diabetic metabolic state fracture healing in spontaneously diabetic rats[J].Diabetes Metab Res Rev,2005,21(3):288-296.

