主动脉壁内血肿的64-MSCTA诊断及影像特征
王 刚,张 皓,李芸芝,卢星如,辛仲宏
(兰州大学第一医院放射科,甘肃 兰州 730000)
主动脉壁内血肿(AIH)是一种逐渐被大家认知的不典型的主动脉夹层,其特点为没有内膜撕裂口,血肿不与管腔相通;约占主动脉夹层的5%~20%。主动脉壁内血肿近年来发病率呈上升趋势。其临床症状、患者体征及危险程度均与主动脉夹层相似,可自行吸收或发展成为典型主动脉夹层,故早期诊断和及时治疗对其预后有着重要的意义[1-2]。因AIH影像学表现较典型主动脉夹层特殊,笔者收集本院2008年7月~2010年6月间的9例AIH,对其临床及影像学表现进行回顾性分析,以进一步提高对它的认识。
1 材料和方法
1.1 一般资料
对临床怀疑主动脉夹层并行64层螺旋CT血管成像(MSCTA)扫描确诊AIH的9例患者的CT影像及临床资料进行回顾性分析。本组9例主动脉壁内血肿病人均经64层螺旋CT血管造影检查证实,男6例,女3例,年龄55~75岁。主要临床表现为突发性胸背部剧烈疼痛,伴有胸闷、气短等,其中7例有高血压病史,高脂血症5例。
1.2 检查方法
采用Siemens Sensation 64 CT机,18-20G套管针肘前静脉内留置。常规扫描获得定位图像,扫描范围从主动脉弓上至左右髂总动脉分叉以下水平。Bolus Tracking触发扫描,触发平面定于隆突平面升主动脉腔内,触发阈值设定为100HU。高压注射器经肘前静脉注射非离子型造影剂(欧乃派克 350mg/ml或优维显 370mg/ml),60~70ml(根据扫描时间确定),注射流率4.0ml/s,以相同速率跟进40~50ml生理盐水。头-足方向扫描。扫描条件:120kV,150mA,扫描速度0.37秒;重建层厚0.75~1.0mm,重建间隔0.5mm。
图像后处理:原始数据进行0.75~1.0mm薄层重建,横断面图像传入工作站,分别采用多平面重建(MPR),曲面重建(CPR),最大密度投影(MIP)及容积显示(VR)等显示 AIH情况。
参照主动脉夹层Stanford分型,升主动脉受累者为A型,升主动脉不受累为B型。AIH的诊断标准为:主动脉壁呈新月形或同心圆形增厚,且增厚的血管壁≥5mm,增强后其血管壁无强化,无明确的内膜片显示。
2 结果
9例AIH中,A型3例,B型6例。其中仅累及胸主动脉的为2例,累及范围至肾动脉上方为5例,范围至腹主动脉分叉处2例。MSCTA主动脉管腔内均未见内膜片、破口及真、假腔形成。血管腔内明显均匀强化,血肿及其主动脉壁表现为新月形或环形的中、低密度影,内壁常较光整,血肿及其壁的厚度>5mm。血肿最大壁厚约6~20mm。主动脉壁内溃疡4例,表现为主动脉内膜增厚伴不规则尖角样造影剂充盈区。3例见钙化内移征象,钙化位于血肿的内侧缘。胸腔积液7例,左侧胸膜肥厚1例;伴心包积液3例。3例A型AIH分别于MSCT检查后15天~1月后随访复查,2例表现壁内血肿厚度无改变,其中1例示主动脉壁内溃疡封闭;1例48岁患者显示血肿消失。
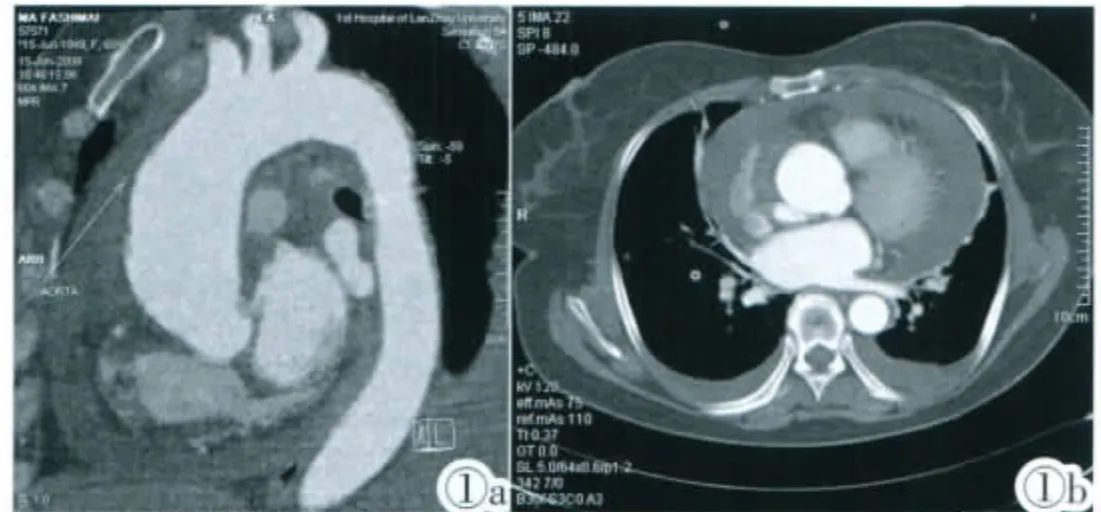
图1 Stanford A型,MPR(图1a)示升主动脉受累,薄层轴位(图1b)示升主动脉壁半月形低密度血肿、血肿侧后壁不规则小溃疡形成、双侧胸腔积液及心包积液。Figure 1. Type A aortic intramural hematoma.MPR image(Figure 1a)shows crescentic wall thickening of ascending aorta.Axial CT image(Figure 1b)shows a focal contrast-material-filled pouch extending outward that communicates with the aortic lumen,pericardial and pleural effusion of both sides.
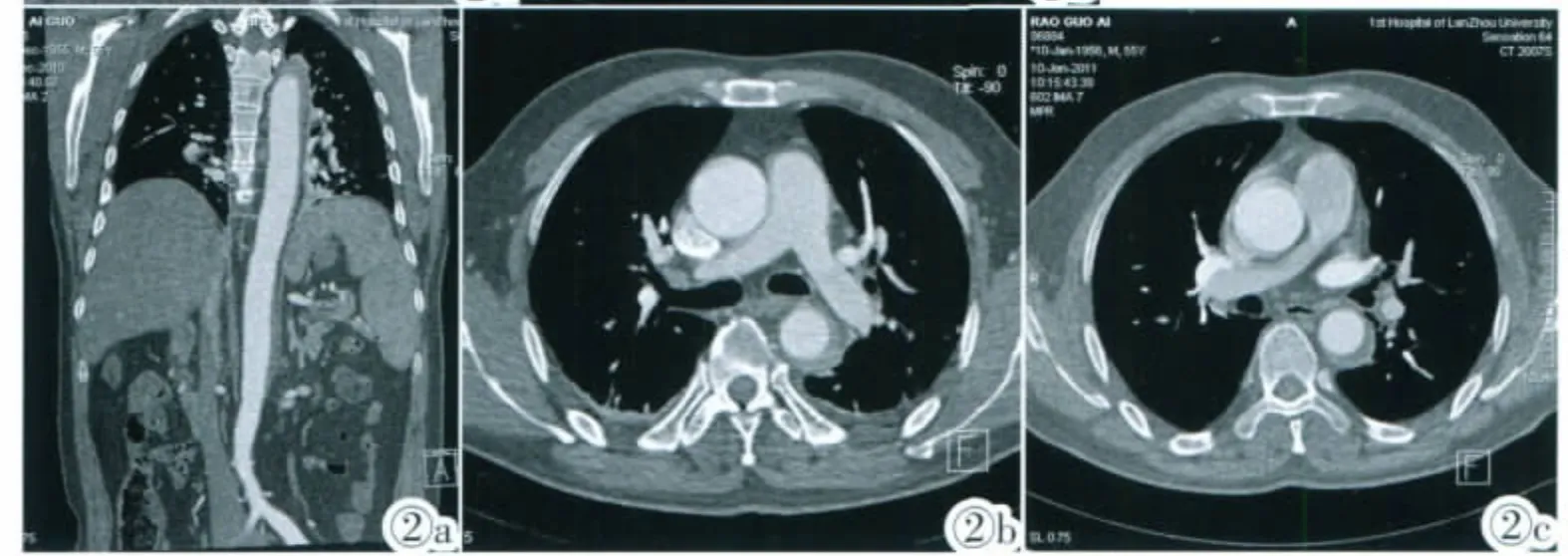
图2 Stanford B 型,MPR(图2a)示胸降主动脉及腹主动脉全程受累,轴位图(图2b)示胸降主动脉壁半月形增厚>5mm, 伴双侧少量积液及胸膜肥厚。复查(图2c)示血肿厚度范围无变化, 胸腔积液及胸膜肥厚消失。Figure 2. Type B aortic intramural hematoma. MPR(Figure 2a) shows resolution of a type B aortic intramural hematoma in the descending thoracic aorta and abdominal aorta. Contrast-enhanced axial CT image (Figure 2b) shows crescentic aortic wall thickening>5mm, with small amount of pleural fluid of both sides. Follow-up transverse CT scan (Figure 2c) obtained one month later shows that the crescentic, hyperattenuating region of thickening wall of the aorta has the same size after conservative management, the pleural effusion has disappeared.
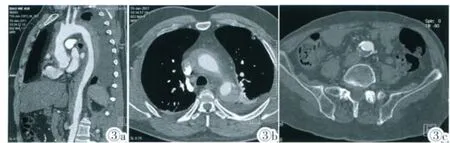
图3 Stanford A 型,MPR(图3a)示升、降主动脉全程受累,薄层轴位图像(图3b)示主动脉壁环壁及新月形低密度血肿、血肿前侧壁充盈之不规则小溃疡形成左侧胸腔积液、右侧胸膜肥厚。图3c 示腹主动脉远段主动脉壁内血肿, 显示内膜瓣钙化、内侧移位。Figure 3. Type A aortic intramural hematoma. MPR (Figure 3a) shows circumferential or crescentic region of aortic wall thickening from the ascending aorta to the descending aorta. Axial image(Figure 3b) shows the intramural fluid collection appears as a nonenhancing, crescentic region of aortic wall thickening that extends around the aortic lumen on with a focal ulcerlike projection. Axial image (Figure 3c) shows
9例患者浏览薄层横断面图像均可明确诊断AIH。MPR和CPR更利于显示AIH细节如测量血肿厚度、显示内膜钙化内移征、壁内溃疡等;适当厚度的MIP亦可清晰显示血肿与管腔;VRT可供诊断AIH的价值有限,仅用于观察血管及分支走行全貌及血管变异等。
3 讨论
AIH指血管壁中层发生血肿的主动脉夹层,主动脉内膜完整、无破裂口及内膜片,血肿腔与主动脉腔无直接血流交通。壁内血肿是主动脉夹层的病理变异类型,与典型的夹层有着不同的发病机制。目前认为形成AIH主要因素为:主动脉中层的滋养血管破裂导致血肿进入外膜;动脉粥样斑块的内膜碎裂和穿透溃疡的邻近出血在动脉壁中层蔓延而形成。据统计,约5%~20%的急性主动脉综合征是主动脉壁间血肿[3],AIH多被认为是典型主动脉夹层的前兆,患者年龄普遍大于典型夹层患者,本组9例发生于55~75岁,平均63岁。高血压及主动脉壁的粥样硬化改变被认为是最主要的易感因素。AIH在高血压患者中可自发发生,文献报道发生部位及动脉粥样硬化斑块溃疡是影响预后的重要因素,AIH患者合并有主动脉粥样硬化的比例高达84%[4],而AIH中伴溃疡灶者发生率约为54%[5],伴有溃疡灶的急性症状住院患者主动脉破裂发生的机会更高,因而预后较典型夹层者更差[6]。在病理上,AIH的主动脉中膜均表现有明显变性,血肿离外膜非常近,因而主动脉壁内血肿比典型的主动脉夹层更容易发生破裂[7]。AIH的临床发展进程可变,可随时间推移血肿减小或完全消失,亦可进展成典型的主动脉夹层、破裂或动脉瘤形成,亦有AIH完全吸收后再发生进展为典型主动脉夹层的报道[8]。
主动脉壁内血肿的主要CT征象为:①病变段主动脉管壁呈新月形或环周增厚,厚度>5mm;主动脉管腔无明显狭窄和扩张改变。本组所有的病例均见主动脉壁增厚,血肿的真假腔不相通,因而可以区别于典型的主动脉夹层。②内膜瓣钙化、并向腔内侧移位;有钙化内移时可明确诊断为AIH,因为钙化多发生在内膜,当血肿将内膜撕开,钙化也随之内移[9];本组3例见此特征性表现。③动脉壁不规则增厚并溃疡形成,呈尖角状龛影样表现、局部向腔外突出;④胸膜增厚、胸腔积液和心包积液;本组全部病例显示该征象;⑤血肿边缘可见环形增强,可能代表外膜感染。
AIH鉴别诊断:①典型主动脉夹层:主动脉夹层多沿主动脉长轴螺旋剥离,可见典型真假两腔显示,假腔内血栓形成时亦可呈低密度改变,但多伴有管腔扩张;主动脉AIH患者的年龄多数>60岁,高于典型的主动脉夹层患者[10];壁内血肿大多较均匀环绕主动脉,管腔无明显狭窄及扩张,无撕裂的内膜口及壁内血肿与真腔无交通是两者鉴别的主要点。②大动脉炎:多见于青年女性,主要表现为胸腹主动脉环周性管壁增厚,常为节段性,病变段间隔以正常的主动脉壁,受累主动脉及大分支血管狭窄变细甚至闭塞,受累中膜或全层钙化。AIH无此种表现。③主动脉瘤伴附壁血栓形成:病变段局限或节段性,主动脉腔瘤样扩张,可见新月形或不规则环形低密度血栓,而AIH范围多数较大,很少伴主动脉管腔扩张。④动脉粥样硬化:主要累及胸腹主动脉,主动脉壁常不规则,多发局限性内膜增厚、非钙化及钙化性斑块形成,但无钙化内膜明显内移及胸膜腔、心包积液等。
AIH因其临床症状、危险程度及预后均与主动脉夹层相似,已越来越被临床所重视,早期的诊断对并发症的处理及早期的治疗、改善预后有重要作用。64MSCTA是一种快速有效的检查方法,大范围的快速、薄层扫描,大大提高了图像质量,减少了运动伪影所致图像模糊,病变细节显示更清晰,快速、高效的诊断效能使其更适用于急诊患者的筛查。MSCTA薄层轴位及其MRP、CPR、MIP重建图像能清晰直观地显示AIH直接征象、间接征象及并发症,明确病变的部位及范围,主动脉分支动脉受累情况,MPR结合轴位图像可对主动脉管壁增厚程度进行准确的测量,从而更有利于对AIH主动脉形态变化的随访观察。MSCT图像质量及检查的安全性、有效性都得到最大程度的保障,笔者认为直接行CTA检查即可对主动脉壁内血肿进行明确诊断及鉴别诊断。
[1]张自力,邹文远.多层螺旋CT对主动脉壁内血肿的诊断价值[J].医学影像学杂志,2008,18(8):978-1000.
[2]赵绍宏,蔡祖龙,刘新,等.主动脉壁内血肿的多层面螺旋CT诊断[J]. 中国医学影像学杂志,2005,13(6):514-516.
[3]Maraj R,Rerkpattanapipat P,Jacobs LE,et al.Meta-analysis of 143 reported cases of aortic intramuralhematoma[J].Am J Cardiol,2000,86(6):664-668.
[4]Sundt TM.Intramural hematoma and penetrating atherosclerotic ulcer of the aorta[J].Ann Thorac Surg,2007,83:835-841.
[5]Evangelista A,DominguezR,Sebastia C,etal.Long-term follow-up of aortic intramural hematoma:predictors of outcome[J].Circulation,2003,108:583-589.
[6]Coady MA,Rizzo JA,Hammond GL,et al.Penetrating ulcer of the thoracic aorta:what is it?How do we recognize it?How do we manage it?[J].J Vasc Surg,1998,27:1006-1015.
[7]Coady MA,Rizzo JA,Hammond GL,etal.Whatisthe appropriate size criterion for resection of thoracic aortic aneurysm[J].Thorac Cardiovasc Surg,1997,113(3):476.
[8]Baek WK,Yoon YH,Kim JT,et al.Recurrent type B intramural hematoma progressed into type A acute aortic dissection in a young otherwise healthy woman:are there unknown background factors[J].Interact Cardiovasc Thorac Surg,2007,6(2):255.
[9]Song JK,Kim HS,Song JM,et al.Outcomes of medically treated patients with aortic intramural hematoma[J].Am J Med,2002,113:181-187.
[10]Goarin JP,Cluzel P,Gosgnach M,et al.Evaluation of transesophageal echocardiography for diagnosis of traumatic aortic injury[J].Anesthesiology,2000,93:1373-1377.

