DC联合CIK免疫治疗术后晚期恶性肿瘤84例疗效观察
林 林,谢绍建,宋婷婷,马云鹏,问 明,徐伟利
(河北医科大学第二医院,石家庄050010)
肿瘤的特异性主动免疫治疗作为恶性肿瘤患者治疗的一种辅助疗法,可达到增加患者机体免疫力,清除瘤细胞的目的[1]。树突状细胞(DC)是人体内功能最强且是惟一能递呈蛋白质抗原并致敏初始T细胞的抗原递呈细胞,以DC为基础的肿瘤细胞瘤苗可以有效增强诱导机体特异性抗肿瘤免疫反应,被认为是目前最有潜能的肿瘤免疫治疗手段。细胞因子诱导杀伤细胞(CIK)是具有与细胞毒T淋巴细胞相似的杀肿瘤细胞活性,且不受机体主要组织相容抗原(MHC)限制,可以非特异性识别靶细胞,杀伤所有肿瘤细胞。2008年6月~2010年12月,我们采用DC联合CIK治疗术后晚期恶性肿瘤患者84例,效果较满意。现报告如下。
1 资料与方法
1.1 临床资料 84例均为我院住院手术治疗后的晚期(Ⅲ或Ⅳ期)恶性实体瘤患者,均经病理检查确诊。男49例、女35例,年龄18~80岁、中位年龄59岁。其中胃癌24例,肺癌23例,结肠癌18例,黑色素瘤3例,直肠癌4例,阑尾腺癌1例,卵巢癌2例,乳腺癌4例,肝癌5例。卡氏行为状态评分(KPS)≥60分,血、生化检查正常,预计存活时间超过3个月。84例均经过手术或放化疗治疗,从未接受过免疫治疗,且拒绝继续进行以往治疗而自愿接受免疫治疗者。
1.2 抗原提取及DC、CIK培养方法 ①主要试剂:Ficoll淋巴分离液,IL-4、IL-2,鼠抗人 CD3、CD4、CD8、CD56,肿瘤坏死因子(TNF-α),IFN-γ。粒—巨噬细胞集落刺激因子(GM-CSF)。RPMI1640和无血清培养基。②抗原提取:将患者手术切除的肿瘤组织粉碎后离心(600 r/min)30 min,取上清液作为致敏DC的肿瘤抗原。③DC的培养:取患者外周血,采用聚蔗糖—泛影葡胺分离液分离其外周血单核细胞,采用人单核细胞富集试剂盒筛选CD14+单核细胞,贴壁2 h,轻摇培养瓶,吸出上清及非贴壁细胞(用于培养CIK)。贴壁细胞加入10%胎牛血清、GM-CSF、IL-4等的完全培养基,培养DC,5 d后半量换液并加入肿瘤抗原(40 μg/ml),3 d后再次补充GM-CSF和 IL-4,培养7 d(为致敏DC)。④CIK的培养:收集并离心、洗涤非贴壁细胞、重悬,使细胞密度为 1 ×106/ml,转入含 IFN-γ(1 000 U/ml)的细胞培养袋中培养,置5%CO2培养箱中37℃、培养24 h,加入CD3(100 ng/ml)和IL-2(1 000 U/ml)。每3 d计数,培养基中补充IL-2,1周后,在培养的CIK内,按DC∶CIK为1∶10的比例加入致敏DC,共培养3~5 d,制成DC-CIK。⑤细胞表型测定:分别收集培养第1、7天的DC和第1、12天的CIK,PBS洗涤2次,DC中加入FITC标记的鼠抗人CD14、CD83、CD86单抗及PE标记鼠抗人HLA-DR单抗;CIK中加入FITC标记的鼠抗人CD3、CD4单抗及PE标记鼠抗人CD8、CD56单抗。在室温下孵育20 min,PBS洗涤2次,流式细胞术分析培养前后DC、CIK表型变化,证实为成熟的DC、CIK。
1.3 治疗方法 此免疫治疗与手术及放化疗间隔至少1个月。取DC-CIK离心(600 r/min)10 min,PBS洗涤2次,溶于100 ml生理盐水中,调整细胞密度>1010/ml,于3 h内静脉回输患者体内,2次/d、连续3 d;另将DC溶于生理盐水中,调整细胞密度为106/ml,分别于第1、7、14天皮下注射;14 d为1个疗程,间隔3个月予以第2个疗程,再间隔6个月给予第3个疗程,3个疗程后评价疗效。
1.4 观察指标 ①疗效评价:根据WHO制订的实体瘤近期疗效标准评价疗效[1],分为 CR、PR、SD和PD,计算疾病控制率(DCR)[2],对于CR或PR的患者,于4周后复评。②KPS。③不良反应:按WHO抗癌药物常见毒性反应分级标准[3]分为0~Ⅳ度。④肿瘤标志物检测:检测患者血清中甲胎球蛋白(AFP)、癌胚抗原(CEA)及糖链抗原(CA)125、CA199。
1.5 统计学方法 采用SPSS12.0软件,数据分析用两样本均数比较的t检验。α=0.05。
2 结果
84例中,CR 1例,PR 27例,SD 43例,PD 13例,DCR为84.5%。KPS较治疗前评分提高20分者50 例(59.5%)。发生低热23 例(27.4%),对症处理后缓解,未发生其他不良反应。本组治疗前后血清 AFP、CEA、CA125、CA199 水平比较见表1。
表1 84例治疗前后血清AFP、CEA、CA125、CA199 水平比较(±s)
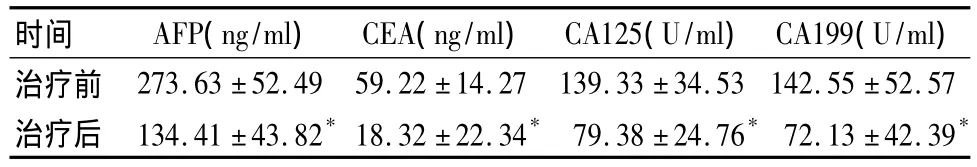
表1 84例治疗前后血清AFP、CEA、CA125、CA199 水平比较(±s)
注:与治疗前比较,*P <0.05
时间 AFP(ng/ml) CEA(ng/ml) CA125(U/ml)CA199(U/ml)治疗前 273.63 ±52.49 59.22 ±14.27 139.33 ±34.53 142.55 ±52.57治疗后 134.41 ±43.82*18.32 ±22.34* 79.38 ±24.76*72.13 ±42.39*
3 讨论
研究发现,恶性肿瘤的发生发展与肿瘤细胞缺乏能致敏T细胞的抗原有关[4],因为T细胞不能识别肿瘤细胞,导致T细胞介导的主动细胞免疫无法启动。近10 a来,以CIK和DC为基础的肿瘤免疫治疗越来越受到人们重视[5]。杀伤细胞(LAK)等治疗取得一定的疗效,但因体外培养增殖细胞数少、对肿瘤细胞杀伤活性低、患者不良反应严重等,其治疗价值受到质疑。
DC是体内专职抗原递呈且功能最强的细胞[6],能有效激活初始T细胞、活跃地摄取一系列不同的抗原物质,并进行加工和装载到MHCⅠ、Ⅱ类分子上,能有效刺激初始T细胞转变为具有肿瘤抗原特异性细胞毒T细胞(CTL)。CIK是一种异质细胞群,CD3+CD56+T细胞是该细胞群中主要效应细胞,因此CIK同时具有T细胞和NK细胞的标志。研究证明[7],CIK具有类似T淋巴细胞的强大抗肿瘤活性;不受MHC限制,杀伤各种肿瘤细胞;体外培养增殖速度快。
CIK对肿瘤细胞的杀伤,需要DC的指导。后者能识别处理肿瘤细胞,并将其相关信号传递给CIK,使CIK对肿瘤细胞的特异杀伤活性大大增加[8]。其机制可能为:①成熟的DC通过其表面树突将肿瘤抗原呈递给CIK;②致敏DC可分泌大量细胞因子如IL-12、IL-18、IFN-γ等,这些因子可以刺激Th0、Th2细胞这向 Th1细胞分化,发生特异性Th1型免疫应答;③DC可经MHCⅡ类分子途径,呈递给CD8外源性肿瘤抗原,并提供共刺激信号[9]。
肿瘤患者因受疾病和手术、放化疗的影响,体内DC识别处理肿瘤细胞的功能受到很大影响[10]。为了恢复和提高DC功能,指导CIK精确杀伤肿瘤细胞,需要体外培养DC-CIK。
本研究结果显示,治疗后84例DCR为84.5%,71例病情未继续进展;KPS较治疗前评分提高超过20分者占59.5%,血清肿瘤标志物水平均明显降低,不良反应轻微。我们认为,对于无法耐受放化疗的术后晚期实体瘤患者,宜选择DC联合CIK免疫治疗。
[1]刘宝瑞,刘文超.现代肿瘤化疗手册[M].西安:世界图书出版西安公司,2000:8-14.
[2]杨涛,邵江河,李启英.树突状细胞联合CIK细胞应用于恶性实体瘤治疗的临床疗效观察[J].肿瘤,2010,30(8):700-705.
[3]吕进,草秀峰,朱斌.放射性125I粒子治疗食管鳞癌的安全性及疗效[J].世界华人消化杂志,2010,18(29):3065-3067.
[4]詹俊,孙小娟,李楚强.S100和CD83阳性树突状细胞与大肠肿瘤微环境的关系[J].世界华人消化杂志,2009,17(29):3061-3065.
[5]吴昌平.肿瘤生物治疗[J].常州实用医学,2009,25(3):210-211.
[6]Park HY,Jin JO,Song MG,et al.Expression of dentritic cell markers on cultured neutrophils and its modulation by antiapoptotic and pro-apoptotic compounds[J].Exp Mol Med,2007,31(4):439-449.
[7]Sangiolo D,Mesiano G,Carnevale-Schianca F,et al.Cytokine induced killer cells as adoptive immunotherapy strategy to augment grvenus tumor after hematopoietie cell transplantation[J].Expert Opin Biol Ther,2009,9(7):831-840.
[8]张志伟宋鑫.DC-CIK细胞临床制备规范化研究[J].中国肿瘤,2011,25(2):85-86.
[9]窦春鹏.树突状细胞联合细胞因子诱导的杀伤细胞抗肿瘤研究进展[J].国际肿瘤学杂志,2010,37(08):573-575.
[10]钟国成,张小玉,孙薏.抗原致敏DC联合CIK在原发性肝癌治疗中的应用[J].中国肿瘤临床,2009,36(24):1404-1408.

