盆栽芍药泥炭替代型有机栽培基质研究
陆光沛, 于晓南,2,*
(1北京林业大学园林学院, 北京 100083;2 国家花卉工程技术中心,北京 100083)
芍药(Paeonia lactiflora)与牡丹并称“花中二绝”,是中国传统名花, 也是世界重要新切花,市场应用前景广阔。目前,中国观赏芍药仍以大田栽培为主[1],其生产受气候因素影响大,因此,很难保证花卉的产量和品质。无土栽培是与设施园艺生产相配套的重要栽培方式,正逐渐成为世界花卉生产的主流模式之一。近年来,在芍药无土栽培生产方面,以色列、新西兰、美国等国已开展一些研究,但其栽培基质均以泥炭为主[2-4]。虽然泥炭以其优越的理化性质一直是世界园艺界公认的最优基质之一,但其在短期内不可再生的特点,使之正逐渐成为一种稀缺资源;加之泥炭的过度采挖,对泥炭地独特的湿地环境也是一种巨大的破坏,因而保护泥炭地,开发泥炭替代型栽培基质,对于环境安全、可持续发展具有重要意义[5]。笔者以菇渣、玉米芯这两种农业废弃物作为无土栽培基质组分,研究用其部分或全部替代泥炭进行芍药盆栽的可行性,以期减少或杜绝盆栽芍药生产中泥炭的使用,为芍药的无土栽培提供新思路。
1 材料与方法
1.1 材 料
供试材料为三年生大富贵芍药盆栽苗。
采用混合型栽培基质,以实现多组分间的取长补短,满足植物的生长需求。基质原材料为经过发酵消毒的菇渣(主成分为棉籽壳)、玉米芯颗粒(直径1 cm)、泥炭、珍珠岩、陶粒(直径1~2 cm)。共设7个处理,其中T1,T2,T3加入部分泥炭,称为“I部分替代组”;T4,T5,T6,T7不含泥炭,完全以代用基质按不同比例混合,称为“Ⅱ完全替代组”。
I部分替代组3个配方的设计依据:T1为初始配方,与对照相比,泥炭用量减少20%,为体现本试验的主要目标,T1以上不再单设泥炭用量减少10%的处理;为进一步减少泥炭用量并兼顾植物适应性,以10%为梯度与T1拉开差距,设置泥炭用量减少30%的T2;为探求泥炭的最低用量,进一步加大与T2的梯度差,设置泥炭用量仅为10%的T3。
上述原材料按表1所示配方,混合均匀,所有比例均为体积比。对照组基质参考北京林业大学鹫峰牡丹研究基地沿用多年的盆栽芍药基质配方(泥炭含量60%)。
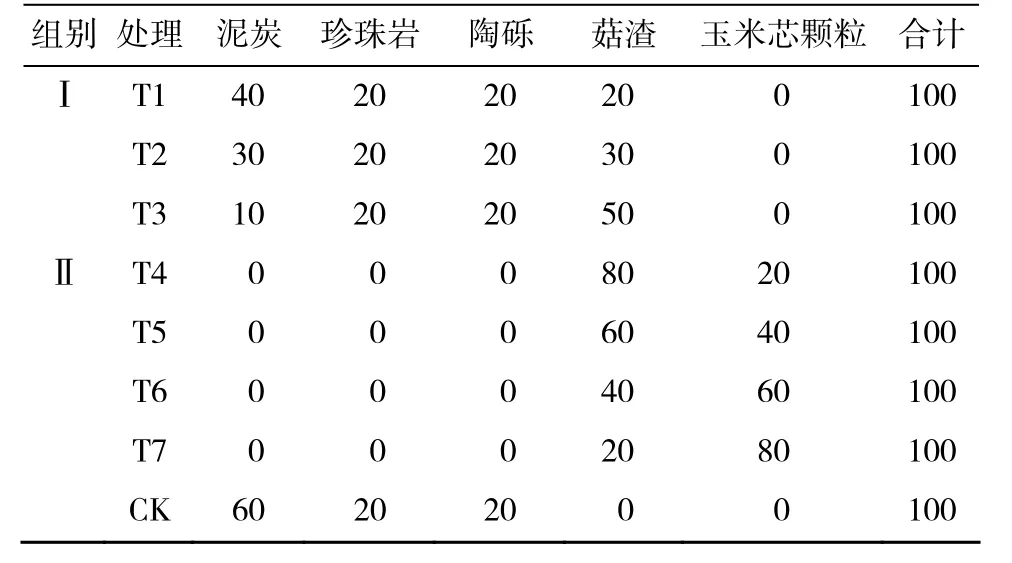
表1 芍药泥炭替代型有机栽培基质各处理的组分配比(%)Table 1 Components mixture ratio of herb peony organic substitute for growing media
1.2 方 法
1.2.1 基质理化性质测试
本试验于2008年9月至2009年9月在北京林业大学鹫峰林场进行。分别于植物刚上盆时与植物开花过后2个时间段,测试栽培基质的基本理化性质,包括干、湿容重、总孔隙度、管孔隙度(即持水孔隙度)、非毛管孔隙度(即通气孔隙度)、气水比、pH值、EC值。每个处理3个重复。测试方法参考并改进荆延德[6]的测试法。
1.2.2 基质氮磷钾含量测试
氮采用凯氏定氮法测定;磷采用 HClO4-H2SO4消化钼蓝比色法测定;钾采用火焰光度计法测定(中国科学院南京土壤研究所,1980)。测试时间及重复次数同1.2.1。
1.2.3 栽培试验
余琳[7]选取精细胶粉与PP/EPDM型聚烯烃类热塑性硫化胶(TPV)通过直接混炼法制备性能保持良好的胶粉/TPV共混材料,同时采用添加增容剂、活化剂与增容剂并用两种方法,进一步改进共混体系的两相界面相容性,提高了共混材料的综合性能。
于2008年秋季上盆,从2009年春开始,按萌动、萌发、抽茎、展叶、显蕾、透色、开花七个物候期进行观测[7];按株高、冠幅、蕾径、花径、开花时间、单株成花量6个性状记录植株生物量,并计算每处理的整体成花率。每个处理3次重复,每重复10盆。
测量花后每处理盆栽芍药的根系情况,选择正常开花的植株,从肉质根上一级侧根的发根处剪取生长健康、有代表性的完整根系。按7项指标(根系鲜重、一级侧根长度、一级侧根直径、二级侧根数量、二级侧根长度、三级侧根数量)记录根系生物量。每株10条根,每个处理3株。
结合浇水同时施营养液,配方参考霍格兰德(Hoagland)配方并稍加改进。
所有数据以Excel进行录入,采用SPSS16.0进行方差分析和LSDα=0.05的差异显著性检验。
2 结果与分析
2.1 栽培基质的基本理化性质
表2为2008年秋季芍药种苗刚上盆时和2009年春季芍药开花后,各处理组基质的基本理化性质。通过对比,可以分析出上盆时与开花后栽培基质基本理化性质的变化,为后文分析植株、根系生长状况在处理间的差异提供参考。

表2 盆栽芍药上盆时和开花后各处理基质的理化性质Table 2 The initial physicochemical property of growing media for each treatment of potted peonies
基质选用标准中,“质轻、性良、安全”的实用性非常重要[8]。从表 2可以看出,有泥炭参与的部分替代组基质(T1,T2,T3),其干容重普遍大于没有泥炭参与的完全替代组基质(T4,T5,T6,T7)的干容重。这是因为完全替代组基质普遍具有较高的总孔隙度,在风干状态下,其轻质性好于部分替代组。就湿容重而言,完全替代组基质则普遍大于部分替代组。这是因为完全替代组基质普遍具有较高的毛管孔隙度,能吸纳更多的水分。对比表3不难发现,经过半年多的栽培使用,各处理组基质的干湿容重均有所上升。这主要是因为随着浇水,基质被不断沉淀压实,于是单位体积内的基质质量有所增加。
泥炭替代型基质的总孔隙度整体偏大。从表 2可以看出,经过半年多的栽培使用,代用型基质的总孔隙度还有进一步增大的趋势。这主要是由于代用基质中的纤维素成分仍在不断分解,尤其是有玉米芯颗粒参与的完全替代组,总孔隙度增幅明显。因为玉米芯为花序轴,主要由薄壁细胞构成,纤维素含量较低,长时间使用,纤维素分解较快。
2.2 栽培基质的营养元素分析
本试验测试了芍药上盆时与开花后,栽培基质中氮、磷、钾3种大量营养元素的全态含量,结果见表3。从表3可以看出,部分替代组I(T1,T2,T3)的氮、磷含量,在刚上盆时,明显小于完全替代组 II(T4,T5,T6,T7)的氮、磷含量。主要原因是玉米芯的磷含量较高。

表3 芍药上盆时与开花后各处理基质的N,P,K含量 (g/kg)Table 3 Initial and final content of N, P, K in different media of potted peonies
随着浇施营养液,氮、磷含量在部分替代组与完全替代组之间,产生了相反的变化:氮、磷含量在部分替代组内有小幅增加,但在完全替代组内出现了大幅减少。其原因在于:泥炭多孔隙的特殊结构对营养元素的吸附作用较强[9]。参考对照组基质氮、磷、钾含量的变化不难发现,3种元素含量均有不同幅度的上升,其中,氮元素从刚上盆时的6.19 g/kg上升到了花后的9.50 g/kg,增长了3.31 g/kg,涨幅明显,说明了泥炭具有较强的养分蓄积能力。
除T7外,部分替代组的3个处理和完全替代组的3个处理(刚上盆时)钾含量都高于对照组基质,但是,从刚上盆时到开花后,所有(完全)代用型基质的含量均出现了不同程度的下降。在栽培中,菇渣仍进行着缓慢的发酵分解,加上浇营养液时的淋溶作用,使钾元素含量迅速减少。
2.3 栽培基质对盆栽芍药生长及成花质量的影响
比较不同处理组植株的各项生物量,是泥炭替代型基质筛选的重要依据。表4显示,部分替代组I的枝叶生长量,在3个处理间变化幅度不大。T1株高最高,达到30.9 cm,与对照的株高差异不显著;T2与T3株高相等,都比T1低2.6 cm。T2的冠幅最大,达到33.9 cm,是所有处理组当中冠幅最大的,T1的冠幅略低于T2,但T1,T2,对照组(CK)的差异均不显著。总之,部分替代组植株的叶幕整体较丰满。
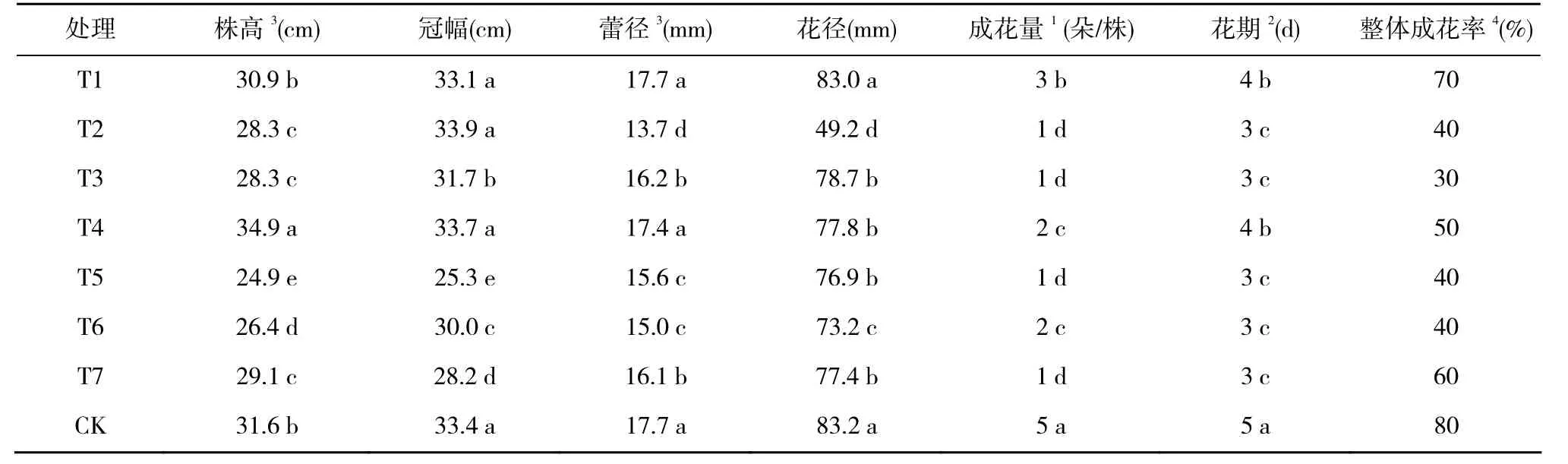
表4 盆栽芍药各基质处理的植株花期生物量Table 4 Florescence biomass of plants in different media of potted peonies
完全替代组Ⅱ的枝叶生长量,在 4个处理间出现了强烈的分化:T4株高达34.9 cm,最高;T5最矮,株高只有24.9 cm,与T4相差10 cm之多。另外2个处理组株高也在30 cm以下。值得注意是,T4的冠幅达到了33.7 cm,即T4的株高和冠幅,都超越了对照和部分替代组,具有最高的枝叶生长量。
部分替代组I中的T1蕾径最大,为17.7 mm;完全替代组II中的T4蕾径为17.4 mm,T1和T4与对照相比差异均不显著。T1从显蕾期到透色期,蕾径持续增长;T4进入透色期,蕾径增速明显减缓;此外,其他几个处理的花蕾,在进入透色期之后,均出现了蕾径增速减缓或蕾径停止增长的现象,分析这种现象出现的原因可能在于基质给养不足。
成花效果是反映栽培质量的重要指标,可由花径、单株成花量、花期、整体成花率4项指标反应。T1花径为83.0 mm,与对照83.2 mm相比,差异不显著;T2的花径最小,只有49.2 mm;其他几个泥炭替代型基质组的花径都在70~80 mm。
2.4 栽培基质对盆栽芍药根系的影响
各栽培基质处理下,盆栽芍药的根系生长情况见表 5。根系的长度、直径共同反应了侧根的生长势,健康的侧根应当是在长度、直径双方面都取得较高的数值。表5中, T1的1级侧根,长124.87 mm,与对照相比差异不显著;粗1.79 mm,是所有替代型基质1级侧根中最粗的。
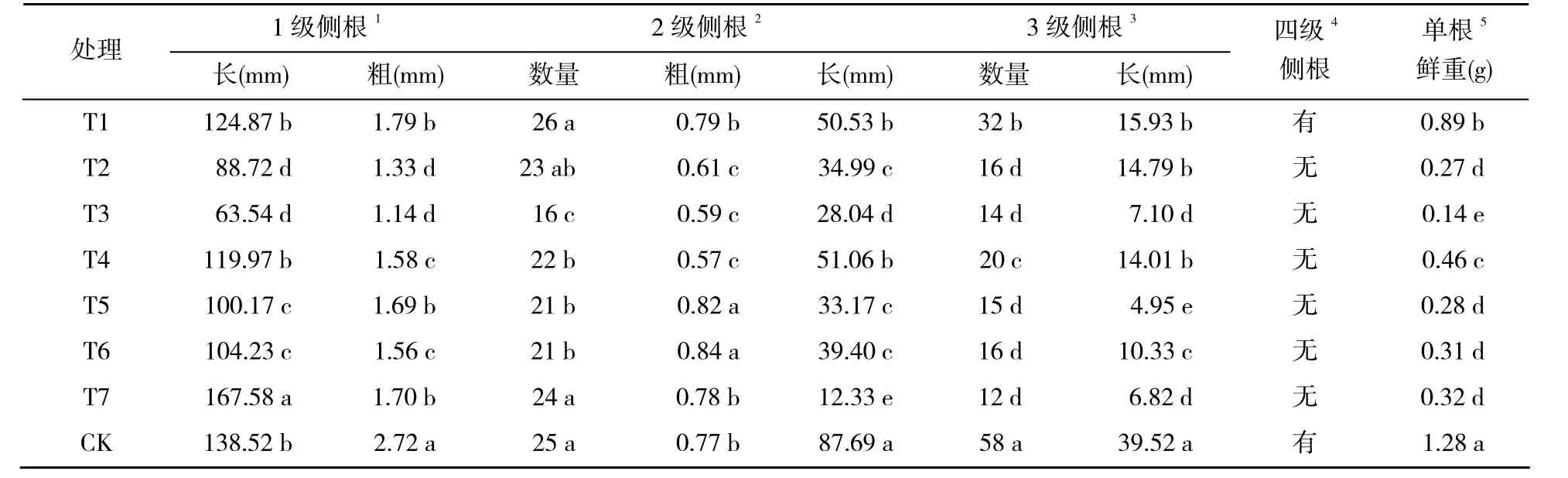
表5 各基质处理组中芍药根系的生物量Table 5 Root biomass of plants in different media of potted peonies
1级侧根从芍药的肉质根上生长而出,不具有养分吸收能力,是以输导营养为主的输导根,1级侧根上会生出2级侧根,2级侧根上会生出3级侧根,因此,高级别侧根的生长势很大程度上决定了低级别侧根的生长势。如T1的2级、3级侧根的数量、长度、直径(粗),在所有替代型基质的2级、3级侧根中也基本都处于前列。
在基质给养不充分或气水比失调的情况下,侧根可能会偏重增长或偏重加粗。如T7的2级侧根、T4的2级侧根,都出现了此类现象。
3 结论与讨论
栽培品质是衡量栽培基质优劣的主要标准。栽培品质,最重要的在于枝叶生长状况和成花效果。通过观察,所有泥炭替代型基质栽培的植株,均可成活,但成花效果在处理组间存在明显差异。
部分替代组I中,T1基质栽培的植株,在枝叶生长状况和成花效果两方面,都取得了较好表现,且 T1的根系生物量与对照最接近。完全替代组Ⅱ中,T4基质栽培的植株,枝叶生长状况较好,但成花效果较差。其主要原因可能在于花期养分供应不足。综合比较,在今后的芍药盆栽生产中,首推T1基质配方:40%泥炭+20%菇渣+20%陶粒+20%珍珠岩。国外学者在研究泥炭有机代用型基质时也有类似实例:将菇渣与泥炭、树皮等混合后栽培观赏灌木,亦取得了很好的效果[10]。除了菇渣可作为泥炭代用型基质,花生壳粉作为泥炭代用型基质栽培一品红、仙客来也取得很好的效果[11,12]。今后亦可尝试将花生壳粉应用于芍药盆栽。
相关研究表明,泥炭中含有丰富的腐植酸。这是泥炭优于腐叶土、树皮、蛭石、珍珠岩等其他常用无土栽培基质的重要特点[13]。本试验中并未化验各组基质腐植酸的含量,但值得注意的是,部分替代组Ⅰ的T3基质虽有10%的泥炭参与,其根系各项生物量却不如没有泥炭参与的完全替代组Ⅱ。国外学者的相关试验已证实,有机化合物残体(试材以甲苯为例)经微生物 Pseudomonas fluorescens(荧光假单孢菌)的降解,能从中抽提出一定含量的腐植酸[14]。国内也有应用作物秸秆生产复合腐植酸的专利[15]。可见,农林有机废弃物经过发酵处理,也能产生一定含量的腐植酸,这为农林废弃物作为泥炭有机代用型栽培基质应用于芍药盆栽提供了有利支持。
根据试验结果,本研究总结出一套适宜芍药根系生长的盆栽基质物理环境特征:总孔隙度为64%~76%;非毛管孔隙度为9%~10%;毛管孔隙度为54%~64%;气水比为0.17~0.22。各项孔隙度及气水比均不宜过高。经济性是基质筛选的另一原则。根据上述物理环境特征,有利于各地因地制宜地选用盆栽芍药泥炭代用型基质的原材料。
值得一提的是,在保证栽培品质不降低的前提下,本试验初创性地尝试了以农林废弃物替代泥炭应用于芍药盆栽,尤其是综合考虑到泥炭的不可再生性和湿地资源的保护等因素,在一定程度上降低了泥炭的使用,其环保意义和经济价值均对生产实践具有一定的指导意义。后续的研究还有待在泥炭替代型基质配方上不断改进,以期实现环境效益与栽培效果双赢的目标。
[1]Qin KJ. Herbaceous Peony[M]. Beijing: China Forestry Publishing House, 2004. (in Chinese)
[2]Page M. The Gardener’s Peony, Herbaceous and Tree Peonies[M]. Portland, Oregon: Timber Press, 2005.
[3]Hall AJ,Catley JL, Walton EF. The effect of forcing temperature on peony shoot and flower development [J]. Sci Hort,2007,113:188-195.
[4]Kamenetsky R, Barzilay A, Erez A, et al. Temperature requirements for floral development of herbaceous peony cv.‘Sarah Bernhardt’[J]. Sci Hort, 2003, 97: 309-320.
[5]Liu Q-C. Studies on organic substitute for growing media of three kinds of important pot flower [D]. Beijing: Beijing Forestry University, 2006.(in Chinese)
[6]Jing YD, Zhang ZG. “A coordinated process”physicochemical property determination method for growing media [J]. Northern Horticulture, 2002(3): 18-19.(in Chinese)
[7]Cheng FY, Gao SP, Yu XN. Stage identification and morphological types of bud maturity or flowering in paeonia lactiflora cultivars[J]. Acta Horticulturae Sinica, 2009,36(4): 611-613.(in Chinese)
[8]Wang H F. Flowers and Plants Soilless Culture[M].Beijing:Goldshieid Publishing House, 1997.
[9]Ma TH . Soilless Culture [M]. Beijing: Beijing Publishing House, 1980.
[10]Chong C,Cline RA,Rinker DL. Bark- and peat- amended spent mushroom compost for containerized culture of shrubs [J]. Hort Science, 1994, 29(7): 781-784.
[11]Sun XL , Zhang QX . Studies on bark and the powder of peanut hulls for growing media of euphorbia pulcherrima[J].Journal of Northwest Forestry University, 2008, 23(6):108-113. (in Chinese)
[12]Zhang QX, Pan HT, Liu QC, et al. Patent of invention(number of the patent: CN200710064037.0): A growing media for cyclamen with the component of peanut shell[D].Beijing: Beijing Forestry University, 2007.(in Chinese)
[13]Baran A. Characterization of carex peat using extinction values of humic acids[J]. Bioresource Technology, 2002,85(1): 99-101.
[14]Sivagurunathan M,Antonio M,Robert J. Helleur biological waste-treatment of hydrocarbon residues: Effects of humic acids on the degradation of toluene [J]. Applied Energy,2003,75(3/4):267-273.
[15]Hao SZ, Zuo ZJ. Patent of invention (number of the patent:200710061737): A preparation method of compound humid acid, a kind of plant growth regulator, with the application of plant straw [J]. Hebei Provenience, 2007.(in Chinese)

