欧美山杨杂种嫩枝微扦插生根相关氧化酶活性变化及繁殖技术1)
闫绍鹏 武晓东 王秋玉 宋兴舜 杨瑞华
(东北林业大学,哈尔滨,150040) (黑龙江省农业科学院园艺分院)
欧美山杨杂种(Populus tremula×P.tremuloides)是欧洲山杨和北美山杨的杂交种,具有生长快、耐寒、耐贫瘠、树形高大、适应性强等特点,是北方山地造林的优良树种。另外,该树种材质较软、细密,洁白,树干端直,是造纸、胶合板、刨花板等工业的优质原料[1],目前作为优良用材树种被许多国家广泛引进。由于欧美山杨是杂交种,为了保持其较高的杂种优势,只能采用组培等方法进行微体繁殖[2-4],几年的研究表明,杂种无性系的组培繁殖成本很高,繁殖系数低,大大阻碍了欧美山杨杂种大规模的商业化生产[5]。因此,对欧美山杨杂种扦插繁殖研究就显得极为重要。为了提高植物扦插成活率,人们对扦插生根机理进行了广泛的研究。研究结果表明,过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)与植物不定根的发生和发展有着密切的关系。在不定根形成期间,POD和 IAAO活性都呈现一定的变化规律[6-7]。POD的活性与IAAO的分解代谢以及不定根的形成有非常密切的关系[8]。PPO的活性对不定根的形成是十分重要的,“生长素—酚”的缩合物(生根素)是在PPO、POD以及一些其他酶的作用下形成的[9-10]。IAAO 能降解 IAA,调节植物体内的IAA水平,从而影响植物的生长发育。可见,不定根的起源和生长与这3种氧化酶的活性变化有着密切关系。为此,笔者研究了欧美山杨杂种扦插生根过程中这3种酶的活性变化,以及外源激素处理对扦插生根及其POD、PPO、IAAO活性变化的影响,以揭示欧美山杨杂种扦插生根的机理。
1 材料与方法
1.1 插穗采集处理和扦插条件
以5年生欧美山杨杂种优良无性系为母株,2009年4月,剪取其当年生半木质化枝条为扦插材料。选择阴天采条,在母株上选取茎粗在0.3 cm左右、生长健壮、无病虫害的当年生半木质化枝条,对剪切下来的插条适当喷水,置于阴凉处防止萎蔫,保持新鲜状态。将枝条剪成长为2~3 cm、带1个节间、1片叶子的插穗,切口上平下斜,上切口在叶柄上方0.5 cm处,下切口在叶柄下方1~2 cm处,切口无破裂。每根插条只留1个叶片,叶片剪去2/3,并保留叶柄。制作好的插穗在清水中浸泡,以减少抑制剂对生根的影响,稍后对其采用不同的激素种类、质量浓度和时间进行处理,并以清水处理作为对照。
供试激素为萘乙酸(NAA)、吲哚丁酸(IBA)和吲哚乙酸(IAA),质量浓度分别为 100、300、500 mg·L-1,以清水为对照。插条在试剂中的浸泡时间分别为15、30、60 min,浸泡后插入基质中。扦插基质为河沙,下铺一层草炭土用以保水。扦插采用斜插法,扦插深度为插穗的1/3~2/5。
扦插后,插条叶面应尽量保持湿润,喷水次数和喷水量要根据具体情况而定,一般空气相对湿度要保持在80%左右,后期可适当降低。扦插期间记录插条的变化情况,扦插20 d后统计插条的生根率、生根数、根长和根径。
1.2 微扦插试验设计
按L9(34)正交表进行试验,试验因子和水平见表1。不考虑各因子之间的交互作用,9个处理随机排列,每个处理30个插穗,3次重复,管理一致。

表1 欧美山杨杂种嫩枝微扦插正交试验因子和水平
1.3 指标与测定方法
1.3.1 生根指标
扦插6 d后开始进行生根形态观察,每天上午观察1次;20 d时对生根状况进行全面调查,即调查插穗生根类型、生根率、生根数、根长、根径。
1.3.2 酶活性的测定
分别在扦插的当天和扦插后的6、9、12、15 d进行取材,取NAA100 mg·L-1浸泡处理30 min的欧美山杨杂种插穗测定酶活性。POD活性参照文献[11]测定,IAAO和PPO活性参照文献[12]测定。POD以每克鲜质量每分钟内A470变化0.01为1个过氧化物酶活性单位[U/(g·min)];PPO以每克鲜质量每分钟A525变化0.01为一个多酚氧化酶活性单位[U/(g·min)];IAAO以每毫升酶液每小时分解破坏IAA的量(μg)表示酶活力的大小[mg/(h·L)]。
1.4 扦插过程中插穗的形态变化
扦插生根过程根据插穗形态变化可划分为3个时期,分别为:从扦插当天起到扦插后第6天为愈伤组织形成期,可见少部分插穗基部愈伤组织出现;从扦插后第6天到第9天为生根诱导期,部分插穗皮部可见白色突起;从扦插后第9天到第12天为生根表达期,即,不定根生长期可见不定根突破皮层伸长生长。
1.5 数据处理
试验测量数据采用EXCEL及SPSS13.0软件进行方差分析、多重比较及相关分析。
2 结果与分析
2.1 激素处理对欧美山杨杂种嫩枝微扦插生根效果的影响
通过对欧美山杨杂种嫩枝微扦插20 d后生根情况(表2)研究发现,激素处理插穗生根率范围为14% ~76%,清水对照生根率仅为6%;不定根生根数为1.50~4.62条;不定根根长为2.65 ~5.96 cm;不定根根径为1.30 ~3.00 mm。在扦插试验过程中发现,根生长部位大多位于插穗基部的皮部,极少由愈伤组织生根,还有些插穗与其他同期扦插的生根插条相比仅出现了发达的愈伤组织而没有生根。因此,欧美山杨杂种嫩枝扦插生根为皮部生根类型。
对欧美山杨杂种嫩枝微扦插正交试验结果进行方差分析的结果表明(表3):激素种类对生根率、根长影响差异极显著,对根径影响差异显著;激素质量浓度对生根率影响差异显著;处理时间对生根率、生根数、根长和根径影响的差异不显著。

表2 正交试验结果

表3 正交试验方差分析结果
2.1.1 激素种类对生根的影响
不同激素种类对插条的生根率、根长和根径影响显著,对生根数影响不显著。用NAA、IBA和IAA处理插条的生根率差异极显著。根据LSD多重比较(表4)来看,NAA处理后扦插生根率显著高于IBA和IAA,IBA和IAA生根率差异不显著,但均高于对照;NAA处理所得不定根的数量较多,高于IBA和IAA,也高于对照;NAA处理的插条所发生的不定根短粗,相对健壮,而IAA和IBA处理的插条所发生的不定根相对细长;3种激素对于扦插生根数影响不显著。综合来看,NAA对插条促进生根效果明显好于IBA、IAA和对照。欧美山杨杂种扦插平均生根率 NAA(65.33%)>IAA(31.00%)>IBA(26.62%)>清水(6%)。
不同质量浓度的激素处理对插条的生根率影响显著,而对于生根数、根长和根径影响不显著。3种激素处理都表现出在质量浓度低时有利于生根,而质量浓度过高则抑制生根。即插穗中内源激素基本满足生根要求,如果再使用外源激素,应以低的质量浓度为宜,若质量浓度过高,则会抑制生根和根发育。试验结果表明,与对照相比,不同质量浓度的3种激素均可提高生根率,最适合欧美山杨杂种扦插生根的质量浓度为NAA100 mg·L-1,平均生根率为65.33%。不同质量浓度的激素处理对欧美山杨杂种扦插枝条的生根数目及根长、根径影响较小。
2.1.2 激素处理时间对生根的影响
不同浸泡时间对欧美山杨杂种扦插枝条的生根率有影响(表4),但不显著,生根率较高的处理时间为NAA30 min。各处理时间的插穗生根率、生根数、根长和根径没有差异。说明处理时间对欧美山杨杂种扦插特性影响不显著。
2.1.3 扦插生根各指标间的相关性
通过扦插生根各指标间的相关分析可以看出(表5),插穗生根率和根径、生根数存在显著正相关,生根率和不定根根长相关性较小;根径和根长存在负相关。
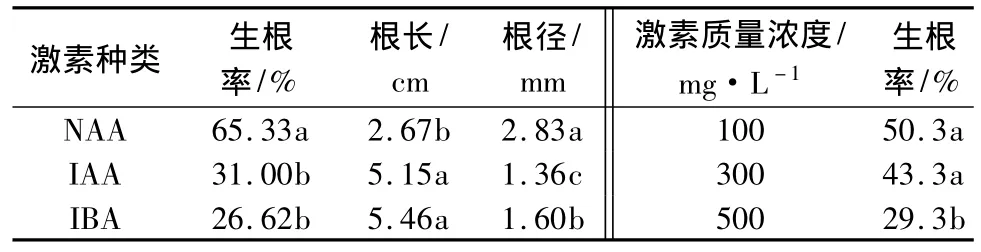
表4 激素种类、质量浓度对生根影响及LSD多重比较

表5 扦插生根各指标间的相关系数
2.1.4 欧美山杨杂种嫩枝微扦插生根效果
扦插繁殖的插穗长度多为8~12 cm,本试验采用的插穗长度仅为2~3 cm,因此叫微扦插。相比之下,欧美山杨杂种微扦插具有插穗短、每棵母株出穗率高、出苗时间短、扦插成本低等特点,通过试验摸索出适合的微扦插条件进行温室容器大规模微扦插育苗是可行的。试验中,各试验处理的最高生根率为76%,可以满足林业生产需要。
利用NAA和IBA、IAA处理欧美山杨插穗对扦插生根率的提高均有显著效果,且NAA的效果明显好于IBA和IAA。综合生根率、生根数、根长和根径4个指标,试验条件下,外源生长调节剂NAA100 mg·L-1处理欧美山杨杂种嫩枝微插穗为最佳处理组合,生根效果好,生根率达到76%。
2.2 欧美山杨杂种扦插生根过程中酶活性的变化
2.2.1 扦插生根过程过氧化物酶(POD)活性变化
POD是普遍存在于植物体内的含铁卟啉辅基的酶,不仅在植物的氧化胁迫中发挥作用,而且它还参与植物体内的多种生理生化过程,与一些高等植物的发育进程有密切关系,在细胞生长、分化的调节中及发育进程中起着重要作用[13]。POD同工酶在植物体内存在发育阶段特异性和组织特异性,外界因子可以通过POD影响植物器官的生理状态及发育方向,被认为是与生根有关的重要酶类,Garspar等将POD视为生根标志之一[14-15]。
从表6可知,在生根过程中,欧美山杨杂种插穗POD的活性总体上呈上升趋势。插穗在诱导期(6~9 d)POD活性上升较快,处理插穗在插后9 d时POD活性达到最高。对照插穗的POD在生根过程中变化较缓,总体上与处理相似,但POD活性在生根过程中低于对照。处理插穗的POD活性在不定根形成过程明显高于对照,这可能与植物生长调节剂(外源激素)作用有关,即外源NAA处理引起了插穗内过氧化物酶扦插生根过程中活性的变化。
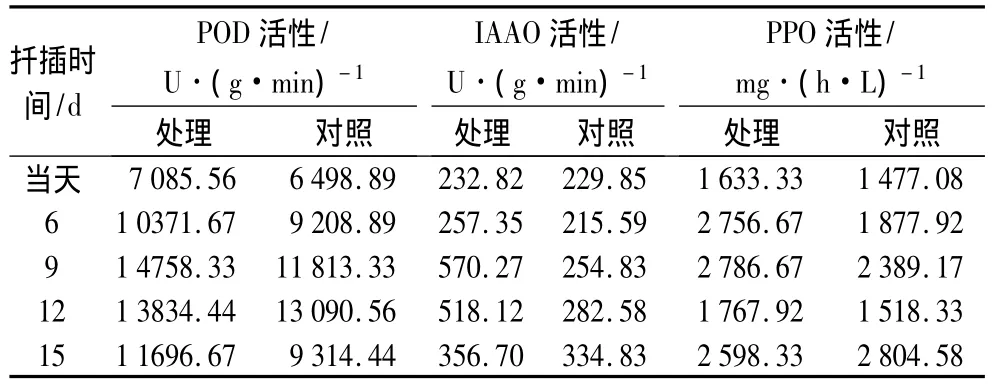
表6 欧美山杨杂种扦插生根过程中的酶活性
2.2.2 扦插生根过程中吲哚乙酸氧化酶(IAAO)活性变化
吲哚乙酸(IAA)在植物扦插不定根生成过程中起着重要作用,而任何影响植物内源IAA含量变化的因素势必影响不定根的发生。IAAO可以氧化IAA,因此IAAO活性的大小与扦插过程中不定根的发生有重要关系。Gaspar等[16]试验表明,离体生根过程中,高活性的吲哚乙酸氧化酶使内源IAA水平降低是生根诱导期的特点之一,质量分数低的IAA有利于生根。在表达期要求IAA的质量分数较高,以促进根的生长,但此阶段吲哚乙酸氧化酶表现活性降低。
从表6中可知,本研究中,处理插穗在扦插过程中IAAO活性先升高后降低,而对照中的IAAO活性则缓慢上升,变化较小。不定根诱导期,IAAO活性逐渐上升,使体内IAA活性降低,有利于根原基的生长。不定根表达期,IAAO活性下降,有利于不定根原基的表达生长。
2.2.3 扦插生根过程中多酚氧化酶(PPO)活性变化
高等植物中普遍存在多酚氧化酶(PPO),这种酶不仅在植物的生长、发育中起重要的作用,而且对植物的器官形态建成也起到非常重要的作用[17]。PPO能催化生长素的代谢,促进不定根的起源与发育。在插条生根过程中,酚类物质对不定根的发生和发育起着极其重要的作用[18],PPO可以催化酚类物质并与IAA形成一种IAA—酚酸复和物,这种复合物是一种生根的辅助因子,具有促进不定根形成的活性。
从表6中可知,在欧美山杨杂种扦插生根过程中,PPO活性先升高后下降再升高,在扦插后6~9 d的根原基诱导期,处理插穗的PPO活性最高,不定根表达期PPO活性则下降。在扦插初期,对照插穗的PPO活性较低,合成的生根辅助因子少,不利于插穗不定根的诱导,因此不定根表达较晚,生根率低。
3 结论与讨论
研究表明,欧美山杨杂种为皮部生根类型。利用NAA、IBA和IAA处理欧美山杨插穗对扦插生根率提高均有效果,且NAA的效果明显好于IBA和IAA。外源NAA处理欧美山杨杂种插穗扦插生根的最佳质量浓度为100 mg·L-1,最高生根率可以达到76%。
欧美山杨杂种插穗生根与POD、PPO和IAAO活性密切相关。在扦插生根过程中,POD、PPO和IAAO活性有规律地变化。在扦插后愈伤组织的形成期,3种酶活性均有上升,其后各自呈现一定的规律性。不定根诱导期IAAO活性高,有利于降解体内高质量分数的IAA,促进根的诱导,表达期IAAO活性下降,内源IAA的质量分数增加,促进根的生长。POD和IAAO活性变化趋势相似,均表现为诱导期上升、表达期活性下降。PPO在生根诱导期维持较高活性,在表达期先降低、后升高。扦插后处理插穗的POD、PPO活性均高于对照,说明POD和PPO活性的增加能够显著提高插穗的生根率。
不同处理插穗的生根效果可能与外源生长素处理改变了生根过程中酶的活性和相互关系有关。不同外源激素种类、质量浓度处理与欧美山杨杂种插穗中POD、PPO、IAAO活性变化的关系,有待进一步研究。
[1]Winton L L.Shoot and tree production from aspen tissue cultures[J].Amer J Bot,1970,57(8):904 - 909.
[2]Wolter Karl E.Root and shoot initiation in aspen callus culture[J].Nature,1968,219:509 -510.
[3]Chalupa V.Control of root and shoot formation and production of trees from poplar callus[J].Biologia Plantarum,1974,16(4):316 -320.
[4]曹川健,任玉芬,黄慧.三倍体欧洲山杨的试管繁殖[J].植物生理学通讯,1998,32(2):124 -125.
[5]刁桂萍,杨传平,詹亚光.欧美山杨杂种工厂化育苗技术[J].东北林业大学学报,2009,36(9):14 -16.
[6]Liu Z H,Ger M J.Changes of enzyme activity during pollen germination in maize,and possible evidence of lignin synthesis[J].Australian Journal of Plant Physiology,1997,24(3):329 -335.
[7]Bagatharia S B,Chanda S V.Changes in peroxidase and IAA oxidase activities during cell elongation in Phaseolus hypocotyls[J].Acta Physiologiae Plantarum,1998,20(1):9 -13.
[8]Saxena C,Samantaray S,Rout G R,et al.Effect of auxins on in vitro rooting of Plumbago zeylanica:peroxidase activity as a marker for root induction[J].Biologia Plantarum,2000,43(1):121 -124.
[9]Al Barazi Z,Schwabe W W.The possible involvement of polyphenol-oxidase and the auxin-oxidase system in root formation and development in cuttings of Pistacia vera[J].Journal of Horticultural Science,1984,59(3):453 -461.
[10]Devi S R,Prasad M N V.Ferulic acid mediated changes in oxidative enzymes of maize seedings:implication in growth[J].Biologia Plantarum,1996,38(3):387 -395.
[11]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2004.
[12]刘萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007.
[13]Moncousin C H,Gaspar T.Peroxidase as a marker for rooting improvement in Cynara scolymus L.cultivated in vitro[J].Biochem Physiol Pflanzen,1983,178:263 -271.
[14]Nordström A C,Eliasson L.Levels of endogenous indole-3-acetic acid and indole-3-acetylaspartic acid during adventitious root formation in pea cuttings[J].Physiol Plant,1991,82(4):599 -605.
[15]Gaspar T,Kevers C,Hausman J F,et al.Practical uses of peroxidase activity as a predictive marker of rooting performance of micropropagated shoots[J].Agronomie,1992,12(10):757 - 765.
[16]黄卓烈,李明,谭绍满,等.吲哚丁酸对桉树插条多酚氧化酶的影响及其与生根的关系[J].广西植物,2003,23(1):77 -82.
[17]Gasper T,Penel C,Thorpe J,et al.Peroxidase 1970 - 1980.A survey of their biochemical and physiological roles in higher plants[M].Geneva:University of Geneve,1982.

