人表皮干细胞的分离与鉴定
梅雪岭 连 石
(1.首都医科大学附属北京友谊医院皮肤科,北京 100050;2.首都医科大学宣武医院皮肤科,北京 100053)
人体干细胞分为胚胎干细胞和成体干细胞。目前在人体多种组织中发现了组织特异性的成体干细胞,包括造血系统、中枢神经系统、角膜上皮等。成体干细胞有2种特性,自我更新能力和多潜能性。干细胞能够不对称性分裂产生一个干细胞存留在龛内和另一个短暂扩充细胞经历有限的增生和终末分化[1]。表皮是皮肤外层的复层上皮,包括滤泡间上皮和附属结构(毛囊和皮脂腺)。在整个生命过程中,表皮内的终末分化细胞不断地脱落并被替代。表皮内的终末分化细胞不能分裂,它们的替代依赖于表皮干细胞。表皮干细胞通过对称或不对称的分裂而产生短暂扩充细胞进而产生滤泡间上皮、毛囊和皮脂腺。最具特征性的表皮干细胞群位于毛囊的隆突处,但是滤泡间上皮和皮脂腺内也存在表皮干细胞[2]。表皮干细胞具有自我更新和多潜能性,因此其主要作用是维持正常状态下的表皮的动态平衡。此外,这些低分裂倾向的休眠的干细胞,在创伤后能够广泛并且持续的自我更新从而促进创伤愈合,因此表皮干细胞是组织工程和再生医学的潜在的细胞来源。除了维持表皮的平衡和愈合,表皮干细胞还是肿瘤发生和基因治疗的重要靶点[3]。基于表皮干细胞在创伤愈合与肿瘤研究方面的重要作用,对于表皮干细胞的研究意义重大。
关于人表皮干细胞的分离和鉴定已经有相关的研究。在早期的研究[4]中,通常根据表皮干细胞在体外的增生潜能与其他角质形成细胞不同而利用克隆类型来鉴别表皮干细胞,但是操作难度较大。近期的研究[5]发现了一些表皮干细胞高表达的蛋白分子,如整合素、P63蛋白、角蛋白15、19等。利用这些分子标志物鉴别表皮干细胞易于操作。本研究依据表皮干细胞能够快速黏附细胞外基质蛋白的特性分离了快速黏附Ⅳ型胶原的原代角质形成细胞群并且通过检测α1整合素、P63蛋白分子的表达对分离的细胞进行了鉴定。
1 材料和方法
1.1 材料
1)仪器:CO2孵箱为美国Thermo Forma公司产品;倒置相差显微镜为日本Nikon公司产品;共聚焦显微镜为德国莱卡公司产品。
2)试剂:中性蛋白酶II为德国罗氏公司产品;胰蛋白酶/EDTA,蛋白酶抑制剂,EpiLife培养基均为美国Cascade Biologics公司产品;Ⅳ型胶原为美国Sigma公司产品;鼠抗人p63抗体(Sc-8431),鼠抗人α6-整合素抗体(Sc-71427)均为美国Santa Cruz公司产品;TFITC结合的羊抗鼠荧光抗体(ZF-0313)为美国ZSGB-BIO公司产品。DAPI为美国Sigma公司产品。
1.2 方法
1)正常原代角质形成细胞的分离和培养:正常人皮肤标本来源于包皮环切术的患者(年龄≤20岁)。依据之前的研究方法[6]制备原代的角质形成细胞。简而言之,将皮肤标本置于2.4 U/mL中性蛋白酶Ⅱ中4℃过夜使表皮与真皮分离。将表皮片置于胰蛋白酶/EDTA中37℃作用30 min并用蛋白酶抑制剂终止反应。将反应的产物置于EpiLife培养基中制备人正常原代角质形成细胞的单细胞悬液。将单细胞悬液种于无Ⅳ型胶原包被的普通24孔培养板内,置于37℃培养箱,EpiLife培养基内继续培养正常原代角质形成细胞。
2)快速黏附Ⅳ型胶原的角质形成细胞的分离和培养:快速黏附Ⅳ型胶原的角质形成细胞的制备过程在之前的研究[7]中已经描述。将人的原代角质形成细胞的单细胞悬液种于用20 μg/mLⅣ型胶原包被的24孔培养板内,置于37℃培养箱内孵育20 min。之后,用培养基清洗培养板2次,将培养板内没有黏附的细胞全部去掉,剩余的即为快速黏附Ⅳ型胶原的角质形成细胞。将此细胞置于37℃培养箱,EpiLife培养基内继续培养。将2种细胞群置于相同的条件下培养,EpiLife培养基,5%CO237℃培养箱。培养24 h后更换培养基并观察细胞形态。
3)快速黏附Ⅳ型胶原的角质形成细胞和正常原代角质形成细胞的免疫荧光标记:细胞培养24 h后,将快速黏附Ⅳ型胶原的角质形成细胞和原代正常角质形成细胞在相同的条件下进行免疫荧光标记:4%多聚甲醛室温下固定10 min;磷酸盐缓冲液洗涤3遍;穿孔剂室温下作用15 min;2%牛血清蛋白封闭30 min;洗涤后分别加入p63、α6-整合素抗体4℃过夜。2种抗体均按1∶100比例稀释使用。过夜后将细胞清洗3遍,再将细胞与荧光素标记的抗体37℃下作用1 h。DAPI室温下复染5 min标记细胞核。
4)细胞形态学观察及量化分析:使用倒置相差显微镜观察细胞的大小形状等形态特征并取得图片。使用共聚焦显微镜观察不同抗体标记细胞的荧光反应状态并取得图片。同时于2种细胞群的2种标志物染色结果中各取得20个高倍视野,并计数p63,α6-整合素阳性细胞的数量。
1.3 统计学方法
所有实验至少重复3遍。采用SAS 9.1.3软件对数据进行分析处理,各组数据间的比较采用独立样本的t检验。结果以均数±标准误(mean±SE)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态
细胞分离培养后24和48 h,所有的快速黏附细胞形态及大小几乎一致,细胞核较大,细胞近似圆形。但是对照组的正常原代角质形成细胞形状不规则,大小不一致(图1)。
2.2 细胞分子标记蛋白的表达
于分离细胞后24 h,我们用α6整合素,p63抗体对2组细胞群进行染色,并且利用共聚焦显微镜观察2种蛋白的表达。我们发现,快速黏附于Ⅳ型胶原的角质形成细胞群高表达α6整合素和p63蛋白。相反,对照组原代角质形成细胞群低表达α6整合素和p63蛋白(图2)。
2.3 量化分析
为了进一步量化分析2组细胞的蛋白表达情况,本研究选择了20个高倍视野对α6整合素、p63蛋白表达阳性的细胞进行计数并进行比较(图3)。2组细胞蛋白表达差异有统计学意义(P<0.05)。此量化分析结果显示快速黏附Ⅳ型胶原而分离的角质形成细胞群富集了人的表皮干细胞。
3 讨论

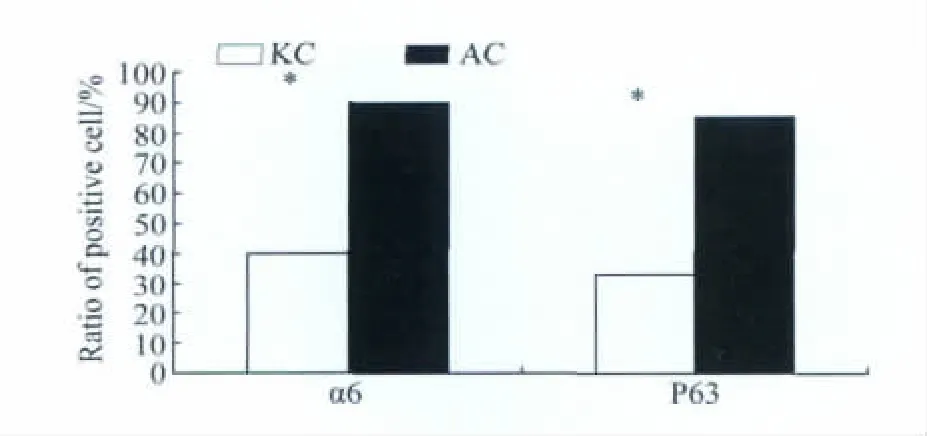
图3 细胞标记蛋白表达量化分析Fig.3 Quantitative analysis of expression of markers
表皮干细胞的生物学研究能够为某些皮肤病的临床治疗提供新的思路,如对于烧伤、难治性溃疡以及一些遗传异常导致的皮肤缺损性疾病,宿主表皮干细胞的实验室扩增能够最大限度地减少患者供皮区的面积,给皮肤移植和皮肤替代物的研究带来新的希望。除了皮肤替代物,表皮干细胞的培养还提供了基因治疗的可能性,此方法在大疱性表皮松解的动物模型中已经获得成功[1]。表皮干细胞研究与临床相关的另一个方面是皮肤的恶性肿瘤。在致癌物研究的模型中,致癌物被发现残留在表皮内的休眠的细胞内和具有高增生潜力的细胞内,均提示为表皮干细胞。所以,通过表皮干细胞生物学基础研究的发展,我们也许能够更好地治疗良性和恶性的皮肤疾病。
分离并鉴定表皮干细胞是表皮干细胞体外研究的基础。早期的研究[8]显示,快速黏附于细胞外基质蛋白的角质形成细胞表现为高效的克隆形成,进一步的研究[7]结果也显示利用快速黏附Ⅳ型胶原,纤连蛋白或其他细胞外基质的方法能够从角质形成细胞中纯化干细胞。因此利用快速黏附Ⅳ型胶原的方法分离表皮干细胞的方法被普遍应用。表皮干细胞的鉴定是近年来的研究重点,许多表皮干细胞标记分子陆续被报道,整合素是介导角质形成细胞与基底膜黏附的黏附分子,β1整合素的表达局限于毛囊的隆突部位和表皮突,α6整合素表达于毛囊外根鞘的最外层和滤泡间上皮的基底层,2者均为表皮干细胞的标记分子之一。研究[10]显示角蛋白(cytokeratin,CK)-15阳性细胞位于毛囊隆突部位,表皮的基底层和外分泌腺,也是表皮干细胞的标记蛋白之一。CK19阳性的细胞也出现于毛囊隆突和远端外根鞘的外层,体内和体外研究[11]均显示CK19对于干细胞的定向分化很重要,亦为表皮干细胞的标记蛋白之一。转录因子家族的结构性关联蛋白p63是p53肿瘤抑制基因的类似物,研究[5]显示p63蛋白表达于基底层和毛囊外根鞘的细胞,可以作为鉴定表皮干细胞的标记分子。研究[12]显示CD34表达于人毛囊隆突下部外根鞘的外层细胞。CD200阳性细胞也已经从标记滞留的人隆突细胞中分离出来,并且发现CD200可能在抑制免疫反应中发挥了作用,能够防止毛囊内的角质形成细胞的炎性反应损害[13]。虽然研究显示多种蛋白标记分子表达于表皮干细胞分布的部位,但是唯一特异并且可靠的干细胞标记分子仍旧缺乏。因此我们使用2种标记分子联合鉴定法来标记分离的细胞。因为表皮干细胞具有高黏附和高增生的特性,因此我们选取代表黏附和增生特性的整合素和P63蛋白分子作为标记分子。
本研究利用快速黏附Ⅳ型胶原的方法分离了具有快速黏附能力的角质形成细胞,并且对分离的细胞是否表达α6整合素、p63蛋白进行鉴定。我们发现分离的快速黏附细胞形态与普通角质形成细胞形态不同,细胞呈圆形,大小均匀一致,胞核较大。分离的快速黏附细胞高表达α6整合素和p63蛋白与传统方法分离到的正常角质形成细胞差异有统计学意义,说明快速黏附法分离的细胞群具有显著的高黏附和高增生的特性,均符合表皮干细胞的特性。虽然短暂扩充细胞的特性与表皮干细胞的特性非常相似,而且目前尚无一种特异的蛋白分子能够在体外将2者严格区分,但是快速黏附法分离的细胞群较正常角质形成细胞群而言是富集了人表皮干细胞的细胞群。因此,利用此细胞群作为体外研究的研究对象获得的研究结果能够代表表皮干细胞的趋向性。
总之,我们利用表皮干细胞对胶原的黏附特性成功地从人的正常皮肤中分离出了富集了人表皮干细胞的细胞群并对其进行鉴定。为进一步体外研究表皮干细胞的生物学特性奠定了基础。
[1]Li L,Xie T.Stem cell niche:structure and function[J].Annu Rev Cell Dev Biol,2005,21:605-631.
[2]Alonso L,Fuchs E.The hair cycle[J].J Cell Sci,2006,119(Pt3):391-393.
[3]Owens D M,Watt F M.Contribution of stem cells and differentiated cells to epidermal tumours[J].Nat Rev Cancer,2003,3(6):444-3451.
[4]Barrandon Y,Green H.Three clonal types of keratinocyte with different capacities for multiplication[J].Proc Natl Acad Sci U S A,1987,84(8):2302-2306.
[5]Pellegrini G,Dellambra E,Golisano O,et al.P63 identi-fies keratinocyte stem cells[J].Proc Natl Acad Sci U S A,2001,98(6):3156-3161.
[6]Wittmann M,Purwar R,Hartmann C,et al.Human keratinocytes respond to interleukin-18:implication for the course of chronic inflammatory skin diseases[J].J Invest Dermatol,2005,124(6):1225-1233.
[7]Kim D S,Cho H J,Choi H R,et al.Isolation of human epidermal stem cells by adherence and the reconstruction of skin equivalents[J].Cell Mol Life Sci,2004,61(21):2774-2781.
[8]Jones P H,Watt F M.Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression[J].Cell,1993,73(4):713-724.
[9]Kloepper J E,Tiede S,Brinckmann J,et al.Immunophenotyping of the human bulge region:the quest to define useful in situ markers for human epithelial hair follicle stem cells and their niche[J].Exp Dermatol,2008,17(7):592-609.
[10]Lyle S,Christofidou-Solomidou M,Liu Y,et al.The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells[J].J Cell Sci,1998,111(Pt21):317931-317988.
[11]Michel M,Torok N,Godbout M J,et al.Keratin 19 as a biochemical marker of skin stem cells in vivo and in vitro:keratin 19 expressing cells are differentially localized in function of anatomic sites,and their number varies with donor age and culture stage[J].J Cell Sci,1996,109(Pt5):1017-1028.
[12]Trempus C S,Morris R J,Bortner C D,et al.Enrichment for living murine keratinocytes from the hair follicle bulge with the cell surface marker CD34[J].J Invest Dermatol,2003,120(4):501-511.
[13]Rosenblum M D,Olasz E B,Yancey K B,et al.Expression of CD200 on epithelial cells of the murine hair follicle:a role in tissuespecific immune tolerance?[J].J Invest Dermatol,2004,123(5):880-887.

