α-突触核蛋白在人脑膜瘤组织中的表达
吴 杨 苏玉金 李 昕 刘光伟 李尧华 于 顺*
(1.首都医科大学宣武医院神经生物学研究室,教育部神经变性病重点实验室,北京 100053;2.首都医科大学天坛医院神经科学研究所,北京 100050)
α-突触核蛋白(α-synuclein,α-syn)由 140 个氨基酸组成,在中枢及外周神经组织中含量丰富,主要存在于成年人脑组织神经元的突触前终末端,与突触可塑性的形成有关[1]。α-syn在胚胎脑组织主要存在于神经元的胞体中,随着胚胎发育,逐渐分布到突触前终末端[2-3]。以往的研究[4-5]表明,α-syn 可以促进 β-微管蛋白组装成微管,并提高培养的MES23.5多巴胺神经细胞增生速度。鉴于α-syn家族中的另一个成员 γ-突触核蛋白(γ-synuclein,γ-syn)也具有促进 β-微管蛋白组装成微管的作用[6],并影响肿瘤细胞的增生、迁移和侵袭性[7],推测 α-syn也可能存在于肿瘤细胞中,并发挥与γ-syn类似的作用。本课题组利用免疫组织化学方法证明α-syn在人脑膜瘤组织中的表达,观察其与β-微管蛋白之间的关系。
1 材料和方法
1.1 实验材料
1.1.1 组织切片
人脑组织切片来自首都医科大学天坛医院神经外科患者经手术切除的脑组织,其中20例为脑膜瘤组织。5例为癫痫病人异常放电脑组织,作为对照脑组织。所有组织均制备成石蜡包埋切片。
1.1.2 主要试剂
兔抗人α-syn多克隆抗体、鼠抗人α-syn单克隆抗体 3D5 均由本室制备[8-9];鼠抗人突触素(synaptophysin,SYP)抗体(美国Santa cruz公司);鼠抗人β-微管蛋白单克隆抗体、生物素标记山羊抗兔IgG、生物素标记山羊抗小鼠IgG、链霉亲和素标记辣根过氧化物酶、FITC标记山羊抗兔IgG、TRITC标记山羊抗小鼠IgG(美国Vector Laboratory公司);其他试剂为分析纯。
1.2 方法
1.2.1 免疫组织化学染色
将脑组织切片依次通过二甲苯、不同浓度乙醇和柠檬酸缓冲液进行脱蜡和抗原修复,3%牛血清白蛋白(bovine serum albumin,BSA)溶液封闭,然后与不同抗人 α-syn的抗体(兔多克隆抗体 1∶10 000、3D5 1∶4 000)于4℃反应过夜,与生物素标记的山羊抗兔或山羊抗鼠IgG(1∶1 000)室温反应2 h,再与链霉亲和素标记的辣根过氧化物酶(1∶1 000)室温反应1 h,用含有DAB的显色液显色,在显微镜下观察结果。
1.2.2 免疫荧光双重标记
脱蜡和抗原修复脑组织切片,经3%BSA封闭后,在4℃条件下与兔抗人α-syn多抗(1∶500)和鼠抗人β-微管蛋白单抗(1∶50)或鼠抗人 SYP单抗(1∶400)反应过夜,再与FITC标记的山羊抗兔IgG(1∶800)和TRITC明标记的山羊抗小鼠IgG(1∶800)室温反应2 h。荧光标记结果用荧光共聚焦显微镜观察。
2 结果
2.1 α-syn在对照脑组织中的表达
在正常脑组织中,α-syn免疫活性物质呈细小的颗粒状,均匀分布于脑组织的神经元之间,提示这种蛋白在神经末梢存在(图1)。免疫荧光双重标记证明,α-syn在神经末梢与突触特异蛋白突触素共存。α-syn免疫活性物质还见于神经元的胞体和近端突起部位。α-syn在神经元末梢与 β-微管蛋白共存(图2)。
2.2 α-syn在脑膜瘤组织中的表达
在脑膜瘤组织,α-syn免疫阳性细胞呈漩涡状或巢状分布。α-syn免疫活性物质主要分布于肿瘤细胞的胞质与核膜。此外,α-syn也见于少数肿瘤细胞的胞核中。在不同肿瘤细胞团中的α-syn免疫活性物质的含量不同,有些细胞团含量较高,而另一些则较低(图3,4)。两种不同抗体所显示 α-syn的表达位置相同。
免疫荧光双重标记结果显示,在脑膜瘤细胞中,α-syn和β-微管蛋白在胞质均呈阳性反应,并且共存(图5),在肿瘤组织中β-微管蛋白表达量多,而在正常组织中表达量则较少。
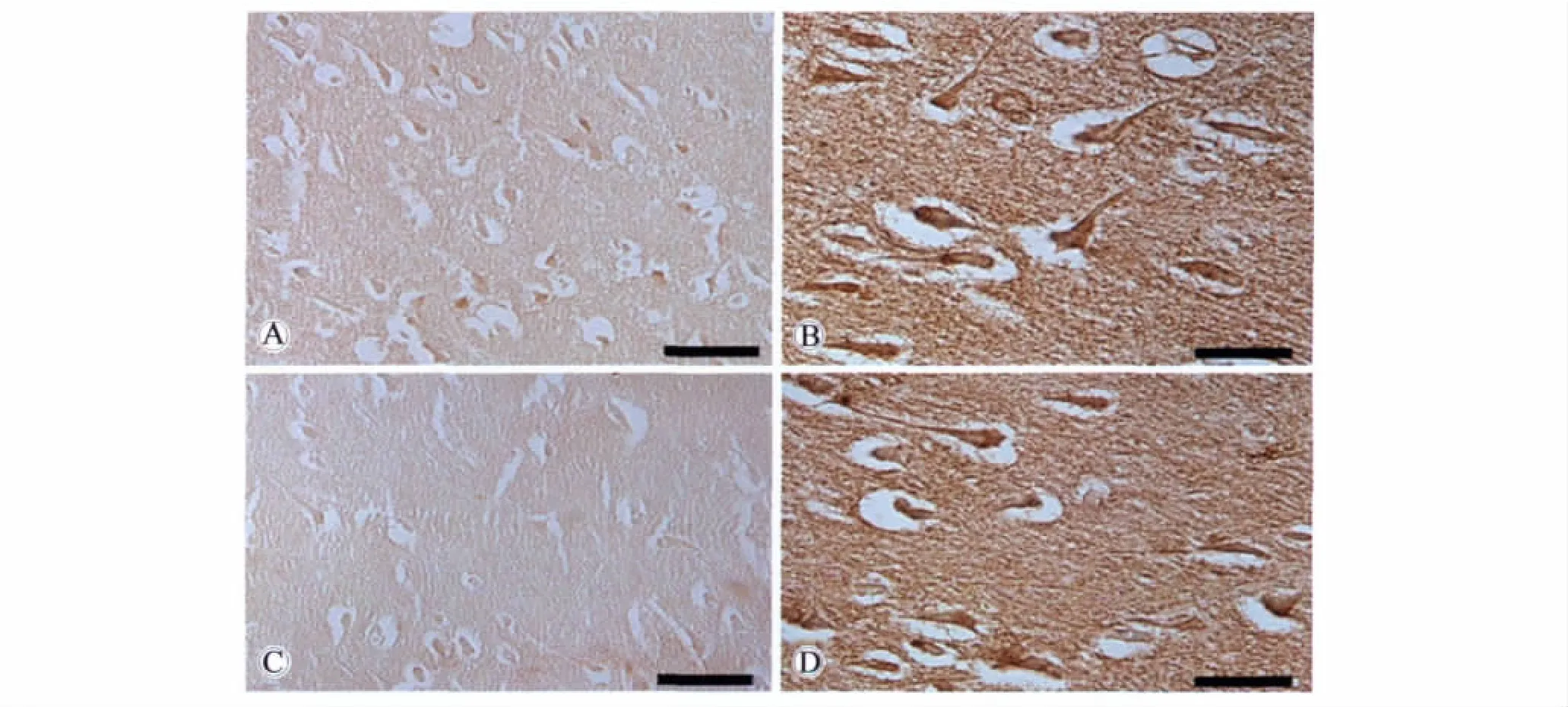
图1 抗人α-syn抗体显示α-syn在对照脑组织中的分布Fig.1 Anatomical distribution of α-syn in control humen brain
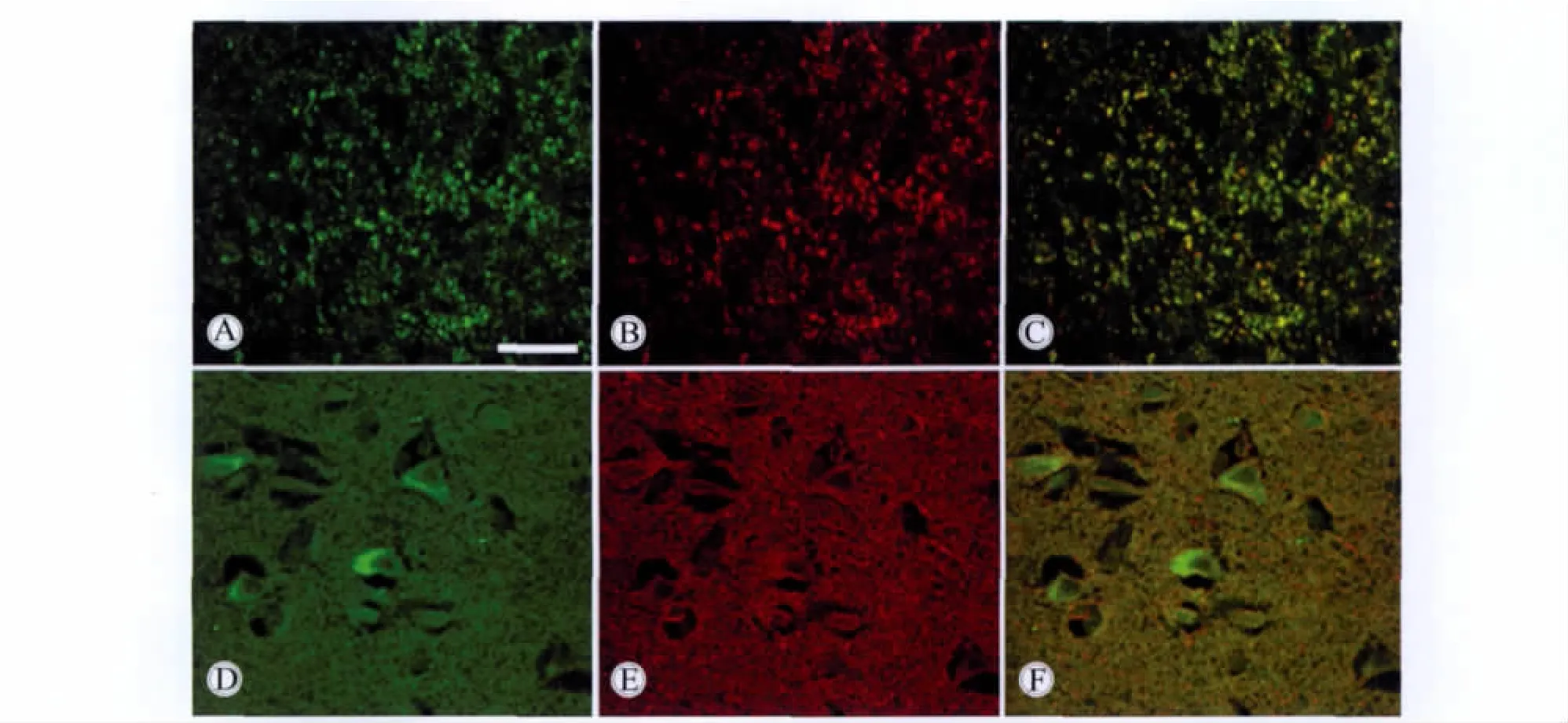
图2 免疫荧光双重标记显示α-syn和突触素、β-微管蛋白在对照脑组织中共存Fig.2 Double immunofluorescent labeling by polyclonal antibody of α-syn and SYP/β-tubulin antibody

图3 抗人α-syn多克隆抗体显示α-syn在脑膜瘤组织中的分布Fig.3 Anatomical distribution of α-syn in meningiomas tissue by polyclonal antibody
3 讨论
本课题组采用了2种抗人α-syn抗体进行免疫组织化学染色,均证明α-syn在脑膜瘤组织中肿瘤细胞的胞质与胞核中存在。而在正常脑组织,α-syn免疫活性物质除少量存在于神经元的胞体和近端突起部位外,主要呈细小的颗粒状分布于神经元之间,这些α-syn免疫活性物质与突触特异性蛋白突触素共存,提示α-syn在正常脑组织存在于神经末梢的突触前终末。以往研究[10-11]表明,α-syn 主要存在于具有神经元分化特性的脑肿瘤中,而在非神经元来源的脑膜瘤则不表达。本研究结果表明,非神经元来源的脑肿瘤也表达 α-syn。

图4 3D5显示α-syn在脑膜瘤组织中的分布Fig.4 Anatomical distribution of α-syn in meningiomas tissue by 3D5

图5 免疫荧光双重标记显示α-syn和β-微管蛋白在脑膜瘤组织中共存Fig.5 Double immunofluorescent labeling by polyclonal antibody of α-syn and β-tubulin antibody
α-syn在脑膜瘤细胞中的功能尚不清楚。以往研究[6-7]表明,α-syn 家族的另一个成员 γ-syn 与肿瘤细胞的增生、迁移、侵袭性有关,γ-syn对肿瘤细胞的影响与其促进微管蛋白组装成微管有关。鉴于α-syn与γ-syn在氨基酸序列上具有高度的一致性,体外研究[4]证明,α-syn也具有促进微管的聚合的作用,推测α-syn在脑膜瘤细胞也可能参与微管的形成过程,并进而影响肿瘤的增生、迁移和侵袭性。作为支持这一推测的证据有α-syn在脑膜瘤细胞与β-微管蛋白共存,提示α-syn与微管组装具有密切的关系。支持以上推测的另一个证据是,本课题组以往的研究[5]表明,α-syn可以促进细胞的增生,而其促进细胞增生的活性部位与其促进微管聚合的活性部位相同,均在其蛋白质羧基末端。
微管作为细胞的重要骨架蛋白参与的核分裂与胞质分裂过程[12],而β-微管蛋白是构成微管的主要成分。鉴于微管参与细胞分裂过程中的核分裂和胞体分裂以及肿瘤细胞的迁移[13-15],推测 α-syn 也可能与肿瘤的增生、迁移和侵袭性有关。
[1]Lavedan C.The synuclein family[J].Genome Res,1998,8(9):871-880.
[2]Hsu L J,Mallory M,Xia Y,et al.Expression pattern of synucleins(non-Ab component of Alzheimer's disease amyloid precursor protein/α-synuclein)during murine brain development[J].J Neurochem,1998,71(1):338-344.
[3]Galvin J E,Schuck T M,Lee V M,et al.Differential expression and distribution of α-,β-,γ-synuclein in the developing human substantia nigra[J].Exp Neurol,2001,168(2):347-355.
[4]Alim M A,Ma Q L,Takeda K,et al.Demonstration of a role for alpha-synuclein as functional microtubule-associated protein[J].J Alzheimers Dis,2004,6(4):435-442.
[5]Yin J,Han J,Zhang C,et al.C-terminal part of α-synuclein mediates its activity in promoting proliferation of dopaminergic cells[J].J Neural Transm,2011,118(8):1155-1164.
[6]Zhang H,Kouadio A,Cartledge D,et al.Role of gammasynuclein in microtubule regulation[J].Exp Cell Res,2011,317(10):1330-1339.
[7]Liu C,Dong B,Lu A,et al.Synuclein gamma predicts poor clinical outcome in colon cancer with normal levels of carcinoembryonic antigen[J].BMC Cancer,2010,10:359.
[8]Yu S,Li X,Liu G,et al.Extensive nuclear localization of alpha-synuclein in normal rat brain neurons revealed by a novel monoclonal antibody[J].Neuroscience,2007,145(2):539-555.
[9]贾春松,李昕,李尧华,等.缺血/再灌注大鼠脑和血浆中α-突触核蛋白含量的变化[J].首都医科大学学报,2010,31(3):368-372.
[10]Kawashima M,Suzuki S O,Doh-ura K,et al.Alpha-synuclein is expressed in a variety of brain tumors showing neuronal differentiation[J].Acta Neuropathol,2000,99(2):154-160.
[11]Raghavan R,White C L 3rd,Rogers B,et al.Alphasynucelin expression in central nervous system tumors showing neuronal or mixed neuronal/glial differentiation[J].J Neuropathol Exp Neurol,2000,59(6):490-494.
[12]Katsetos C D,Herman M M,Mörk S J,et al.ClassⅢ beta-tubulin in human development and cancer[J].Cell Motil Cytoskeleton,2003,55(2):77-96.
[13]Esteves A R,Arduino D M,Swerdlow R H,et al.Microtubule depolymerization potentiates alpha-synuclein oligomerization[J].Front Aging Neurosci,2010,1:5.
[14]Nakayama K,Suzuki Y,Yazawa I.Microtubule Depolymerization Suppresses α-synuclein accumulation in a mouse model of Multiple system atrophy[J].Am J Pathol,2009,174(4):1471-1480.
[15]Zhou R M,Huang Y X,Li X L,et al.Molecular interaction of alpha-synucelin with tubulin influences on the polymerization of microtubule in vitro and structure of microtubule in cells[J].Mol Biol Rep,2010,37(7):3183-3192.
——水芹主要害虫识别与为害症状

