药用植物黄酮类化合物的提取方法
吴聪华,程 华,李琳玲,姜德志,袁红慧,程水源*
(1.经济林木种质改良与资源综合利用湖北省重点实验室,湖北 黄冈 438000;2.黄冈师范学院化学与生命科学学院,湖北 黄冈 438000;3.武汉工程大学化工与制药学院,湖北 武汉 430074)
0 引 言
黄酮类化合物(flavonoids)是一类存在于自然界的、具有2-苯基色原酮(flavone)结构的化合物.它们分子中有一个酮式羰基,第一位上的氧原子具碱性,能与强酸成盐,其羟基衍生物多具黄色,故又称黄碱素或黄酮[1].黄酮(flavonoids)主要是由C6-C3-C6组成(图1).依据C3部分的形成方式(氧化、成环、取代)的差异,可将黄酮分为黄酮醇、查尔酮、橙酮、黄酮类、异黄酮、花青素以及各类二氢衍生物[2-3].
图1 黄酮类化合物的基本骨架
对于人类来说黄酮类化合物不仅赋予了植物美好的颜色和口感,而且这些化合物本身对人类健康具有多种保健和医药功能[4].它们可以清除自由基,抗氧化,消炎,抗病毒,抗癌,发挥植物雌激素活性,保护心血管系统和肝脏,抑制酒精嗜好症,防止骨质疏松等.随着分离纯化技术的发展,发现的黄酮类化合物种类越来越多.为了找到更多、药效更好的黄酮单体并研究其药理作用,对药用植物中黄酮的分离提纯方法[5]研究就显得尤为重要.
1 药用植物黄酮类化合物的提取工艺
1.1 植物黄酮类化合物简介
黄酮类化合物是一种植物中分布广而且重要的多酚类天然产物,广泛存在于高等植物,也存在于许多低等植物如苔藓和地钱中,即几乎存在于所有的绿色植物中,尤以芸香科、唇形科、石南科、玄参科、豆科、苦苣苔科、银杏科和菊科等高等植物中分布较多[6].在中草药和现代医药方面,黄酮类化合物有着重要的作用.银杏、菊花、葛根、柚皮、马鞭草、金银花等一系列富含黄酮类化合物植物的研究不断深入,科研工作者在黄酮的提取方面做了大量工作[7-13].
1.2 黄酮类化合物提取方法
1.2.1 水提取法 黄酮类化合物的水提取法(Water Extraction, WE)是一种较传统的方法[14],目前已较少使用.在不破坏黄酮化合物结构的情况下,林启训[15]对枇杷叶中黄酮类化合物进行了相关提取摸索,并且摸索出了一套优化提取条件.肖坤福[16]在对多穗柯中黄酮类物质提取工艺的研究中也对水提法作了较详细的介绍,此法为日常生活中食用富含黄酮类化合物食物提供了较好的参考价值.
1.2.2 醇提取法 醇提取法(SE)较水提法效率要高.对于含黄酮植物,有机溶剂提取法是比较常用的一种方法.SE法提取有机溶剂主要有乙醇、甲醇、乙酸乙酯、乙醚等,其中最常使用的溶剂是乙醇.刘银芳[17]摸索出了一套优化的乙醇提取条件,给沙苑子中黄酮类化合物的提取带来了极大的便利.陈少峰[18]在提取柴胡中总黄酮时,选定的优化条件为:温度80 ℃、柴胡颗粒粒径1 mm、乙醇体积分数60%、搅拌速度300 r·min-1,实验发现表观活化能为33.271 kJ·mol-1.在醇提法中,甲醇也是一种常用的提取剂,较之乙醇其提取效果更好.在实验过程中,为了得到纯度更佳的黄酮类化合物,通常还要进行石油醚或己烷的脱脂或脱色素预处理,然后再用甲醇、乙醇、丙醇及它们的一系列水溶液溶剂来进一步提取.
1.2.3 超声波提取法 超声波提取法(ultrasound-assisted extraction, UAE)是目前应用较为广泛的一种方法,具有操作方便,实用性强等特点.卞杰松[19]在对马鞭草中黄酮化合物的测定中,利用超声波结合乙醇法得到的黄酮类化合物的总含量为8.36 mg/g,回收率为99.56%,效果良好.很多科研工作者将超声波法和其它方法联合在一起效果更佳.通过微波-超声波法的协同作用,张培宇等[20]对马齿苋中黄酮化合物的提取工艺进行了优化:在马齿苋20倍量体积分数为70%乙醇的条件下,辅助微波功率600 W处理5 min,置80 ℃温水浴中超声提取2次,每次提取15 min;此时的提取产率为11.35%,而相同条件下超声波法和微波法的提取产率分别为5.79%和4.56%.由此可见,微波-超声波联用比单独提取效果更好.此外,在醇提法的基础上还可以使用超声波法做预处理,效果也较理想.例如,张公亮[11]采用超声波萃取法,研究仙人掌黄酮类化合物的提取工艺.通过试验确定了超声波功率、乙醇体积分数及辐射时间的最佳参数,实验结果表明提取最佳条件为:乙醇体积分数65%、功率550 W、辐射时间12 s,并且AB-8型树脂分离提纯效果最好,吸附率为84.81%,解吸率达88.42%.
1.2.4 微波提取法 微波提取法(Microwave extraction, ME)同其它方法相比具有操作简便,耗能耗材少等优点.尤其对特定的药材提取效果更为理想.谭静[21]等通过微波提取法和超声波提取法提取柚皮中的黄酮类化合物进行了对比,实验发现:微波萃取法提取柚皮中黄酮类化合物的最佳条件为料液比1∶25(质量分数)、提取时间为20 min、提取温度为50 ℃、乙醇体积分数为60%时,黄酮得率最高,为8.437 mg/g;超声波提取法提取柚皮黄酮的最佳条件为:料液比1∶25(质量分数)、提取时间为10 min、提取温度50 ℃、乙醇体积分数50%,此时黄酮得率为5.263 mg/g.微波法常用来作为一种辅助手段使植物黄酮提取效率最大化.
1.2.5 超临界萃取技术 超临界萃取技术(supercritical fluid extraction, SFE)是使用较为广泛的药物提取、分离手段,在药物成分提取方面有着重要的应用意义.王敏[22]通过试验对银杏叶黄酮的超临界萃取技术进行了优化,并且实现了萃取和分离一体化,其最佳参数为:CO2流速为20 L/h,乙醇体积分数为80%,乙醇夹带剂用量为100 mL/100 g银杏叶,萃取时间为2 h,萃取温度为45 ℃,萃取压力为30 MPa.在对锁阳黄酮化合物超临界二氧化碳的提取研究中,Luan N[23]通过实验找到了最佳提取参数:在粒度为0.180~0.250 mm筛,压力为30 MPa,温度为50 ℃,时间为75 min,酒精体积分数为50%,携带率为8%,通量二氧化碳为5 mL/min条件下,总黄酮的产率可达21.18%.
1.2.6 酶解法 酶解法(enzyme-assisted extraction, EAE)是通过酶的作用裂解植物细胞壁,使得植物次生代谢产物充分得到释放,从而提高药用成分得率一种分离提取方法.吴梅林[9]在研究银杏黄酮类化合物酶解法的提取条件中获得了黄酮类化合提取的最好条件,与传统的乙醇提取工艺相比,银杏总黄酮得率提高了18.92%.庞允[7]在研究银杏叶中黄酮的提取工艺时发现,酶解法同乙醇提取法相比,黄酮的提取率由1.29%提高为1.78%.刘晓光[24]采用酶解法对山楂中黄酮的提取工艺进行了研究,在酶质量浓度为0.15 mg/mL,酶解pH值为5.0,酶解温度55 ℃,酶解时间为90 min,料液比为1∶12 (质量比)时,提取效果最佳.该方法提取黄酮的得率可达90%,而且黄酮的生物活性保持良好.在酶解法中,酶种类的选择对提取效率也有一定的影响.林宣贤[25]分别用单一酶和复合酶方法对金樱子黄酮进行提取,结果发现,复合酶(纤维素酶+果胶酶+β-葡聚糖酶+半纤维素酶+木瓜蛋白酶)处理效果比单一酶要好,最后提取总黄酮产率真提高了26.2%.
2 黄酮类化合物主要分析方法
2.1 紫外分光光度法
紫外分光光度法(UV spectrophotometry)测定原理是:黄酮类化合物固有的结构可以与Al3+结合形成络合物,并且在不同条件下具有不同的紫外吸收峰,因此可以对不同的黄酮类化合物进行分析测定.张公亮[26]和齐曼丽[27]在研究中发现,黄酮类化合物直接与AlCl3络合时,在415 nm可以检测到总黄酮最高吸光值.而与Al(NO3)3作用时,在271 nm处可以检测到黄酮类化合物的最高吸收值,从而可以对其进行定量测定[28].吕红[29]在267 nm条件下直接测定银杏制剂中的黄酮含量,效果也较好.研究[30]发现,并不是所有的黄酮类化合物都能与铝盐发生络合.杜薇[31]在有醋酸钾或醋酸钠存在的条件下测定刺梨总黄酮含量,AlCl3与黄酮类化合物共存40 min后,可在420 nm处测定总黄酮的含量.张进棠[32]采用此法测定银杏中黄酮总含量时相对标准偏差为2.1%.同时,张兰杰[33]利用双波长法测得黑玉米花粉中总黄酮平均含量为3.53%.此法稳定可靠,重现性好.另外,肖福坤通过三波长分光光度法测定芹菜中总黄酮的质量分数质量分数为[34],回收率为96.8%~105.9%,变异系数小于0.49%,方法的准确度与精密度均令人满意,而且操作简便易行.
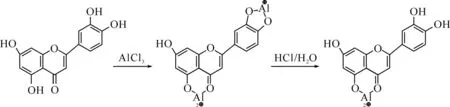
图2 AlCl3和AlCl3/HCl对黄酮紫外光谱的影响
2.2 传统色谱柱纯化
传统色谱柱纯化(Column purification)在分离纯化黄酮类化合物方面有着重要的作用.程秀丽[35]在研究罗布麻叶中黄酮类化合物时,采用聚酰胺柱、硅胶柱和Sephadex LH-20柱层析法对黄酮进行纯化,通过化学、波谱方法分离得到了8种黄酮类物质,并且鉴定出其中的5种化合物.徐小花[36]采用硅胶柱层析、Sephadex LH-20、重结晶等方法,在女贞子(Ligustrum lucidum Ait)果实中分离得到了芹菜素(Ⅰ)、大波斯菊苷(Ⅱ)、芹菜素-7-O-乙酰-β-D-葡萄糖苷(Ⅲ)、芹菜素-7-O-β-D-芦丁糖苷(Ⅳ)、木樨草素(Ⅴ)、木樨草素-7-O-β-D-葡萄糖苷(Ⅵ)、槲皮素(Ⅶ)等7种黄酮类化合物.在对连钱草黄酮化合物成分的研究中,杨念云[37]采用工业酒精提取、硅胶柱层析、ODS柱层析和重结晶相结合的方法,首次从连钱草中分离得到了芹菜素(1)、木犀草素(2)、芹菜素-7-O-葡萄糖醛酸乙酯苷(3)、木犀草素-7-O-葡萄糖醛酸乙酯苷(4)、大波斯菊苷(5)、木犀草素-7-O-葡萄糖苷(6)、山奈酚-3-O-芸香糖苷(7)、芦丁(8)、6-C-阿拉伯糖-8-C-葡萄糖-芹菜素(9)和6-C-葡萄糖-8-C-葡萄糖-芹菜素(10)等10种黄酮类化合物.
2.3 薄层色谱法
薄层色谱法(Thin layer chromatography, TLC).梁淑芳[38]在研究山楂时,采用十二烷基硫酸钠-正丁醇-正庚烷-水微乳液作为展开剂,利用聚酰胺薄层色谱法将山楂黄酮完全分离,总共获得了7个黄酮斑点.卫静莉[39]采用薄层色谱法对树脂纯化后的无梗五加果总黄酮进行了研究,发现薄层层析鉴定效果较好.郑大成[13]利用薄层色谱法和化学定性分析法对昆仑雪菊水溶性黄酮进行初步的色谱和化学鉴定,结果显示水提物经正丁醇萃取后,大部分黄酮类成分被转移至正丁醇层,该方法成功应用于昆仑雪菊水溶性总黄酮的制备.
2.4 高效液相色谱法
高效液相色谱法(High Performance Liquid Chromatography, HPLC)最早由俄国植物化学家茨维特(Tswett)1906年提出,后经过不断改进和创新现已得到广泛应用.在测定凤尾茶中黄酮的含量时陈海云[40]运用岛津LC-2010A,色谱柱为Agilent-Extend-RP柱,流动相甲醇-乙腈-0.2%(质量分数)磷酸,流速1.0 mL/min,紫外检测波长280 nm,在0.244~2.928 μg线性关系良好,回收效率较高.而贺云彪[41]在采用高效液相色谱法测定黄芪中毛蕊异黄酮和芒柄花素的含量时,借直观推导式演进特征投影(HELP)法分辨HPLC-DAD产生的二维数据得到毛蕊异黄酮的标准曲线为y=166.72x+127.8(r=0.999 7)线性范围为1.0~116.5 μg/mL;孟双明[42]运用高效液相色谱法对黄酮含量进行分离测定,得到了芦丁、曲克芦丁、黄芩苷、槲皮素的RSD分别为1.7%,2.0%,3.1%和3.9%.张宏武[43]采用Sunfire C18色谱柱(150 mm×4.6 mm,5 mm),以乙腈-0.1%(质量分数)磷酸溶液(体积比20∶80)为流动相,流速为1 mL·min-1,检测波长为283 nm,柱温为30 ℃时,测定枳壳饮片中柚皮芸香苷、柚皮苷、橙皮苷和新橙皮苷四种黄酮类化合物的平均回收率分别为96.6%,96.1%,96.0%和97.2%,此法快速、准确、重复性好.
2.5 其它分析方法
除了以上分离纯化方法外,还有其他一些方法应用较为广泛.张军[44]采用高效毛细管电泳法对不同桑品种的桑叶中,进行了黄酮类化合物的图谱建立,在25 ℃、20 kV的压力下进行电泳,245 nm波长处检测,线性关系良好.彭爱一[8]和余波[45]采用改进的高速逆流色谱法分离纯化几种黄酮类化合物,其纯化率分别达到了95%和97%以上.多种分离纯化技术的联用也使得分离测定效果更佳,谢建伟[10]运用色谱和光谱联用技术建立了4个产地黄芪中黄酮类化合物特征色谱指纹图谱,张语迟[12]采用高效液相色谱-电喷雾质谱(HPLC-ESI MS)联用技术分析了酶解前后黄酮化合物的活性,效果较为理想.
3 结 语
黄酮类化合物作为一大类植物次生代谢产物,不仅数量种类繁多,而且结构类型复杂多样,表现出多种多样的药理活性.科研工作者正在不断的完善各种分离纯化手段,为获得更好更多的黄酮类化合物或黄酮单体进行努力,鲍海鸥[46]等人对庐山的野生药用植物资源给出了分析和建议,张馨心[47]和郑有飞[48]就对黄酮的研究现状进行了分析.对黄酮类化合物分离检测纯化方法的深入研究将对黄酮类化合物的开发应用,药理活性研究等产生深远的影响.
参考文献:
[1] 郭军, 凌和平, 李良俊, 等.园艺作物黄酮类化合物研究进展[J].江苏农业学报, 2011,27(2): 430-436.
[2] 毕珣, 卢嘉文, 蔡东联.银杏及叶中黄酮类化合物生理功效的研究进展[J].武警医学, 2004, 15(6): 458-459.
[3] 李勇, 刘新民.银杏及叶中黄酮类化合物生理功效的研究进展[J].食品科技, 2001(5): 72-73.
[4] 吕红, 刘永琼, 张志清, 等.银杏叶缓释片的制备及体外释药动力学[J].武汉化工学院学报,2000, 22(1): 7-9.
[5] 肖艳华.从银杏叶中提取香豆槲皮素的研究[J].武汉化工学院学报, 1999,21(4):19-21.
[6] 张培成.黄酮化学[M].北京: 化学工业出版社, 2008: 1.
[7] 庞允, 杨建秀, 刘子兰.银杏叶中黄酮的提取工艺比较[J].制药技术, 2007, 16(3): 38-39.
[8] 彭爱一.高速逆流色谱分离纯化九里香中的黄酮类化合物[J].色谱, 2010, 28(4): 425-429.
[9] 吴梅林.酶法提取银杏黄酮类化合物研究[J].天然产物研究与开发, 2004, 16(6): 4.
[10] 谢建伟.黄芪中黄酮类化合物色谱指纹图谱的光谱相关色谱分析[J].光谱实验室, 2010, 27(2): 553-557.
[11] 张公亮.仙人掌黄酮类化合物的超声波提取和纯化[D].大连:大连轻工业学院生物与食品工程学院,2005.
[12] 张语迟.罗布麻叶黄酮类成分酶解前后的液相色谱-质谱分析及活性比较[J].分析测试学报, 2010, 29(10): 1073-1077.
[13] 郑大成.昆仑雪菊水溶性黄酮的制备及初步鉴定[J].亚太传统医药, 2010, 6(10): 18-20.
[14] 卢起来, 蔡文芬, 肖启慧.银杏叶中有效成分的提取 [J].武汉化工学院学报,1999, 21(3):1-3.
[15] 林启训.枇杷叶黄酮类化合物的水浸提工艺研究[J].农业工程学报, 2005, 21(7): 190-195.
[16] 肖坤福, 廖晓峰, 催艳娟, 等.多穗柯中黄酮类物质提取工艺的研究[J].食品科学, 2004, 25(5): 112-116.
[17] 刘银芳, 吴文倩, 刘春宇, 等.沙苑子黄酮提取工艺研究[J].时珍国医国药, 2010, 21(6): 1401-1403.
[18] 陈少峰, 池汝安, 田君.柴胡总黄酮提取条件优化及其动力学[J].武汉化工学院学报, 2006,28(3): 10-15.
[19] 卞杰松.超声波提取马鞭草中黄酮类化合物的工艺研究[J].时珍国医国药, 2009, 20(6): 1420-1421.
[20] 张培宇.微波-超声波协同萃取马齿苋中黄酮类化合物[J].中国药业, 2010, 19(21): 34-35.
[21] 谭静.微波萃取和超声波提取法提取柚皮中黄酮类化合物的对比[J].食品研究与开发, 2010, 31(2): 4.
[22] 王敏.银杏叶黄酮和多糖综合分离技术的研究[D].南京:南京农业大学食品科技学院, 2007.
[23] Luan N, Li D.Study on supercritical CO2extraction of flavonoids from Cynomorium songaricum[J].Journal of Chinese medicinal materials, 2010, 33(7): 1167-1171.
[24] 刘晓光.酶解法提取山楂黄酮的工艺[J].食品研究与开发, 2010, 31(8): 56-59.
[25] 林宣贤.酶法提取金樱子总黄酮的研究[J].中国食品添加剂, 2009(4): 117-121.
[26] 张公亮.仙人掌黄酮类化合物的超声波提取和纯化[J].食品与发酵工业, 2004, 30(12): 137-140,144.
[27] 齐曼丽, 何春松, 韩春敏.五味沙棘冲剂中总黄酮的含量测定[J].中国民族医药杂志, 2000, 6(12): 18-20.
[28] 席荣英.半枝莲中总黄酮含量测定[J].新乡医学院学报, 2003, 20(1): 29-30.
[29] 吕红.紫外分光光度法测定银杏制剂黄酮含量[J].武汉化工学院学报, 2000,22(3):3-4,7.
[30] 王淑杰.双波长紫外分光光度法测定甘草中总黄酮的含量[J].宁夏医学院学报, 2005, 27(6): 506-508.
[31] 杜薇.刺梨中微量元素和总黄酮的含量测定[J].中国医院药学杂志, 2003, 23(9): 530-532.
[32] 张进棠, 姚本林, 刘伏煌, 等.银杏叶提取物中总黄酮的紫外分光光度测定[J].武汉化工学院学报,1998(1):26-28.
[33] 张兰杰.双波长分光光度法测定黑玉米花粉中总黄酮的含量[J].食品科学, 2006, 27(2): 230-232.
[34] 肖坤福.三波长分光光度法测定芹菜叶中黄酮的含量[J].食品研究与开发, 2005, 26(4): 134-136.
[35] 程秀丽.罗布麻叶中黄酮类化合物研究[J].中药材, 2007, 30(9): 1086-1088.
[36] 徐小花.女贞子黄酮类化合物的研究[J].中药材, 2007, 30(5): 538-540.
[37] 杨念云.连钱草中的黄酮类化学成分[J].中国药科大学学报, 2005, 36(3): 210-212.
[38] 梁淑芳.山楂黄酮的薄层色谱分离鉴定研究[J].林产化学与工业, 2003, 23(4): 86-88.
[39] 卫静莉.柿叶提取黄酮类化合物方法及鉴定[J].林业科技开发, 2007, 21(3): 47-49.
[40] 陈海云, 樊建, 曹建新.高效液相色谱测定凤尾茶中黄酮的含量[J].中国中药杂志, 2007, 32(22): 2385-2389.
[41] 贺云彪, 黄兰芳, 胡伟, 等.高效液相色谱测定黄芪中毛蕊异黄酮和芒柄花素的含量[J].光谱实验室, 2010, 27(4): 1541-1548.
[42] 孟双明.高效液相色谱法测定中党参中4种黄酮类物质的含量[J].分析化学, 2009, 37(A02): 244.
[43] 张宏武.高效液相色谱法同时测定枳壳饮片中4种黄酮类化合物的含量[J].中国新药杂志, 2008, 17(18): 1600-1602,1621.
[44] 张军.采用高效毛细管电泳法建立不同桑品种桑叶黄酮类化合物指纹图谱的试验[J].蚕业科学, 2008, 34(1): 119-123.
[45] 于波.高速逆流色谱法分离纯化青皮中六种多甲氧基黄酮[J].天然产物研究与开发, 2010, 22(3): 383-387.
[46] 鲍海鸥, 庄国梁, 陈波红, 等.庐山野生药用植物资源[J].江西林业科技, 2010(1):14-17.
[47] 张馨心.黄酮的研究现状[J].广州化学, 2009,34:69-74.
[48] 郑有飞.天然黄酮物质提取技术和分析方法的研究进展[J].分析科学学报, 2009, 25(1): 102-107.

