产铁载体PG PR菌筛选及其对病原菌的拮抗作用
荣良燕, 姚 拓*, 赵桂琴, 柴 强, 席琳乔, 王小利
(1.甘肃农业大学草业学院,兰州 730070; 2.草业生态系统教育部重点实验室,兰州 730070;3.甘肃农业大学农学院,兰州 730070; 4.塔里木大学动物科技学院,阿拉尔 843300;5.贵州省草业研究所,独山 558200)
促进植物生长菌(plant growth promoting rhizobacteria,简称PGPR)是指自由生活在土壤或附生于植物根、茎、叶的一类可促进植物生长及其对矿质营养吸收和利用,并能抑制有害微生物的有益菌类[1]。铁元素虽在地壳中含量较高,但由于地球的富氧环境,铁的氧化物以溶解度极低的形式存在,不易直接被植物吸收利用。铁载体(siderophores)是一类具有很强的特异螯合Fe3+(螯合系数可达1 020~1 030)的小分子(1~2 ku)化合物[2-3],许多植物根际微生物可通过合成这类物质来摄取环境中的铁,并将多余的铁提供给植物利用,可以与植物根际铁载体产量很小的有害病原菌竞争铁元素,进而抑制有害微生物的生长和繁殖[4]。目前应用最为普遍的细菌铁载体检测方法是Schwyn与Neilands于1987年建立的CAS检测体系(chromeazurol sulfonate assay),适用于许多不同类型铁载体的检测[5],且CAS染液对G-细菌毒性较小,还能用于G-细菌铁载体固体平板检测[6]。本研究利用改进的CAS检测方法[6]从16株PGPR菌株中选出具有铁载体分泌能力的菌株,并与植物病原真菌进行拮抗作用测定,以期筛选出较强抗病的促生菌株,服务于农业生产。
1 材料与方法
1.1 材料
1.1.1 LB培养基配方
1 L培养基中含:葡萄糖10 g,酵母膏5 g,NaCl 5~10 g,琼脂 15~20 g,pH7.0。
1.1.2 SA液体培养基配方
1 L培养基中含:蔗糖 20.0 g、L-天门冬酰胺2.0 g、K2HPO40.5 g、MgSO4◦7H2O 0.5 g;8-羟基喹啉除铁后,无外加铁离子,其本底铁离子浓度约为 0.16 μ mol/L,pH7.0[7]。
1.1.3 CAS检测平板配方
CAS染液配制:1 mmol/L CAS(铬天青),0.1 mmol/L FeCl3,4 mmol/L十六烷基三甲基溴化胺(HDTMA)[5,8],0.1 mol/L磷酸盐缓冲液,pH6.8[6]。
0.1 mol/L磷酸盐缓冲液pH6.8的配制:每100 mL含Na2HPO4◦12H2O 2.427 g,NaH2PO4◦2H2O 0.590 5 g,KH2PO40.075 g,NH4Cl 0.250 g,NaCl 0.125 g,使用时10倍稀释[6]。
CAS检测平板的配制:每100 mL含20%蔗糖溶液1 mL,10%酸水解酪素3 mL,1 mmol/L CaCl2100 μ L,1 mmol/L MgSO42 mL,琼脂 1.8 g[6]。
在约60℃时缓慢加入0.1 mol/L磷酸盐缓冲液和CAS染液各5 mL,混合均匀即得蓝色检测平板[6]。所有溶液均用去离子水配制,具体用量视所需制备平板个数及所需药品含量换算后添加,可以将用量少的溶液先制成母液而后在使用时定容至所需浓度。定性定量试验中所用玻璃器皿均用6 mol/L的HCl浸泡并用蒸馏水冲洗数遍进行脱铁处理。
1.1.4 PDA固体培养基配方
1 L培养基中含:马铃薯200 g,葡萄糖15~20 g,琼脂17~20 g。
1.1.5 PGPR菌株
从兰州三叶草、苜蓿和燕麦根际筛选出具溶磷、固氮和分泌植物生长激素特性的细菌。编号为191,92,170,LS1-1,LS1-2,LS3,LS13,LHS4-1,LHS4-2,LHS8,LHS9,LHS11,LHS14,LH11,LH13-3,LM4-3,由甘肃农业大学草业学院草地微生物多样性实验室提供。
1.1.6 病原真菌
立枯丝核菌(Rhizoctonia solani),黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum),西瓜枯萎病菌(F.oxysporum f.sp.niveum),由甘肃农业大学草业学院植病系徐秉良教授、陈秀蓉教授提供。
1.2 方法
1.2.1 铁载体定性检测方法
将保存在LB斜面上的PGPR菌株转接到LB平板上培养24~48 h后,采用点接种法,用灭菌的牙签将菌种接在CAS固体检测平板上,一皿4个点,一个菌3个重复,28℃培养48 h,并在培养箱中放盛有水的烧杯2个以保持一定的湿度。经过培养的CAS检测平板上,分泌铁载体的细菌菌落周围会出现明显的橙色铁载体晕圈。经观察后每个平板上菌落形态有差别,晕圈大小和颜色深浅不同,观察平板上橙黄色透明圈的产生和大小、颜色,并记录。同时,通过计算晕圈比例,即可溶性指数[9],来对其分泌铁载体能力进行比较分析,以判断产铁载体能力强的菌株。
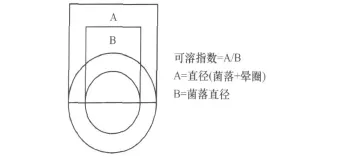
图1 可溶性指数的计算方法
1.2.2 定量检测方法
用铂金丝接种新鲜菌种于限铁SA液体(0.16 μ mol/L FeCl3)培养基中,28 ℃摇床培养(150 r/min)48 h;菌悬液经10 000 r/min离心15 min,取上清液,菌液和CAS检测液1∶1的体积充分混匀,静止1 h后,测定630 nm[10]波长处的吸光值(As),取双蒸水作为对照调零,以同法测定的未接种的SA液体培养基的吸光值作为参比值(Ar),并按Machuca和Miliagres的方法[11]计算铁载体活性单位([(Ar-As)/Ar]×100)。
1.2.3 产铁载体菌与病原真菌拮抗作用测定
将定性和定量检测筛选出的优良菌株,采用平板对峙法测定其与病原真菌的拮抗作用。将保存在PDA斜面上的病原真菌接种到PDA平板上,25℃培养5~7 d。细菌接种在LB液体培养基中,150 r/min,培养48 h,细菌菌液浓度 106μ g/mL备用。再将真菌与细菌同时接种在PDA平板上,平板中心接种真菌,菌饼直径为6 mm;距中心1.7~1.8 cm处接种细菌,采用滴下法(即用加液枪,将菌液垂直滴加在培养基平面上),每种组合3个重复。25℃培养6 d,测量真菌距细菌远端和近端的半径。
2 结果与分析
2.1 产铁载体PGPR菌初选
固体CAS培养基呈现天蓝色的固态胶状,通过点接种培养得到菌落,当细菌分泌铁载体时会在菌落周围形成黄色晕圈(图2),与蓝色形成对比,其产生黄色晕圈越大,说明该菌株产铁载体能力越强。本研究的16株PGPR菌株在CAS检测平板上菌落大小及产铁载体情况见表1。
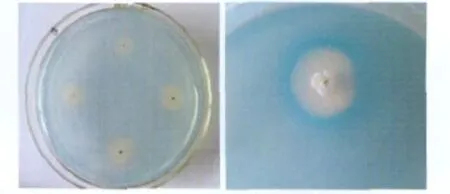
图2 PGPR菌产铁载体的初选(图为菌株LHS11)
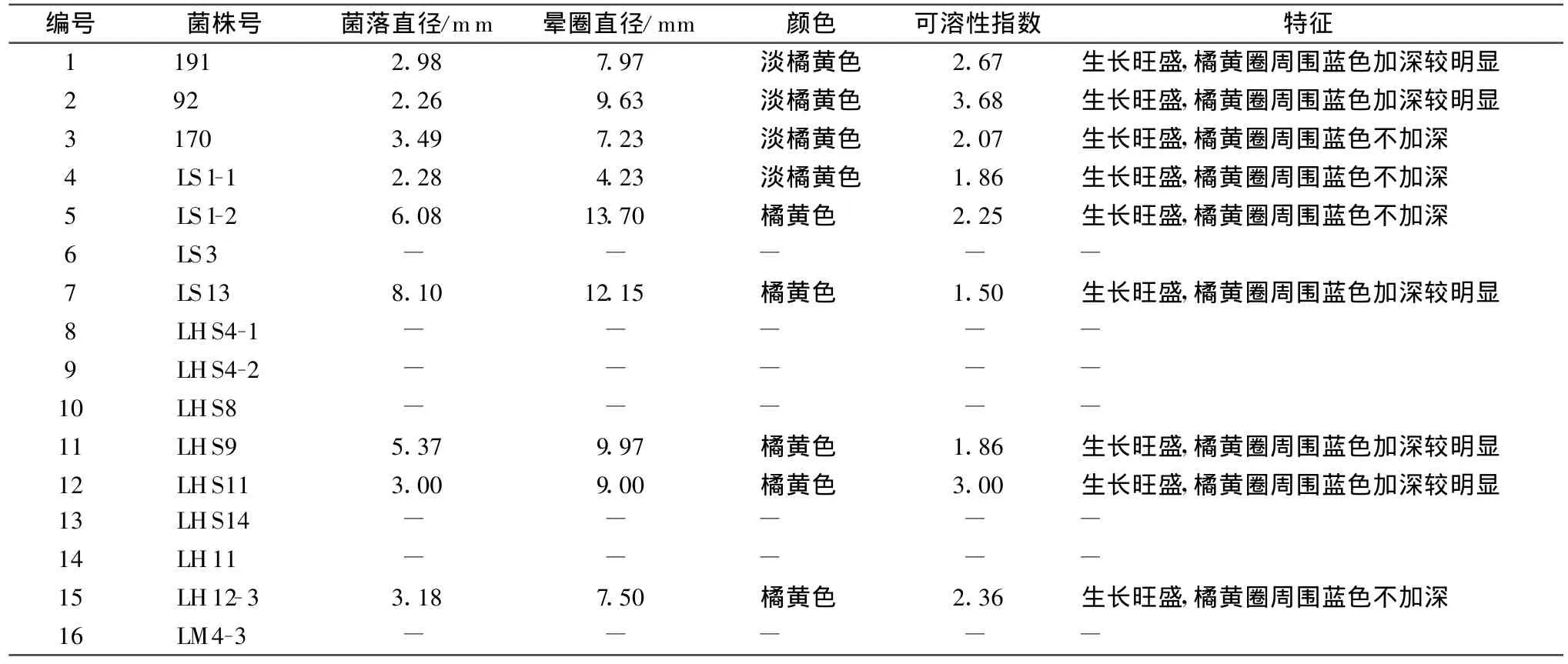
表1 CAS检测平板上菌落大小、晕圈直径及其他特征1)
从表1可看出,16株被测菌株中有9株在CAS检测平板上可以生长并产生橘黄色晕圈,晕圈从大到小分别为 LS1-2、LS13、LHS9、92、LHS11、191、LH12-3、170 和 LS1-1。晕圈颜色深浅不一,橘黄圈周围的蓝色也深浅不同。同时计算可溶性指数,值越大,其分泌的铁载体在培养基中的分布范围越大,即其在相同培养条件和时间下产生铁载体能力越强。本研究供试菌株中可溶性指数>2,从大到小依次为92,LHS11,191,LH12-3,LS1-2和170(表1)。
2.2 产铁载体PGPR菌复选
由于定性测定是根据晕圈直径、可溶性指数和晕圈颜色等指标进行的,该方法存在一定的局限性,如有的菌株的菌落较小但是其产生的变色晕圈的范围大,具有在相对较短的时间内产生较多铁载体的能力,如:92、LHS11。有的菌落大小与一般产铁载体细菌菌落无明显差异但是其分泌能力稍强于该样中其他各菌,如 191、LH12-3、LS1-2、170。因此 ,为了较为准确测定其产铁载体的能力,对可溶性指数>2的菌株进行了定量复选,其结果见表2。
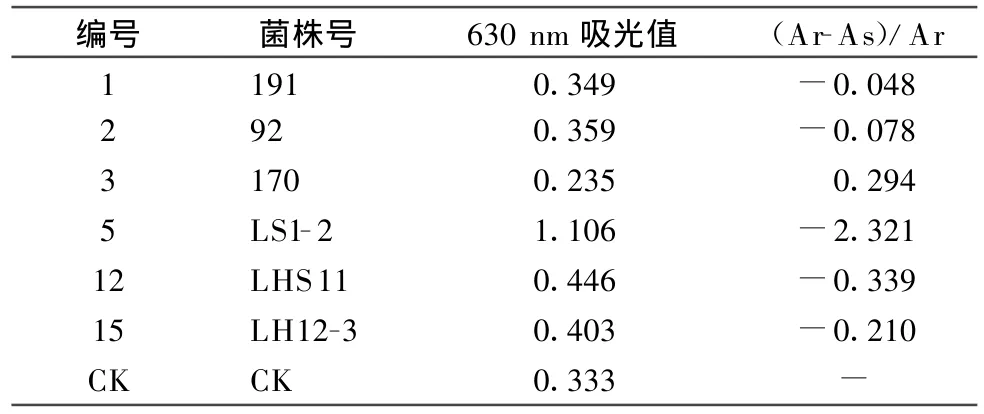
表2 各离心菌样在630 nm波长处的吸光值及铁载体活性单位
细菌分泌的铁载体用CAS检测液检测时,在630 nm处的光吸收值最大,因此测定 A630 nm值的大小可以很好地反映溶液中铁载体的含量,A630nm值越大则铁载体含量越高,反之亦然。根据所测数据的大小可判断出各个菌分泌铁载体能力的大小,其顺序为 LS1-2>LHS11>LH12-3>92>191>170(表2)。但是CAS检测液的吸收值在不同pH条件下极易产生偏差[12],而细菌培养液样品pH变化较大,所以使得所测数据偏差较大。该种检测方法对铁载体的定量可以通过 A/Ar值的降低来衡量。A/Ar代表样品中铁载体的相对含量,该值越低,表明铁载体含量越高,从小到大依次为 LS1-2>LHS11>LH12-3>92>191>170(表2)。
2.3 产铁载体菌与病原真菌拮抗作用测定
将5株经过定性、定量检测产铁载体量较高的PGPR菌株与3株供试病原真菌分别进行拮抗作用测定,第3、6天测量真菌距细菌远端和近端的半径,细菌对病原真菌的抑菌率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%,抑菌率越高,细菌对真菌的抑制作用越高。进一步计算PGPR菌对3种病原菌的抑菌率,结果见图3、表3。

图3 PGPR菌与真菌拮抗
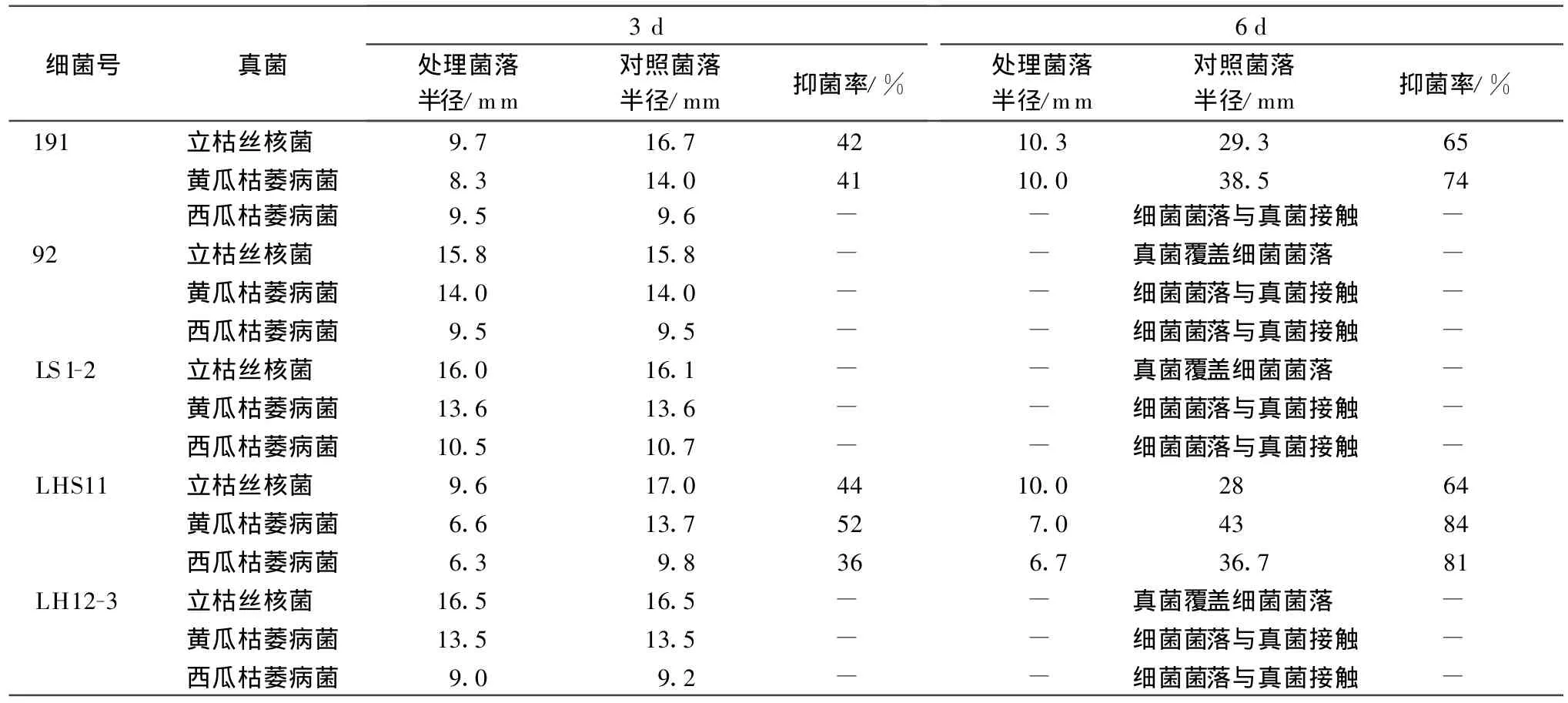
表3 PGPR菌与真菌拮抗及抑菌率
从表3可以看出,供试PGPR菌株191对立枯丝核菌和黄瓜枯萎病菌、LHS11对立枯丝核菌、黄瓜枯萎病菌和西瓜枯萎病菌均有较好的抑制作用。在3 d时,LHS11对黄瓜枯萎病菌的抑制作用最好,抑菌率为53%,191对棉花立枯丝核菌、黄瓜枯萎病菌,LHS11对棉花立枯丝核菌的抑制作用相差不多,在41%~44%之间。5种组合中,除菌株191和LHS11外,其他3株PGPR对病原菌几乎没有抑制作用。在6 d时,LHS11对黄瓜枯萎病菌和西瓜枯萎病菌的抑制作用最好,达到了 80%以上,其中LHS11对黄瓜枯萎病菌的抑菌率最高,达到84%。其次是191对黄瓜枯萎病菌,抑菌率为74%,191和LHS11对立枯丝核菌的抑制作用相差不多,抑菌率为64%~65%。LHS11对黄瓜枯萎病菌的抑制效果在3 d和6 d时都最好,LHS11对西瓜枯萎病菌的抑制效果在3 d较低,但到6 d时效果加强,191和LHS11对立枯丝核菌的抑制作用在3 d时较好,随时间推后作用降低。其余PGPR菌落的边缘与真菌菌丝接触或真菌菌丝覆盖了其菌落,说明这3株PGPR菌对提供的3株病原真菌无拮抗作用。
3 结论
3.1 铁载体分泌能力
16株被测菌株中有9株在CAS检测平板上可以生长并产生橘黄色晕圈,为 LS1-2、LS13、LHS9、92、LHS11、191、LH12-3 、170 和 LS1-1,初步确定这些PGPR菌株可以产生铁载体。结合可溶性指数及定量检测中630 nm波长处的吸光值和铁载体活性单位,测定及计算出产铁载体的能力从大到小的菌株依次为 LS1-2 、LHS11、LH12-3、92、191。
3.2 产铁载体菌对病原真菌拮抗作用
在平板对峙拮抗试验中菌株191和LHS11对供试的病原真菌均有较好的抑制作用,其中LHS11对黄瓜枯萎病菌,西瓜枯萎病菌的抑制作用最好,LHS11对黄瓜枯萎病菌的抑菌率达到了84%。其次是191对黄瓜枯萎病菌的拮抗作用,抑菌率为74%。191和LHS11对棉花立枯丝核菌的抑制作用相近,抑菌率在64%~65%之间。
4 讨论
试验中选用了指示性较强的CAS培养基作为产铁载体鉴定、菌筛的首选,当高铁螯合能力的铁载体从有络天青、铁离子和十六氨基烷基溴化铵形成的CAS蓝色检测液中夺取了铁离子时,检测液即会发生明显的由蓝到橙的颜色改变,但是络天青在不同pH条件下会显示出不同的颜色,所以配置的固体培养基选用了改进后的CAS固体检测培养基,即采用了pH 6.8的磷酸缓冲液代替了原来的MM9缓冲体系[6],1994年王平[13]采用通用的CAS检测方法检测到了小麦根圈细菌的铁载体分泌。作者运用类似的方法进行了产铁载体菌的筛选,并对其中效果好的菌株与植物病原真菌进行拮抗试验,筛选出2株对3种植物病原真菌有抑制作用的生防菌。
某些荧光假单胞杆菌及其产生的拮抗物质可抑制一些植物病原真菌,国内外研究证实假单胞菌产生的铁载体在防治土传真菌病害方面发挥着重要作用[14]。本试验从已筛选出的具溶磷、固氮及分泌植物生长激素能力的细菌中继续进行产铁载体能力的筛选。在定性、定量试验中筛选出5株,将其分别与病原真菌进行拮抗试验。在定量试验中菌株 LS1-2的效果最好,菌株191的效果列最后,但在与病原真菌拮抗试验中LS1-2的优势却没有显示出来,LHS11和191成为对病原真菌抑制作用最好的菌株。实际上,细菌对病原真菌的拮抗作用是由其产生的拮抗物质来决定的,铁载体只是其中可能的一类拮抗物质。从本研究的结果来看,菌株 LS1-2、LH12-3、92均产生铁载体,但是其无抗病原菌的活性,可以初步得出菌株LS1-2产生铁载体与其抗菌活性没有必然关系。这一研究结果与Laine等人测定了CAS法对细菌产铁载体量和拮抗病原菌能力的相关性,发现两者之间并不是正相关,有的细菌产铁载体量虽然较多,但并非在实际中可以很好地抑制某种病原真菌[15]的结果相似。因此,本研究中对病原真菌抑制作用最好的菌株(如LHS11和191)其抑菌机理跟产生铁载体是存在必然联系,还是偶然巧合,抑或另有其他抗菌物质产生尚需做进一步的研究来证实,相关研究正在进行中。
[1]Malik K A,Rakhshanda B.Association of nitrogen-fixing plant g rowth promoting Rhizobacteria(PGP R)with Kallar grass and rice[J].Plant and Soil,1997,194:37-44.
[2]Simon C A,Andrea K R,Francisco R Q.Bacterial iron homeostasis[J].FEMS Microbiol Rev,2003,27:215-237.
[3]Shelley M P.Detection,isolation,and characterization of siderophores[J].Methods in Enzymology,1994,235:329-344.
[4]Kloepper J W,John L,Teintze M.Enhanced plant growth by siderophores produced by plant growth-promoting Rhizobacteria[J].Nature,1980,286:885-886.
[5]Schwyn B,Neilands J B.Universal chemical assay for the detection and determination of siderophores[J].Analytical Biochemistry,1987,160:47-56.
[6]赵翔,谢志翔,陈绍兴,等.适合高产铁载体细菌筛选、检测体系的改进与探析[J].微生物学通报,2006,33(6):13-18.
[7]Fekete F A.Assays for microbial siderophores[M]∥Iron chelation in plants and microorganisms.New York:A cademic P ress,1993,(6):399-417.
[8]Neilands J B.Siderophore:Structure and function of microbial iron transpo rt compounds[J].J Bioll Chem,1995,270(45):26723-26726.
[9]赵翔,陈绍兴.产高铁载体荧光假单胞菌Pseudomonas f luorescens sp-f的筛选鉴定及其铁载体特性研究[J].微生物学报,2006,46(50):691-695.
[10]陈绍兴.细菌铁载体检测方法[J].红河学院学报,2005,3(6):16-18.
[11]徐金娥,滕忠才,张秀敏.微生物生态学中定量分析技术的应用进展[J].保定师范专科学校学报,2005(4):25-30.
[12]谢小军.铁载体—细菌营养竞争的有力武器[J].微生物学通报,2007(5):45-51.
[13]王平,董飚,李阜慄,等.小麦根圈细菌铁载体的检测[J].微生物学报,1994,21(6):323-326.
[14]田方,丁延芹,朱辉,等.烟草根际铁载体产生菌G-229-21T的筛选、鉴定及拮抗机理[J].微生物学报,2008,48(5):631-636.
[15]Manninen M,Mattila-Sandholm T.Mmethods for the detection Pseudomonas siderophores[J].J Microbiol Methods,1994,19:223-234.

