甜瓜白粉病内生拮抗细菌的筛选鉴定及其防治效果的研究
马英元, 栾非时, 马鸿艳, 王学征
(东北农业大学园艺学院,哈尔滨 150030)
白粉病是甜瓜作物上广泛发生的一种严重的世界性病害[1]。该病从苗期到成株期均可危害,严重降低了甜瓜品质和产量,在生产上造成了很大的经济损失。随着设施瓜类栽培面积的逐年扩大,白粉病的危害范围也更加广泛。目前,白粉病已成为我国瓜类蔬菜无公害生产的主要障碍之一[2]。多年来,国内外众多研究者对白粉病的防治展开了一系列研究,提出了各种防治措施。而生物防治以其安全、高效及无污染等特点已经成为植物病害防治的重要途径[3]。许多研究证明,健康植物体内存在大量的内生细菌,它们是植物病害生物防治的潜在资源菌[4-5],具有潜在的应用和开发价值。国内外已有报道用真菌、土壤拮抗细菌及放线菌等[6-8]来防治白粉病,但利用内生细菌防治甜瓜白粉病的报道还较少。本研究旨在从高抗甜瓜品种的植株内分离筛选出对该病害有较好防效的菌株,以期为甜瓜白粉病生物防治探寻新途径。
1 材料与方法
1.1 试验材料
甜瓜白粉病病原菌[Sphaerotheca fuliginea(Sch lecht.ex Fr.)Po ll]为东北农业大学西甜瓜遗传育种研究室分离保存S.fuliginea 1号生理小种。
细菌培养采用NA培养基,液体培养采用NB培养基。
甜瓜抗病品种‘MR-1’为内生细菌的分离材料;甜瓜感病品种‘甜帅’用于室内盆栽试验筛选菌株。
1.2 内生细菌的分离、纯化及其发酵液的制备
采集健康无病的甜瓜高抗白粉病品种‘MR-1’植株,按照常规无菌操作进行内生细菌的分离。将植株用水冲洗干净后,取适量的根、茎、叶组织剪碎后,在75%乙醇中浸泡1 min,然后在0.1%升汞溶液中浸泡60~180 s,再放入75%乙醇浸泡30 s,取出后用无菌水冲洗4次。在无菌研钵内加入10 ML无菌水和少量灭过菌的石英砂研磨成匀浆,加盖静置30 min,吸取0.1ML于NA平板上,涂抹均匀后置于32℃培养箱中,培养48 h后,根据菌落形态、颜色和大小选取不同菌落在平板上进行纯化保存。以组织消毒后用无菌水第4次冲洗液作为空白对照(CK),涂皿,3 d后如有菌落生成,表明消毒不彻底,弃去;若CK中无菌落,则研磨液中长出的菌是内生细菌,进行纯化培养后,于4℃冰箱保存备用。
将分离纯化到的细菌菌株转接在NA斜面培养基上,24 h后接在装有NB液体培养基的三角瓶(100 ML/250 ML)中,在恒温摇床上培养48 h(170 r/min,28℃),得到的发酵原液用已灭菌的蒸馏水适量稀释后,采用平板菌落计数法将原液制成菌体含量为108cfu/ML的发酵液。
1.3 温室盆栽试验筛选内生拮抗菌
将预先制好的内生细菌发酵液(108cfu/ML)喷洒在‘甜帅’三叶期幼苗叶片上,24 h后,接种甜瓜白粉病病原菌孢子悬浮液(106个/ML),20~24℃下保湿24 h。每处理5株幼苗,4次重复,以喷清水为对照。7~12 d后待对照充分发病,进行病情调查并按公式计算病情指数和防治效果[9]。

1.4 叶盘复筛试验
对温室试验中筛选出的防治效果明显的菌株进行叶盘漂浮法复筛。用直径15mm打孔器从健康‘甜帅’幼叶上切下叶盘,在内生细菌发酵液(108cfu/ML)中浸湿后晾干,正面朝上悬浮在加有苯胼咪唑(25mg/L)的无菌水表面。将保存在幼苗上的白粉菌孢子抖落在悬浮叶盘上,盖上培养皿盖,置入光照培养箱(22℃,光照16 h/d)。每9个叶盘为1个处理,重复3次,以清水为对照。7~10 d后参照王美英等[8]分级标准调查病斑面积,并计算病情指数和防治效果。
1.5 内生拮抗菌对白粉菌孢子萌发和产孢量的影响
对上述两种方法筛选到的拮抗菌株,采用叶盘法进行试验(同 1.4),将培养皿置入光照培养箱(22℃,光照L∥D=16 h∥8 h)中。接种白粉菌后于不同时间取样,用考马斯亮蓝染色法[10]在光学显微镜下观察,统计不同拮抗菌处理后离体叶盘上白粉菌孢子萌发率。分生孢子形成数量参照D.Romeroa等[11]方法进行统计,即取处理10 d后的叶盘置于0.02%Tween溶液中,然后停靠在漩涡仪上30 s,将叶盘上的分生孢子打散。用血球计数板在光学显微镜下计数(分生孢子数/mm2)。
1.6 扫描电镜观察菌株Mg15对甜瓜白粉菌的作用
采用叶盘法进行试验(同1.4),经菌株Mg15发酵液(108cfu/ML)处理过的叶盘,接种白粉菌后于不同时间取样,按扫描电镜常规方法[12]制样后,在JEOL-6360型扫描电镜下观察,以清水处理为对照。
1.7 拮抗菌株Mg15温室防病效果测定
取‘甜帅’4片真叶期幼苗,分别用Mg15原液和稀释5倍、10倍、20倍液喷雾,每株15ML,24 h后接种白粉病菌。每个处理5株,3次重复,7~12 d后待对照充分发病,进行病情调查并计算防治效果。
1.8 拮抗菌株Mg15的鉴定
1.8.1 生理生化及形态鉴定
参照《伯杰细菌鉴定手册》〈第 8版〉[13]和《常见细菌系统鉴定手册》[14]利用形态学和生理生化方法对拮抗菌株Mg15进行鉴定。
1.8.2 分子生物学鉴定
采用CTAB法[15]提取菌株 Mg15基因组DNA,根据原核生物16S rDNA保守序列通用引物进行PCR扩增,引物序列为 R:5′-ACGGCTACCTTGTTACGACT-3′;F :5′-AGAGTTTGATCCTGGCTCAG-3′。将PCR产物回收后,与 PMD19-T载体连接,转化大肠杆菌DH 5α感受态细胞,在含氨苄抗性平板上筛选白色菌落,提取质粒DNA验证阳性克隆,测序,将测定的序列用BLAST软件在Gen-Bank中与已登录的16S rDNA进行同源性比较,随后用DNASTAR5.0软件进行多序列比对,构建系统发育进化树。
1.9 数据分析方法
试验结果采用DPS软件(7.55)进行统计分析,采用Duncan’s新复极差法进行多重比较,以不同小写英文字母表示在p=0.05水平上有显著性差异,大写英文字母表示p=0.01水平上有显著性差异。
2 结果与分析
2.1 甜瓜内生细菌的分离及温室盆栽防病效果
根据菌落形态、颜色、大小的不同,从甜瓜高抗白粉病品种‘MR-1’不同组织中共分离纯化到31株内生细菌,其中从根中分离到17株,茎中10株,叶片中 4株,分别编号为 Mg1~Mg17,Mj1~Mj10,My1~My4。对31株内生细菌展开温室盆栽筛选试验,结果表明:各菌株的防效在5.38%~74.3%之间不等,其中防效在40%以上的有8株(表1),占总筛选菌株数的25.8%。差异显著性分析结果表明,菌株 Mg2、Mg9、Mg 14、Mg15 和Mj8防治效果明显好于其他菌株,其中Mg15防效最好,达到 74.3%。
2.2 内生细菌不同菌株对甜瓜白粉病的叶盘法防治效果
对温室盆栽初步筛选出的5株内生菌进行叶盘法试验,结果如表 2所示。5株菌处理后甜瓜叶盘上白粉病病情指数为32.59~53.02,与空白对照之间存在显著差异,说明这5株内生菌对白粉病均有一定拮抗作用,但各菌株之间拮抗作用有强弱差异,Mg15的防效最好(图 1),达到 63%,与菌株 Mg2、Mg9、Mg14和Mj8存在显著差异。

表1 不同内生细菌菌株对甜瓜白粉病的温室盆栽防病效果1)
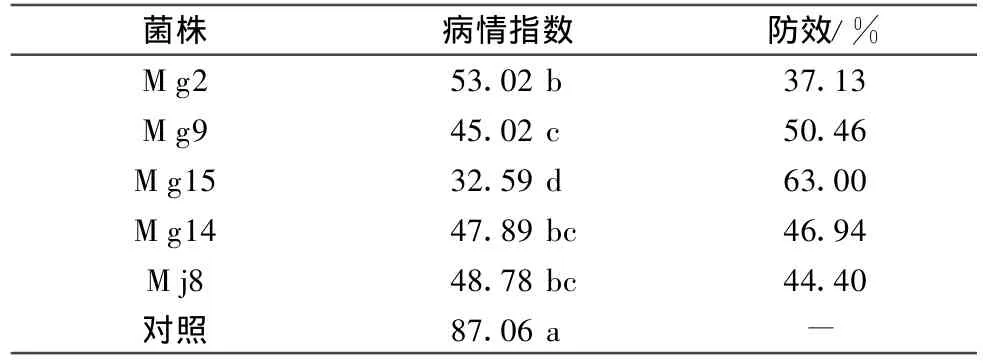
表2 不同内生细菌菌株对甜瓜白粉病叶盘法防治效果1)

图1 叶盘法测定菌株Mg15对甜瓜白粉病防治效果
2.3 内生拮抗菌对白粉菌孢子萌发和产孢量的影响
通过叶盘法试验,在光学显微镜下观察发现(表3),经5株内生拮抗菌的发酵液处理12 h后,叶盘上白粉菌孢子萌发率显著低于空白对照,其中菌株Mg15对白粉菌孢子抑制作用最强,孢子萌发率仅为9.29%。另外,5株拮抗菌对叶盘上白粉菌孢子生成量也有一定影响,处理组孢子生成量均低于对照组,其中Mg15处理过的叶盘上孢子生成量仅为189.22个/mm2,与对照相比降低了60%,并且显著低于其他4株菌株处理效果。
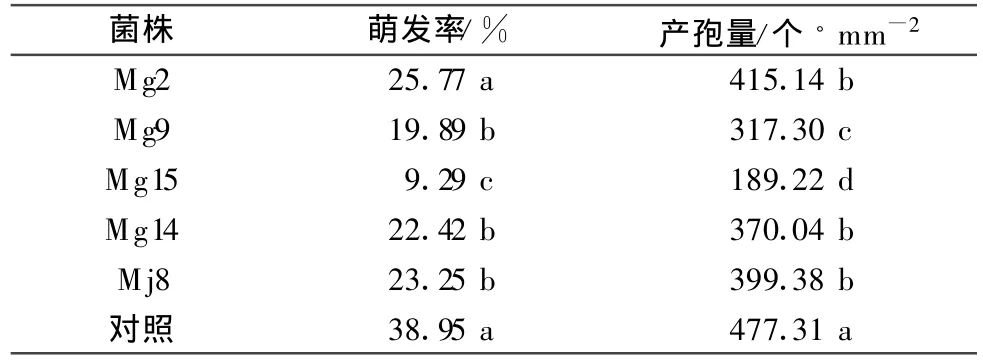
表3 不同内生拮抗菌株处理对离体叶盘上白粉菌孢子萌发和产孢量的影响1)
2.4 扫描电镜观察菌株Mg15对甜瓜白粉菌的作用
在扫描电镜下观察发现,在拮抗菌株Mg15发酵液作用下,白粉菌孢子不萌发或萌发后菌丝不能正常生长,与对照相比(图2a、d),菌丝和分生孢子梗皱缩(图2b、e),有的菌丝中间扭曲膨大,发生畸变(图2c),说明Mg15发酵液能严重影响白粉菌的正常生长发育和扩展。
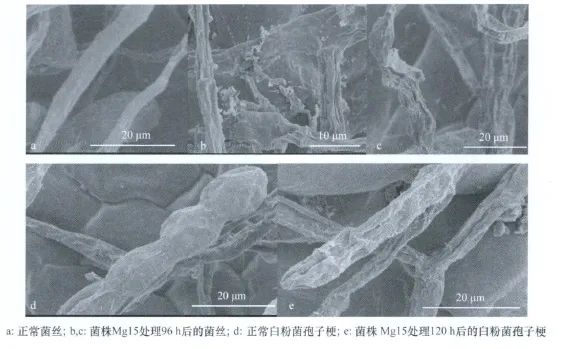
图2 扫描电镜观察拮抗菌株Mg15发酵液对离体叶片上白粉菌的影响
2.5 拮抗菌株Mg15对温室甜瓜白粉病的防治效果
菌株Mg15的发酵原液、稀释5倍、10倍、20倍防治效果如图3所示,由图可以看出,不同稀释倍数的拮抗内生细菌Mg15发酵液对甜瓜白粉病均有一定防治效果。其中Mg15发酵原液防效达到80.66%,随着发酵液稀释倍数的增加,防治效果逐渐降低。
2.6 拮抗菌株Mg15的鉴定
2.6.1 生理生化及形态鉴定
拮抗菌株Mg15菌体为杆状,菌落乳白色、圆形,有的中央隆起,革兰氏染色阳性,产芽胞,经生理生化特性鉴定(表4),初步确定Mg15菌株为枯草芽胞杆菌(Bacillussubtilis)。
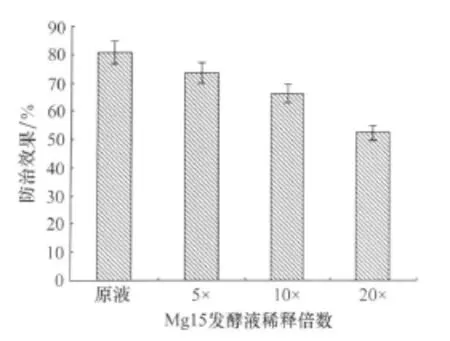
图3 不同浓度Mg15发酵液对温室甜瓜白粉病的防治效果
2.6.2 分子生物学鉴定
菌株Mg15经16S rDNA保守序列通用引物PCR扩增后,产物长度约为1.5 kb,经测序,通过用Blast程序对该序列和GenBank中已登录的 16S rDNA序列进行同源性比较,对比结果发现,与多株枯草芽胞杆菌的16S rDNA核苷酸序列的同源性均在99%以上,把比对结果中相似性较高菌株的序列与供试拮抗菌的序列一起用DNASTAR软件建立系统发育树(图4)。结果显示,Mg15与枯草芽胞杆菌(登录号为EU266071.1)的遗传距离最近。结合生理生化鉴定结果,确定菌株Mg15为枯草芽胞杆菌(Bacillussubtilis)。

表4 Mg15菌株的生理生化鉴定1)

图4 菌株Mg15及相关菌株的16S rDNA系统发育树
3 讨论
植物内生细菌(endophy tic bacteria)是指能在健康植物组织内栖居而对植物不造成实质性危害并与植物建立了和谐联合关系的细菌[16]。它是植物体内种类和数量最多的微生物,具有在植株体内分布广、定殖能力强、防效好以及增殖和扩散快等优点,因而成为发展前景很好的植物病害生防菌[17]。
本研究根据内生细菌的生防优势,从高抗甜瓜白粉病品种‘MR-1’中分离到内生菌31株,通过温室盆栽试验和叶盘法试验筛选出对甜瓜白粉病拮抗作用最强的菌株为Mg15,盆栽试验防效达到74.3%。叶盘法筛选比温室初筛试验防效稍低,可能因拮抗菌处理方法、病原物接种时间及环境条件等因素引起。Mg15室内筛选结果与温室防病效果一致,不同稀释倍数的发酵液对甜瓜白粉病均有一定防治效果,其中Mg15的发酵原液防效高达80.66%。对菌株Mg15生理生化特性和16S rDNA序列鉴定结果表明,该菌株为枯草芽胞杆菌,这与前人研究[18]认为枯草芽胞杆菌对许多植物病原物具有拮抗作用的观点是一致的。至今已从大豆[19]、桔梗[20]、辣椒[21]等植物体内分离到多株具有生防功能的枯草芽胞杆菌。
Tamehiro[22]等进一步指出枯草芽胞杆菌能产生丰富的具有潜在的植物病害防治价值的抗菌物质,如脂肽类、肽类、磷脂类、多烯类、氨基酸类和核酸类等多种化合物。本研究在扫描电镜下观察发现,Mg15发酵液处理后的白粉菌菌丝皱缩生长,甚至产生畸形,说明可能是Mg15发酵液中的胞外代谢产物影响了白粉菌正常生长发育,关于菌株Mg15的具体防病机理以及是否具有促生作用与在甜瓜植株内的生存状况等问题还有待于进一步研究。
[1]Kuzuya M,Yashiro K,ToMita K,et al.Pow dery Mildew(Podosphaera xanthii)resistance in melon is categorized into tw o ty pes based on inhibition of the infection processes[J].Journal of Experimental Botany,2006,57(9):2093-2100.
[2]王娟,邓建新,宫国义.甜瓜抗白粉病育种研究进展[J].中国瓜菜,2006(1):33-36.
[3]王美琴,贺运春,薛丽,等.番茄内生细菌的分离及拮抗菌株的筛选[J].植物保护学报,2007,34(5):559-560.
[4]杨海莲,孙晓璐,宋未.植物内生细菌的研究[J].微生物学通报,1998,25(4):224-227.
[5]Stu rz A V,Christie BR,Now ak J.Bacterialendophytes:potential role in developing sustainable systems of crop production[J].C ritical Review s in Plan t Scien ces,2000,19(1):1-30.
[6]Romero D,Rivera ME,Cazorla FM,et al.Efficacy ofmycoparasitic fungi on the developMen t of Sphaerotheca fusca in melon leaves[J].Mycol Res,2003,107(1):64-71.
[7]鹿秀云,李社增,马平,等.黄瓜白粉病拮抗细菌的筛选与鉴定及其防病机理[J].中国生物防治,2006,22(增刊):54-58.
[8]王美英,黄丽丽,康振生,等.植物内生放线菌防治西葫芦白粉病的初步研究[J].园艺学报,2007,34(6):1471-1476.
[9]中华人民共和国国家标准农药田间药效试验准则(一)杀菌剂防治黄瓜白粉病[M].北京:中国标准出版社,2000.
[10]W olf G,Fric F.A rapid stainingMethod for E rysiphegraMinis f.sp.hordei in and on w hole barley leaves with a protein-specific dye[J].Phytopathology,1981,71(6):596-598.
[11]Romero D,de VicenteA,Zeriouh H,et al.Evaluation of biological controlagents formanaging cucu rbit pow deryMildew on g reenhouse-g row n melon[J].Plant Pathology,2007,56:976-986.
[12]Pérez-García A,Olalla L,Rivera E,et al.Development of Sphaerotheca fusca on susceptible,resistant,and temperature-sensitive resistant cultivars[J].Mycol Res,105(10):1216-1222.
[13]Buchanan R E,Gibbons N E.伯杰细菌鉴定手册[M].第8版.中国科学院微生物研究所翻译组译.北京:科学出版社,1978.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]林加涵,魏文铃,彭宣宪.现代生物学实验(下册)[M].北京:高等教育出版社,2001:98-103.
[16]Di Fiore S.Entophytic bacteria and their possible role in the host plant[C]∥Istven F.Azosp ir iluMV Iand related MicroorganisMs:genetics,physiology,ecology.H eidelberg:Sp ringer,1995:72-78.
[17]彭细桥,周国生,邓正平,等.烟草青枯病内生拮抗菌的筛选、鉴定及其防效测定[J].植物病理学报,2007,37(6):670-674.
[18]Dubnau D A.TheMolecular biology of the Bacilli.Volume1:Bacillus subtilis[M].New York:AcadeMic Press,1982:154-156.
[19]BaiY,Aoust F D,SMith D L,et al.Isolation of plant-grow thp roMoting Bacillus strains fromsoy-bean root nodules[J].Can JMicrobial,2002,48(3):230-238.
[20]Choi EH,Lee S E,Kw on K S,et al.Isolation of nitrogen-fixing bacteria fromgraMineous crop s andMeasu rement of nitrogenaseactivity[J].Ko rean J of Microbial&Biotech,2003,31(1):18-24.
[21]何红,邱思鑫,蔡学清,等.辣椒内生细菌 BS-1和BS-2在植物体内的定殖及鉴定[J].微生物学报,2004,44(1):13-18.
[22]Tamehiro N,OkaMoto Y,OkaMoto S,et al.Bacily socin,a novel phospholipid antibiotic produced by Bacillussubtilis 168[J].AntiMicrob Agen ts Chemother,2002,46:315-320.

