田间柑橘植株不同部位黄龙病菌的PCR检测及发病原因分析
鹿连明, 范国成, 胡秀荣, 张利平, 黄振东, 陈国庆*
(1.浙江省柑橘研究所,台州 318020; 2.福建省农业科学院果树研究所,福州 350013)
柑橘黄龙病(huanglongbing,H LB)是柑橘生产上的一种毁灭性病害,广泛分布在亚洲、非洲、美洲的40多个国家和地区[1]。其病原物为韧皮部杆菌属细菌(Candidatus Liberibacter),可分为亚洲种(Ca.L.asiaticus)、非洲种(Ca.L.africanus)和美洲种(Ca.L.americanus)[2],我国的黄龙病病原菌主要为亚洲种[3]。迄今为止该病菌尚不能人工培养,在自然条件下主要通过柑橘木虱和嫁接传播,柑橘植株被侵染后产生复杂多样的病害症状,发病叶片常表现为均匀黄化、缺素状和斑驳黄化等,而发病果实往往变小或畸形,着色不均,橘类常表现为“红鼻子果”,橙类则表现为果皮青绿、无光泽的“青果”[4]。新树感病后在1~2年内即死亡,老树感病后3~5年内死亡或丧失结果能力,严重发生时可造成毁园。
柑橘黄龙病的猖獗危害和蔓延扩散,对柑橘产业的稳定和发展造成了严重的威胁,已经成为柑橘产业发展的重大障碍。尽管从发现该病害到现在已有百年的历史,但目前尚缺乏有效的防治药剂和理想的抗病品种,主要采取以预防为主的综合防治的方法来控制其发生和蔓延,因此,及时了解柑橘植株内黄龙病菌的存在情况,明确病害发生的原因,对于该病害的有效防控具有重要意义。为此,作者对浙江省台州市柑橘黄龙病发生情况进行了调查,并通过常规和巢式PCR方法,对黄龙病菌在柑橘病株不同部位的分布情况进行了检测,分析了不同果园内柑橘黄龙病可能发生的原因,以期为今后该病害的有效防控提供借鉴。
1 材料与方法
1.1 植物材料
材料A:a果园内‘槾橘’上高接换种为‘本地早’的柑橘植株,表现典型的叶片斑驳黄化和“红鼻子果”症状。材料B:b果园内‘哈姆林’柑橘植株,表现典型的均匀黄化、斑驳黄化和“青果”等症状。材料C:a果园内与材料A临近的未高接换种的‘本地早’、‘槾橘’和‘早橘’植株,未表现柑橘黄龙病症状。材料D:b果园内与材料B临近的‘柳本橙’、‘椪柑’和‘橘柚’植株,大部分枝条或个别枝条表现叶片斑驳黄化症状。
1.2 主要试剂
DNA提取试剂如CTAB、酚/氯仿/异戊醇、氯仿/异戊醇 、异丙醇 、PVP、β-巯基乙醇等为 Amersco公司产品。PCR试剂如Taq酶、dNTP等购自大连宝生物公司(TaKaRa)。琼脂糖为Biowest公司产品。凝胶染料为Biotium公司生产的GelRed。
1.3 引物
设计用于常规PCR检测的引物LAP1/LAP2,用于巢式PCR检测的引物P1/P2和P3/P4,设计好的引物送交TaKaRa公司合成,引物信息见表1。
1.4 柑橘黄龙病的调查分析
于浙江省台州市不同果园内,现场调查‘少核本地早’、‘温州蜜柑’、‘椪柑’、‘槾橘’、‘柳本橙’、‘橘柚’等品种的柑橘黄龙病发生状况,根据叶片均匀黄化、缺素状、斑驳黄化和“红鼻子果”、“青果”等柑橘黄龙病的病害症状,初步了解黄龙病的发生率和危害程度。并向当地果农了解近几年该病害的发生趋势,结合其发生现状,分析病害的发生规律及可能的发病原因。对于病害发生情况有明显差异的果园,采集不同柑橘植株和同一柑橘植株不同部位的样品,带回室内进行深入的研究确定。

表1 本研究所用的引物
1.5 柑橘样品总DNA的提取
采用改良的CTAB法提取柑橘样品材料总DNA:称取0.1~0.2 g材料于研钵中,加入少量PVP后用液氮研磨成粉末;加入 1~2 ML 2%的CTAB缓冲液及 10~20μLβ-巯基乙醇;将提取液转移到2 ML的离心管中,于65℃水浴30~60min,期间不时摇动使其充分混匀;加入等体积的酚/氯仿/异戊醇(25∶24∶1),颠倒混匀,12 000 r/min离心10 Min;取上清,加入等体积的氯仿/异戊醇(24∶1),颠倒混匀,12 000 r/min 离心 10 min;取上清,加入等体积预冷的异丙醇,颠倒混匀,-20℃放置30~60Min;12 000 r/Min离心10 Min以沉淀DNA;弃上清,加入适量75%乙醇洗涤沉淀 2次;12 000 r/min离心 10min,吸尽上清,使沉淀于室温下自然晾干,加入10~20μL TE(含 RNase 50μg/ML)溶解DNA,所得溶液即为样品DNA溶液。取1μL溶液上样于0.8%的琼脂糖凝胶上进行电泳,检测所提取的DNA质量。
1.6 柑橘植株不同部位黄龙病菌的检测
取材料A和B的无症状叶片中脉、有症状叶片中脉、枝条韧皮部、主干韧皮部、砧木韧皮部和根韧皮部,提取样品总DNA,分别以引物A 2/J5和P1/P2→P3/P4进行常规和巢式PCR检测。常规PCR反应体系为:10×Buffer 2.5μL,dNTPs 2μL,上下游引物(10μmol/L)各 1.5μL,Taq DNA 聚合酶0.2μL,DNA模板 1μL,无菌水补足至总体积25μL。反应条件为94℃5Min,94℃1Min,55℃1min,72℃1 min,35个循环,72℃10min。对于巢式PCR,取1μL第1轮PCR产物为模板,进行第2轮扩增,扩增体系和扩增条件同上。PCR产物上样于1.5%的预混有GelRed染料的琼脂糖凝胶上电泳,电泳结束后于凝胶成像仪中观察拍照。
1.7 不同柑橘植株内黄龙病菌的检测
分别取材料C和D多个不同柑橘植株的叶片中脉,提取总DNA,分别以引物 A 2/J5和 P1/P2→P3/P4进行常规和巢式PCR检测。PCR反应体系和条件同1.5,产物经琼脂糖凝胶电泳后于凝胶成像仪中观察拍照。
2 结果与分析
2.1 柑橘黄龙病的发生状况
通过调查发现,浙江省台州市柑橘黄龙病的发生较为普遍,不同果园不同柑橘品种发病程度有所差异。很多果园发病率在5%左右,而发病严重的果园则超过60%,‘椪柑’、‘少核本地早’等品种发病较重,而橙类等发病相对较轻。多数果园(如本研究中的b果园)的发病率呈逐年递增的趋势,即某一处或几处柑橘植株先发病,而后以此为中心向周围逐步扩散至其他植株相继发病,单个植株(如材料B)某一个或几个枝条顶部叶片先表现病害症状,之后扩散到其他枝条至整个植株发病,发病叶片表现均匀黄化、缺素黄化和斑驳黄化等,果实表现为“红鼻子果”或“青果”,椪柑果实除表现为“红鼻子果”外,其中一些形状转变为柱状。而台州市黄岩区半洋洪村柑橘果园(a果园)的发病情况较为特殊,在一年内‘槾橘’高接换种为‘少核本地早’的柑橘植株(材料A)整体发病,之后病害逐步加重,整株树表现明显的斑驳黄化和“红鼻子果”,而同果园内未高接换种的‘少核本地早’、‘槾橘’和‘早橘’等植株未表现任何病害症状。
2.2 黄龙病菌在柑橘植株不同部位的存在情况
以引物 LAP1/LAP2进行的常规PCR扩增产物为382 bp,以引物 P1/P2→P3/P4进行的巢式PCR扩增产物为400 bp,经检测发现材料A和B植株不同部位中黄龙病菌的存在情况有所差异(图1)。在材料A的无症状叶片中脉、有症状叶片中脉、枝条韧皮部中,及材料B的有症状叶片中脉、枝条韧皮部、主干韧皮部、砧木韧皮部中均可检测到病菌,而在两种材料的根韧皮部均未检测到病菌,在材料A的主干韧皮部、砧木韧皮部和材料B的无症状叶片中脉也未发现病菌的存在。
2.3 不同柑橘植株被黄龙病菌感染情况
经常规和巢式PCR检测,发现从与材料A同果园内的未高接换种的‘本地早’、‘槾橘’和‘早橘’植株中均扩增不到目的产物,说明这些植株未感染黄龙病菌;而从与材料B同果园内的‘柳本橙’、‘椪柑’和‘橘柚’植株中均可扩增到目的产物,说明这些植株已经被病菌感染。检测结果如图2。
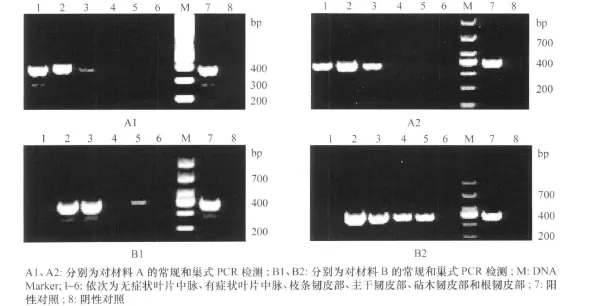
图1 柑橘植株不同部位中黄龙病菌的检测

图2 不同柑橘植株中黄龙病菌的检测
3 讨论
柑橘黄龙病在自然条件下主要通过柑橘木虱和嫁接传播,是柑橘生产上防治最难、危害最重、威胁最大的一种病害,目前主要通过加强植物检疫和培育无病毒苗木来预防,通过消灭田间柑橘木虱和彻底挖除病树来控制病害的蔓延,因此对该病害快速、准确地检测并及时了解其发生规律和原因对该病害的有效防控至关重要。通过对浙江省台州市柑橘黄龙病的调查,了解了当地柑橘黄龙病发生现状,并通过常规和巢式PCR检测,确定了黄龙病菌在柑橘植株不同部位的存在情况并分析了其发病原因。对材料B研究发现,病株的有症状叶片、枝条、主干和砧木中均含有病菌,无症状叶片和根中未检测到病菌,而其周围的‘柳本橙’、‘椪柑’和‘橘柚’等植株中也均有病菌的存在。结合材料B的发病情形,即材料B所在的b果园内最初是几处柑橘植株先发病,然后蔓延到周围其他植株,材料B最初是单个枝梢先表现病害症状,而后逐步扩散到其他枝条,至整个植株发病,分析认为b果园内如材料B等的柑橘植株发病是由携带黄龙病菌的柑橘木虱传播引起的。对材料A研究发现病株的无症状叶片、有症状叶片和枝条中均存在病菌,主干、砧木和根中不含有病菌,而其周围的未高接换种的‘本地早’、‘槾橘’和‘早橘’植株也未发现被病菌侵染。结合材料A的发病情形,即在a果园及同地区其他类似的果园内‘槾橘’高接换种为‘本地早’的柑橘植株在同一年内整体表现病害症状,而同果园内的未高接换种的‘本地早’、‘槾橘’和‘早橘’植株未表现任何症状,分析认为诸如a果园内材料A的发病是由嫁接传播引起的,即用以高接换种的接穗材料可能本身带有黄龙病菌,从而导致所有高接换种的柑橘植株整体发生病害。研究发现,柑橘木虱在病株上取食15Min即可获得病菌[5],带菌的木虱在健株上取食5 h即可传播病菌[6],可见柑橘木虱作为黄龙病菌的媒介昆虫具有较强的传播病菌的能力。而嫁接传播所造成的病害更为严重,一旦接穗带菌,经嫁接后的柑橘植株将会在以后成片发病,并会以此为毒源经由柑橘木虱持续传播扩散。因此,对于柑橘黄龙病的有效防控,首先要做好预防工作,加强植物检疫和无病毒苗木的培育,切断病菌的来源。同时,加强对田间柑橘黄龙病的检测鉴定,消灭柑橘木虱,彻底挖除病树,以杜绝病害的持续扩散。
柑橘植株不同部位黄龙病菌存在的差异表明病菌在植株体内可能存在着一个增殖和扩散的过程。对于柑橘木虱传播引起的柑橘黄龙病,最先可在木虱取食部位检测到病菌,之后病菌不断增殖并扩散到枝条、叶片、主干等部位。胡浩[7]发现田间柑橘病株内黄龙病菌的表达量呈动态变化趋势,10-12月期间病菌含量达到高峰;van Vuuren[8]发现柑橘木虱传菌后12个月,可在距接种部位沿树干40 cm处有黄龙病症状表现。对于嫁接传播引起的柑橘黄龙病,Su和H uang[9]发现在嫁接接种后的5个月,可在接种幼苗的根部检测到病菌。胡浩[7]研究发现柑橘病株的叶片、枝条、主干、果实和种皮等部位均含有黄龙病菌,且含量有较大差异,而在根系中却没有检测到病菌。Lopes和Frare[10]研究发现嫁接接种4~5个月后,柑橘叶片表现斑驳或缺铁、缺锰、缺锌等症状,不同品种对黄龙病菌的嫁接传播效率差异明显。Folimonova等[11]研究发现黄龙病菌可在不同品种柑橘植株中增殖,且不同品种对黄龙病菌侵染的反应各异,但植株中病菌的含量与病害的严重程度未表现严格的相关性,另外,通过嫁接试验发现不同品种对黄龙病的嫁接传播效率无明显差异,病菌可在较短的时间(4周)内传播到嫁接后的柑橘植株上。Li等[12]研究发现不同品种柑橘植株和同植株不同部位中黄龙病菌的含量有所差异,且在有的植株根部可检测到黄龙病菌而有的未检测到。Tatineni等[12]在除胚和胚乳外的果实其他部位、树皮、叶脉及根部均检测到了黄龙病菌,且不同部位病菌的含量不同,研究还表明黄龙病菌可从嫁接部位逐步扩散到植株的其他部位。而本研究发现在植株的枝条、主干和砧木等部位检测到病菌的时候,枝条上一些叶片尚未被病菌侵染。对于发病情形不同的果园内的两种柑橘病株,在其根部均未检测到黄龙病菌,且在嫁接传播的柑橘病株的主干和砧木中也未发现病菌。因此,结合前人的研究结果可以看出,柑橘黄龙病菌在柑橘植株中分布不均匀,在不同部位存在病菌的有无和表达量高低的差异。无论对于柑橘木虱传播还是嫁接接种,病菌在植株体内存在一个增殖和运动的过程,由接种部位开始逐步扩散蔓延到其他部位。对此有必要进行深入研究,明确黄龙病菌的侵染机制及其与寄主的互作关系,以制定对柑橘黄龙病更有效的防控措施。
[1]BovéJ M.H uanglongbing:a destructive,new ly-emerging,century-old disease of citrus[J].Journal of Plant Pathology,2006,88(1):7-37.
[2]Teixeira DC,Danet JL,Eveillard S,et al.Citrus huanglongbing in Sa ~o Paulo State,Brazil:PCR detection of the‘Candidatus’Liberibacter species associated with the disease[J].Molecular and Cellular Probes,2005,19(3):173-179.
[3]田亚南,柯穗,柯冲.应用多聚酶链式反应(PCR)技术检测和定量分析柑桔黄龙病病原[J].植物病理学报,1996,26(3):243-250.
[4]陈国庆,许渭根,童英富.柑橘病虫原色图谱[M].杭州:浙江科学技术出版社,2006:170-172.
[5]Capoor SP,Rao DG,Visw anath SM.Greening diseaseof citrus in the Deccan Trap country and its relationship with the vector,Diaphorina citriKuwayama[C].Proc.6th Conferenceof the International Organization of Citrus V irologists(IOCV),1974:43-49.
[6]许长藩.柑桔木虱传播黄龙病的规律及病原在虫体内分布的研究[J].福建省农科院学报,1988,3(2):57-61.
[7]胡浩.应用荧光定量PCR技术研究亚洲韧皮部杆菌在寄主体内的动态变化及分布[D].重庆:重庆大学生物工程学院,2007.
[8]VanVuuren S P.Variable transMission of african greening to sw eet orange[C].Proc.12th Conferen ce of the International Organization of Citrus V irologists(IOCV),1993:264-268.
[9]Su H J,Huang RS.The nature of likubin organism,life cycle,morphology and possible strains[C].Proc Asia Pacific International Conference on Citriculture,1990:106-110.
[10]Lopes SA,Frare G F.G raft transmission and cultivar reaction of citrus to‘Candidatus Liberibacter americanus’[J].Plan t Disease,2008,92(1):21-24.
[11]Folimonova S Y,Robertson C J,Garnsey SM,et al.ExaMination of the responses of different genotypesof citrus to huanglongbing(citrus greening)under different conditions[J].Phy topathology,2009,99(12):1346-1354.
[12]Li W B,Levy L,H artung J S.Quantitative distribution of‘Candidatus Liberibacter asiaticus’in citrus plants with citrus huanglongbing[J].Phytopathology,2009,99(2):139-144.
[13]Tatineni S,SagaraMU S,Gow da S,et al.In planta distribution of‘Candidatus Liberibacter asiaticus’as revealed by polyMerase chain reaction(PCR)and real-time PCR[J].Phytopathology,2008,98(5):592-599.

