一种纯化苏云金杆菌Cry1Ac蛋白的方法
王发祥,刘永乐,丁学知,夏立秋
(1.长沙理工大学化学与生物工程学院,长沙 410114;2.湖南师范大学生命科学学院微生物分子生物学湖南省重点实验室,长沙 410081)
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)是世界上应用范围最广的杀虫微生物,其杀虫活性主要来源于芽胞形成过程中产生的杀虫晶体蛋白。苏云金杆菌毒蛋白的杀虫机理已基本明确,描述如下:晶体蛋白被敏感昆虫吞食后,在碱性的中肠环境中很快被蛋白酶激活为活性毒素,然后结合到中肠上皮细胞的特异受体上,毒素随后发生构象变化并插入中肠膜,形成离子通道的孔,暴露在毒素中的中肠上皮细胞由于渗透平衡破坏而最终裂解死亡,并导致虫体的死亡[1-2]。目前,对苏云金杆菌Cry毒蛋白的结构与功能研究已成为一个热点,但国内在相关领域的研究,受Cry蛋白的纯化技术的制约,远落后于国际水平。
Cry蛋白是苏云金杆菌在芽胞形成期产生的一种伴胞晶体蛋白,只有活化后才具有特异的杀虫活性,其原毒素通常和20 kb DNA结合在一起[3],因此很难用分子筛层析纯化。另外,我们发现,用离子交换层析也无法纯化获得Cry蛋白原毒素,这很可能与Cry蛋白和20 kb DNA分子表面电荷分布复杂有关。基于此,我们提出了一种以等电点沉淀法纯化Cry1Ac蛋白原毒素,进而用分子筛层析纯化其活性的毒素片段的方法,为进一步研究Cry蛋白的结构和功能奠定基础。
1 材料与方法
1.1 仪器和试剂
BH-2型显微镜(日本Olympus公司);AKTA purifier 100 system(美国 GE Healthcare);DYY-Ⅲ-6B型电泳仪(北京六一仪器厂);EY-1型超声波细胞粉碎机(宁波新芝科器研究所)。
胰蛋白酶(trypsin)、苯甲基磺酰氟(PMSF)和二硫苏糖醇(DTT)均购自美国Amresco公司;其它试剂均为国产或进口分装分析纯。
1.2 质粒和菌株
质粒pHTAc35[4]为含有cry1Ac5(Genbank登录号:M73248)全长的pHT315重组质粒,由本室构建;菌株BUAcHT35[4]为含有质粒pHTAc35的 Cry-B重组菌,产典型菱形晶体,为本室构建保存。
1.3 液体双相法提纯伴孢晶体
将菌株BUAcHT35接种于G-tris培养基中,28℃,200 r/min培养至晶体和芽胞从母体细胞中完全释放。收集发酵液,10 000 r/min离心10 min,沉淀,用0.5 mol/L NaCl洗涤3次,以生理盐水制成悬液,超声波处理(工作 30 s,间隙 30 s,20次),使晶体、芽胞、细胞碎片尽量分散;10 000 r/min离心10 min,收集沉淀,以生理盐水洗涤2次;然后制成浓度为70 mg/mL(沉淀/双蒸水)的悬液,用磁力搅拌器反复搅匀,同时不停地除去产生的泡沫,当悬液中的泡沫不再增加时,转入分液漏斗,按7∶6∶7的比例分别加入1%Na2SO4和CCl4,充分振荡10 min后,静置10 min;吸出上层水相,10 000 r/min离心10 min,沉淀用5%丙酮和双蒸水各洗涤3次,所得沉淀即为提纯的伴孢晶体,冻干备用。
1.4 等电点沉淀法纯化原毒素
称取10 mg冻干的晶体,加入10 mL 50 mmol/L 的 Na2CO3/NaHCO3缓冲液(pH 值 10.5),100 μL 100 mmol/L的DTT和终浓度为10 mmol/L的PMSF,4℃溶解 5 h后 12 000 r/min离心 1 min,弃不溶物;上清液用2 mol/L的醋酸/醋酸钠缓冲液(pH 值 4.0) 调节 pH 值分别至 4.55、4.65、4.75、4.85、4.95、5.05,置于 4℃环境下沉淀过夜,离心(13 200 r/min,10 min)收集沉淀,重悬浮于等量50 mmol/L的Na2CO3/NaHCO3(pH值9.5)缓冲液中,进行SDS-PAGE分析。
1.5 分子筛层析纯化核心毒素
上述等电点沉淀纯化的原毒素,加入500 μL 50 mmol/L的Na2CO3/NaHCO3缓冲液(pH值9.5)重悬浮,超声波处理5s后按体积比50∶1加入10 μg/μL胰蛋白酶,37℃振荡1~2 h;然后在 AKTA purifier 100纯化系统中以superdex 200分子筛层析柱进行层析纯化,洗脱液为50 mmol/L的Na2CO3/NaHCO3(pH值10.5),洗脱流速为0.5 mL/min,上样体积为0.5 mL,收集主要的峰部分进行SDS-PAGE检测,目的峰收集部分即为纯化的毒素核心片段。
2 结果与分析
2.1 Cry1Ac5原毒素的纯化
Cry1Ac5蛋白的理论等电点(pI)为5.05,为了确定实际操作中Cry1Ac蛋白的真实等电点,将晶体溶解后调成系列pH值,用SDS-PAGE分析所得沉淀和上清液,结果如图1。
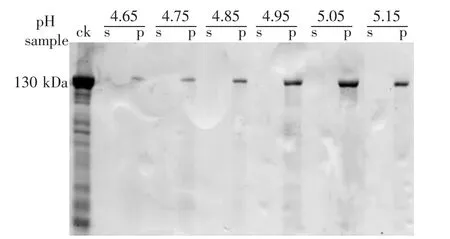
图1 不同的pH值下Cry1Ac原毒素的纯化效果
如图1所示,在pH值4.65~5.15,沉淀中都含有130 kDa蛋白条带,而上清液中则没有检测到相应条带,说明在该pH值范围,原毒素都会沉淀,且随着pH值上升,沉淀中检测到的130 kDa蛋白信号逐渐加强,pH值5.05时,蛋白条带最粗,因此5.05应为Cry1Ac3蛋白原毒素等电点沉淀的最佳pH值,与其理论等电点一致。此外,以等电点沉淀法纯化的原毒素几乎没有杂蛋白,纯化效果较好,但与晶体溶解后的上清液相比,其蛋白含量有较大的损失。
2.2 分子筛层析纯化毒素活性片段
将等电点沉淀的原毒素以胰蛋白酶活化后,以AKTA purifier 100纯化系统进行分子筛层析,如层析图谱(图2A)所示,在洗脱时间15 min和30 min时,有两个典型的峰,其中第1个峰在波长260 nm下的紫外吸收值大于波长280 nm下的吸收值,可能为结合在晶体蛋白上的DNA;第2个峰在280 nm下的紫外吸收值大于波长260 nm下的吸收值,应该为目的蛋白峰。收集峰1和峰2进行SDSPAGE检测(图2B),发现峰1对应的泳道没有蛋白条带,后经琼脂糖电泳证实其主要成分为20kb DNA (数据未列出),峰2对应的泳道仅有一条60 kDa左右的蛋白条带,即为活化的毒素核心片段,且纯化效果较好。另外,洗脱时间35 min后还出现了一个较大的非典型峰,可能为活化过程中降解成的小分子肽片段,实验中没有收集和检测。
图2 AKTA purifier 100纯化图谱(A)和SDS-PAGE分析(B)
3 讨 论
Cry1Ac毒蛋白是目前所知的对鳞翅目昆虫毒性最高和研究最多的Bt毒素之一,在农业生产、森林管理及水生态系统中都具有广泛的应用[5]。目前,在Bt毒素命名委员会网站中公布的Cry1Ac蛋白共23种,即Cry1Ac1~Cry1Ac23,Cry1Ac5为其中一种,含有1177个氨基酸,原毒素理论分子量为133 kDa,被昆虫吞食后在其中肠中被蛋白酶裂解掉C-端566多个氨基酸和N-端的33个氨基酸,激活为65 kDa左右的核心毒素。目前,Cry1Ac蛋白的三维结构尚未通过晶体衍射法完全明确,但研究发现其结构域Ⅲ比较特殊,与其它所有Cry1类蛋白的亲缘关系较远[6]。研究Cry1Ac蛋白的结构与功能一直是当前的热点,因而获得纯化的Cry1Ac蛋白尤为重要。
根据不同的研究目的,Cry1Ac蛋白的纯化涉及到伴孢晶体、原毒素和活性毒素的纯化。伴孢晶体提纯可采用液体双相法和Mg2+梯度离心法[7]等;原毒素由于和20 kb DNA紧密结合,无法以层析等方法纯化,目前鲜有纯化的相关研究;另外,现有的报道几乎都是以分子筛层析方法纯化活性毒素,但由于大多以晶体溶解液直接活化,纯化后还需要用超滤浓缩离心管进行浓缩[8]。本文用液体双相法提纯伴孢晶体后,将其溶解在含有还原剂DTT的Na2CO3/NaHCO3缓冲液(pH 值10.5),调节 pH 值至5.05进行等电点沉淀,获得纯化的原毒素,将其重悬浮于Na2CO3/NaHCO3缓冲液(pH值9.5),用胰蛋白酶激活后进行superdex 200分子筛柱层析,收集其最大峰即为纯化的活性毒素。本方法不仅纯化效果好,而且对原毒素进行了浓缩,故以此为基础通过分子筛层析纯化的活性毒素可直接用于分析和功能研究实验,省去了超滤离心浓缩步骤。这是Cry蛋白的纯化方法研究中的一次革新,对推动Cry蛋白的结构和功能研究具有重要的意义。
[1] Bravo A,Gill S S,Soberon M.Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insect control[J].Toxicon,2006,(49):423-435.
[2] Dean D H,Rajamohan F,Lee M K,et al.Probing the mechanism of action of Bacillus thuringiensis insecticidal proteins by site-directed mutagenesis—a minireview[J].Gene.1996,(179):111-117.
[3] Xia L Q,Sun Y J,Ding X Z,et al.Identification of cry-type genes on 20-kb DNA associated with Cry1 crystal proteins from Bacillus thuringiensis[J].Curr Microbiol,2005,51(1):53-8.
[4] Xia L Q,Wang F X,Ding X Z,et al.The role of β18-β19 loop structure in insecticidal activity of Cry1Ac toxin from Bacillus thuringiensis[J].chinese science bulletin.2008,53(20):3178-3184.
[5] Sarvjeet K.Molecular approaches towards development of novel Bacillus thuringiensis biopesticides[J].World Journal of Microbiology&Biotechnology,2000,(16):781-793.
[6] De Maagd R A,Bravo A,Crickmore N.How Bacillus thuringiensis has evolved specific toxins to colonize the insect world[J].Trends Genet,2001,17(4):193-9.
[7] Liao C,Heckel D G,Akhurst R.Toxicity of Bacillus thuringiensis insecticidal proteins for Helicoverpa armigera and Helicoverpa punctigera(Lepidoptera:Noctuidae),major pests of cotton[J].Invertebr Pathol,2002,80(1):55-63.
[8] Likitvivatanavong S,KatzenmeierG,AngsuthanasombatC.Asn183 in alpha5 is essential for oligomerisation and toxicity of the Bacillus thuringiensis Cry4Ba toxin[J].Arch Biochem Biophys.2006,445(1):46-55.

