莱菔硫烷诱导人肝癌HepG-2细胞凋亡的JNK途径
邹 翔,曲中原,白 晶,季宇彬,
(1.哈尔滨商业大学 生命科学与环境科学研究中心,哈尔滨 150076;2.国家教育部 抗肿瘤天然药物工程研究中心,哈尔滨 150076;3.哈尔滨商业大学中药学博士后流动站,哈尔滨 150076)
西兰花(Broccoli)卓越的防癌抗癌作用归因于其富含异硫氰酸盐类物质,而莱菔硫烷(sulforaphane,SFN)是其中最主要的活性成分之一[1-5].以往研究表明,SFN可通过完全抑制I相酶,并且诱导II相解毒酶的表达而预防化学物诱发的肝癌、肺癌、前列腺癌、乳腺癌、直肠癌等多种癌症的发生[6-7].近年来研究发现,SFN 可通过诱导 HepG-2细胞发生G2/M期阻滞,并通过启动线粒体途径诱导人肝癌HepG-2细胞凋亡,发挥抗肝癌作用[8-9].本文主要在考察 SFN 诱导 HepG-2细胞凋亡作用的基础上,研究SFN对人肝癌HepG-2细胞中JNK和p-JNK蛋白表达的影响,探讨JNK信号转导途径在SFN诱导HepG-2细胞凋亡中的作用.
1 材料与方法
1.1 细胞
人肝癌HepG-2细胞株,由哈尔滨商业大学药物研究所博士后科研工作站传代保种.
1.2 药品和试剂
莱菔硫烷(分子式C6H11NOS2,相对分子质量为 177.3,纯度98.3%),美国 Alexis公司,用前以二甲基亚砜(DMSO)溶解,-20℃保存,临用时加培养液稀释至所需浓度,使DMSO终质量分数不超过0.1%;阿霉素(批号080907),浙江海正药业股份有限公司;RPMI-1640培养基干粉,美国GIBCO公司;胰蛋白酶、二甲基亚砜(DMSO),美国Sigma公司;Hoechst 33258:Sigma公司;鼠抗JNK/SAPK抗体、鼠抗p-JNK/SAPK抗体、碱磷酶标记马抗鼠IgG,碧云天公司;其他试剂均为国产分析纯.
1.3 实验仪器
CO2培养箱,日本Sanyo公司;低温高速离心机,美国Beckman-Coulter公司;荧光显微镜:日本Olympus公司;水平电泳仪、电转仪,美国Bio-Rad公司;超净工作台,苏净集团.
1.4 细胞培养
人肝癌细胞系HepG-2常规细胞复苏后,培养于含有10%胎牛血清RPMI-1640培养液中,置于CO2培养箱(37℃,体积分数为5%的CO2,相对湿度95%)培养.2~3 d传代1次,取对数生长期细胞进行实验.
1.5 荧光显微镜观察凋亡细胞形态
先将6孔培养板内放上盖玻片,取对数生长期细胞接种于6孔培养板中,细胞浓度为3×105个/mL,置培养箱中37℃、5%CO2培养24 h后加入不同浓度的SFN(使其终浓度分别10、20、40μmol/L),阳性对照组加 ADR(终浓度 0.5μmol/L);阴性对照组加相同体积的培养液.48 h后细胞用胰酶消化,加PBS洗1次,加入固定液(甲醇和冰醋酸的体积比为3∶1),4℃固定10min后,加入质量浓度为5mg/L的荧光探针Hoechst 33258,置于37℃,5%CO2培养箱中孵育15min,将孔中的盖玻片取出,盖在已滴好甘油的载玻片上,置于荧光倒置显微镜上观察细胞形态并照相.
1.6 Western blotting法检测细胞内 JNK和 p-JNK蛋白的表达
将对数生长期细胞用胰酶消化后,传代培养于细胞培养瓶,24 h贴壁后给药.各给药组设计为:给药组(SFN 终浓度 10、20、40μmol/L)、对照组(加等体积 RPMI 1640)、阿霉素组(终浓度0.5μmol/L).48 h后,收集细胞,用预冷的 PBS洗2次、离心,加入裂解液冰上裂解1.5 h,4℃、12000 r/min离心10min提取总蛋白.570 nm处测定吸光度,计算蛋白含量,并用细胞裂解液将各样品调至相同浓度.配制5%的浓缩胶及12%的分离胶进行 SDS-PAGE电泳.电泳条件:浓缩胶80 V,待样品前沿进入分离胶后调电压至100V.转膜条件:200 mA恒流转膜60min.将凝胶中的蛋白转移到NC膜上,5% 脱脂奶粉封闭2 h,加一抗过夜.次日,取出NC膜用TBST缓冲液充分振摇洗膜3次,每次10min.加碱磷酶标记马抗小鼠IgG室温孵育2 h后,TBST振摇洗膜3次,每次10min.加显色液显色,Tannon凝胶成像系统照相.扫描图像在天能GIS凝胶成像分析系统进行量化分析.
1.7 统计学处理
2 结果
2.1 SFN对HepG-2细胞凋亡的影响
实验结果如图1所示.不同浓度SFN作用于HepG-2细胞48 h后,荧光显微镜下可见随着药物浓度的增大,凋亡细胞数量逐渐增多,细胞出现核染色质固缩浓集,同时伴有凋亡小体的形成.而空白对照组细胞胞核呈均匀蓝色,无深染的亮点,表明染色质均呈均匀分布.
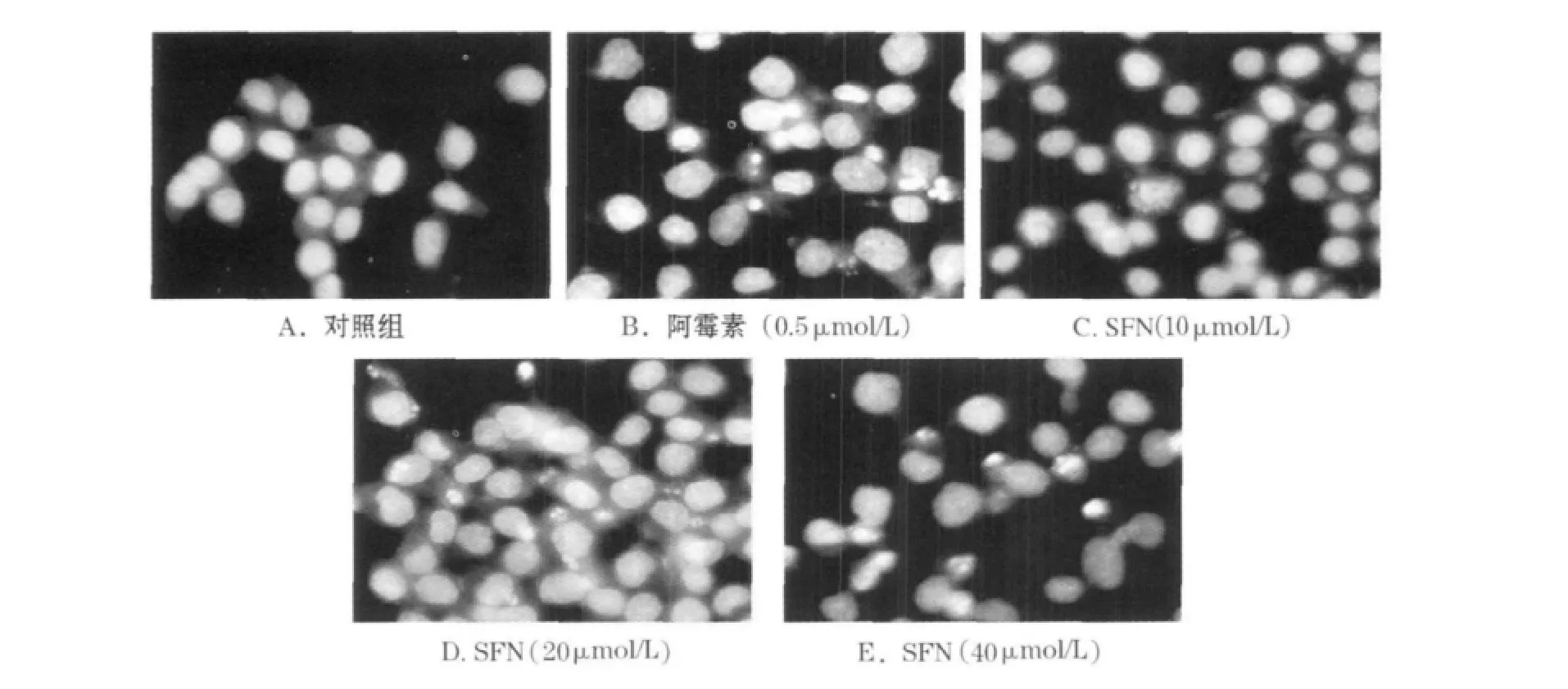
图1 荧光显微镜观察SFN对HepG-2细胞凋亡的影响
2.2 SFN对人肝癌HepG-2细胞内JNK和p-JNK蛋白表达的影响
实验结果如图2-5所示.结果表明,随着SFN浓度的增加,HepG-2细胞内JNK蛋白表达并无明显变化,而p-JNK蛋白表达逐渐增加,各组与对照组比较,差异均具有统计学意义(P<0.05或P <0.01).
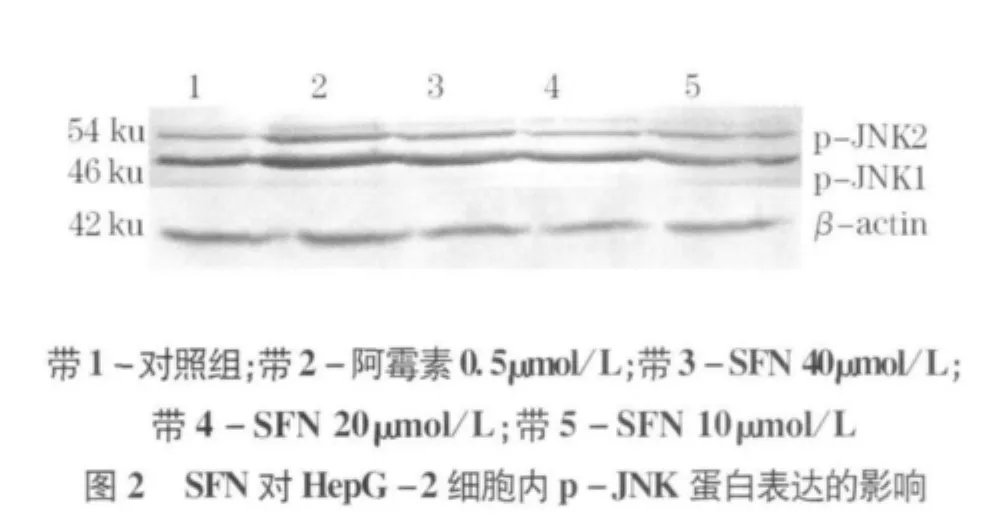

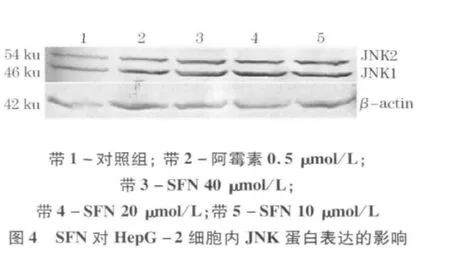

3 讨论
近年来,国内外对于SFN防癌抗癌的作用及机制进行了较为深入研究,已成为热点研究问题.本论文前期研究发现,SFN可通过诱导人肝癌HepG-2细胞发生G2/M期阻滞和凋亡发挥抗肝癌作用,其机制可能是:1)SFN可通过下调HepG-2细胞内Cdk1和CyclinB1蛋白的表达、上调p-Cdk1的表达抑制Cdk1-CyclinB1复合物的形成和活化而将HepG-2细胞阻滞于G2/M期;2)SFN可下调Bcl-2基因表达、上调Bax基因表达,进而诱导线粒体通透性转变孔道(PT孔道)的开放,促进线粒体内Cyt-c向胞浆的释放;释放的Cyt-c进一步与 Apaf-1、procaspase-9结合形成凋亡体,活化的 caspase-9进一步激活下游的caspase-3,最终完成 SFN通过线粒体途径诱导HepG-2 细胞的凋亡过程[7-9].而本课题采用荧光显微镜也证实,SFN可诱导HepG-2细胞发生凋亡,并呈现一定的剂量依赖性.
对于MAPK信号转导通路而言,在大多数情况下,JNK信号传导途径在细胞应激反应中的作用具有复杂性、多样性的特点,被激活后可促进细胞凋亡的发生,具体机制与诱导FasL和TNFR1的表达、调控凋亡相关基因的差异表达及激活Caspase家族有关.有研究表明,鱼藤酮诱导的SH-SY5Y细胞凋亡中,JNK的磷酸化状态被大大加强,并且是Caspase依赖性的,说明鱼藤酮诱导SH-SY5Y细胞凋亡,是通过激活JNK通路,进而通过Capase家族起作用的.在Fas介导的细胞凋亡中,JNK起到了重要作用.在 Fas激活 Caspase后,活化的Caspase裂解JNK的上游调控分子MEKK1,进而激活 JNK 通路诱导凋亡[10-11].而本研究发现,SFN可上调p-JNK蛋白的表达进而激活JNK信号通路,这可能是其诱导HepG-2细胞凋亡的主要机制之一,但结合已有研究我们发现,除了线粒体通路外,死亡受体通路可能也参与了SFN诱导HepG-2细胞凋亡的过程,但该方面的研究还有待进一步证实.
[1]季宇彬,邹 翔,李 雷.十字花科植物中异硫氰酸盐的性质及活性研究[J].哈尔滨商业大学学报:自然科学版,2007,23(4):385-390.
[2]季宇彬,池文杰,邹 翔,等.西兰花中萝卜硫素提取、分离与抗癌活性研究[J].哈尔滨商业大学学报:自然科学版,2005,21(3):270-273.
[3]季宇彬,武晓丹,邹 翔.西兰花中葡萄糖异硫氰酸盐诱导HepG-2细胞凋亡[J].中国天然药物,2007,5(4):293-296.
[4]季宇彬,池文杰,邹 翔,等.西兰花中异硫氰酸盐诱导人肝癌细胞HepG-2凋亡作用及其机制的研究[J].中国中药杂志,2007,32(7):612-615.
[5]邹 翔,郎 朗,武晓丹,等.西兰花中葡萄糖异硫氰酸盐诱导人胃腺癌SGC-7901细胞凋亡的初步研究[J].中草药,2007,38(2):228-231.
[6]孙胜男,邹 翔,高 鹏,等.莱菔硫烷诱导人肝癌HepG-2细胞凋亡的 p38MAPK途经研究[J].药物评价研究,2009,32(1):29-33.
[7]季宇彬,高 鹏,邹 翔,等.莱菔硫烷通过线粒体诱导HepG-2细胞凋亡[J].哈尔滨商业大学学报:自然科学版,2009,25(6):641-644.
[8]邹 翔,曲中原,高 鹏,等.莱菔硫烷对人肝癌HepG-2细胞Bcl-2与Bax基因转录及蛋白表达的影响[J].上海中医药大学学报,2010,24(2):76-80.
[9]邹 翔,曲中原,高 鹏,等.莱菔硫烷诱导HepG-2细胞G2/M期阻滞及其对Cdk1和CyclinB1蛋白表达的影响[J].中医药学报,2010,38(2):8-12.
[10]XU C J,SHEN G X,YUAN X L.ERK and JNK signaling pathways are involved in the regulation of activator protein 1 and cell death elicited by three isothiocyanates in human prostate cancer PC-3 cells[J].Carcinogenesis,2006,27(3):437-445.
[11]邹 翔,曲中原,白 晶,等.莱菔硫烷对人肝癌HepG-2细胞ERK信号通路的影响[J].哈尔滨商业大大学:自然科学版,2011,27(3):357-250,266.

