姜黄素对食管癌EC-109细胞增殖抑制的研究
胡 辉 荆绪斌 蔡先彬 王钦加
姜黄素是从姜科姜黄属植物姜黄根茎中提取的一种酚类色素,其抗肿瘤效应近年来受到研究者关注,实验证实姜黄素有确切的抗肿瘤活性[1~4]。我们前期研究也证实了姜黄素有抗食管癌作用,其作用机制仍有待进一步研究[5]。本研究通过检测不同浓度姜黄素作用食管癌EC-109细胞后的细胞增殖情况、细胞周期各时相分布情况和cyclin D1、cyclin E表达情况,以初步阐述姜黄素抑制食管癌细胞增殖的机制。
1 材料与方法
1.1 主要试剂
姜黄素购于成都思科华公司,噻唑蓝(MTT)、二甲基亚枫(DMSO)购自SIGMA公司,碘化丙啶(PI)、DMEM培养基、胎牛血清(FBS)购自美国Gibco公司,胰蛋白酶(Tyrisin)购自Promega公司,兔抗cyclin D1、cyclin E抗体和辣根过氧化物酶(HPR)标记的羊抗兔抗体购于Boster公司。
1.2 方法
1.2.1 细胞培养 人食管癌Ec-109细胞复苏后培养在含10%的胎牛血清、100 U/ml青霉素和100 mg/L链霉素的DMEM培养液中,每周传代2次,取对数生长期细胞进行实验。培养条件为37℃、5%CO2、饱和湿度。人食管癌Ec-109细胞为汕头大学医学院病理室馈赠。
1.2.2 MTT法检测细胞增殖抑制情况 将细胞悬液接种于24孔培养板中,每孔200 μl,含5×105个细胞。实验设空白组、肿瘤细胞阴性对照组、姜黄素治疗组,治疗组中加入等体积不同浓度姜黄素。将培养板置于37℃,饱和湿度,5%CO2培箱中常规培养12、24、48 h后,各孔均加入5 mg/ml的MTT溶液20 μl继续培养4 h后,离心弃上清,各孔均加入DMSO 150 μl,振荡器上振荡5 min溶解蓝色结晶,混匀后以酶标仪于490 nm处读取各孔吸光度值(A490)。肿瘤细胞的增殖抑制率=(1-实验组平均A值/对照组平均A值)×100%,空白组吸光度值设为0值。实验重复4次,取平均值。
1.2.3 流式细胞术检测细胞周期情况 姜黄素溶解于DMSO中,再用DMEM培养基稀释,样品中DMSO终浓度<0.5%。细胞接种于24孔培养板中,生长至80%融合,加入稀释终浓度为20、40、80 μmol/L姜黄素后继续培养24 h,对照组不加姜黄素,胰酶消化,PBS洗涤细胞2次,离心(1000 r/min×10 min,离心半径13.5 cm)。70%乙醇4℃固定过夜,碘化丙啶避光染色30 min,300目尼龙网过滤后流式细胞仪检测细胞周期分布情况,检测细胞数为1×106个。根据细胞周期各时相分布情况计算细胞增殖指数(proliferation index,PI)。Pl(%)=(S+G2/M)/(G0/G1+S+G2/M)×100%。实验重复4次,取平均值。
1.2.4 Western-blot检测cyclin D1、cyclin E表达 20、40、80 μmol/L的姜黄素分别作用细胞24 h后,细胞先经冷PBS冲洗3遍,收集细胞(1×108/ml),用加样缓冲液裂解细胞,匀浆缓冲液(250 μmol/L Sucrose,20 μmol/L Hepes/KOH,pH 7.5,10 μmol/L KCl,1.5 μmol/L MgCl2,1 μmol/L EGTA,1 μmol/L EDTA,1 μmol/L DTT,0.1 μmol/L PMSF)400 μl重悬,移入玻璃匀浆器内,于冰浴中匀浆5 min,离心(10 000 r/min×10 min,离心半径9.5 cm),收集上清,采用考马斯亮蓝法进行蛋白定量,制备好的蛋白样品置-80℃冰箱保存备用。以20 μg蛋白/泳道上样,经12%聚丙烯酞胺凝胶SDS-PAGE电泳后,电转膜至硝酸纤维膜。室温封闭3 h,加兔抗cyclin D1、cyclin E抗体,室温下孵育2 h,再加HRP标记的羊抗兔抗体,室温下孵育1 h,采用DAB显色试剂盒进行显色约2 min,以β-actin蛋白作为阳性对照,待蛋白条带显色清晰时,拍摄照片,记录实验结果。
1.3 统计学处理
计量资料采用均数±标准差表示。数据行方差分析,如有统计学意义再行均数间多重比较。采用SPSS11.0统计软件处理。
2 结果
2.1 姜黄素抑制细胞增殖情况
20、40、80 μmol/L姜黄素分别作用于食管癌EC-109细胞12、24、48 h后,采用MTT法分析,证实细胞吸光度值随作用时间延长及药物浓度增加而增大,实验组吸光度值与对照组比较均有统计学意义(F=64.795,P<0.05)。相同时间组内或相同剂量组内吸光度值两两比较均有统计学意义(P<0.05);细胞增殖抑制率呈现同样趋势(F=71.40,P<0.00),相同时间组内或相同剂量组内两两比较均有统计学意义(P<0.01)。说明姜黄素能抑制EC-109细胞的增殖,并呈一定的时间、剂量依赖关系,随着药物浓度的增加及作用时间延长,细胞活性及增殖能力逐渐下降,见表1、表2。
2.2 姜黄素干预后细胞周期的比较
20、40、80 μmol/L姜黄素干预EC-109细胞24 h后,细胞周期各时相所占的比例不同,随着姜黄素浓度的增大,G1/G0期所占比例对照组最低,为(51.46±3.22)%,20 μmol/L姜黄素组次之,80 μmol/L姜黄素组为(63.14±4.62)%,两组比较有统计学意义(F=6.27,P<0.05),组内两两比较均有统计学意义,P<0.05。对照组PI为(47.55±2.36)%,20、40、80 μmol/L姜黄素干预组PI分别降至(40.75±4.23)%、(31.26±3.67)% 、(22.78±2.02)%,实验组与对照组比较均有统计学意义(F=12.58,P<0.01),组内两两比较均有统计学意义,P<0.05,见图1,表3。
表1 姜黄素作用后细胞吸光度值比较
实验组与对照组比较,F=64.95,P<0.00;相同时间组内或相同剂量组内两两比较,P<0.05

表2 姜黄素作用后细胞增殖抑制率比较
实验组与对照组比较,F=71.40,P<0.00;相同时间点组内或相同剂量组内两两比较,P<0.01

表3 姜黄素作用后细胞周期变化情况
a为不同浓度姜黄作用后G0/G1期细胞数比较有统计学意义,F=6.27,P<0.05,且两两比较有统计学意义,P<0.05;b为不同浓度姜黄素作用后PI比较有统计学意义,F=12.58,P<0.01,且两两比较有统计学意义,P<0.05
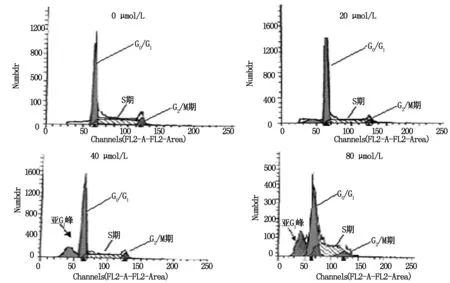
图1 3组裸鼠移植瘤剥离后的瘤体变化
2.3 姜黄素干预后cyclin D1、cyclin E变化情况
经过Western-blot分析发现,20、40、80 μmol/L姜黄素分别作用EC-109细胞24 h后,β-actin蛋白表达水平无改变,cyclin D1、cyclin E表达逐渐下降,对照组蛋白条带最宽,80 μmol/L组蛋白条带最窄,说明姜黄素干预后,cyclin D1、cyclin E表达水平逐渐下降,见图2。

图2 姜黄素对EC-109细胞周期蛋白表达的影响
3 讨论
肿瘤细胞具有快速无限增殖能力,抑制肿瘤细胞增殖已成为目前抗肿瘤治疗的热点之一,实验中检测细胞增殖采用较多的方法为MTT法[6~9]。通过MTT法我们证实,与对照组比较,作用时间相同条件下,不同浓度的姜黄素均能够不同程度抑制食管癌EC-109细胞增殖,其抑制细胞增殖程度与姜黄素剂量呈一定的依赖关系;相同浓度情况下,随着时间的延长,细胞增殖率亦逐渐下降。我们推断姜黄素呈时间、剂量依赖性抑制食管癌EC-109细胞增殖。但由于MTT检测法的局限性,我们无法说明姜黄素抑制食管癌EC-109细胞增殖的途径。通过流式细胞仪对细胞周期各时相的检测,我们证实,与对照组比较,不同浓度姜黄素干预食管癌EC-109细胞24 h,能够不同程度增大细胞G0/G1期细胞比例,浓度越高,G0/G1期细胞比例越大,细胞增殖指数越小。说明姜黄素能够通过使细胞停滞于G0/G1期,阻止细胞周期进程途径来抑制食管癌EC-109细胞增殖。
细胞周期受控于一组被称为细胞周期素的蛋白,它在细胞增殖分裂活动中起重要作用。哺乳动物的细胞周期蛋白有8种,表达量随细胞周期各个时期的转换而改变。在G1期主要有cyclin D1、cyclin E表达,是G1期进展的限速调节分子。有研究表明,cyclin D1、cyclin E表达增多,细胞由G1期进入S期进程加速,细胞增殖加速,而减少cyclin D1、cyclin E表达,能够使细胞阻滞于G0/G1期,抑制细胞增殖[10~12]。通过Western-blot检测发现,不同浓度姜黄素分别干预食管癌EC-109细胞24 h后,cyclin D1、cyclin E表达量不同,姜黄素浓度越高,cyclin D1、cyclin E条带越窄,说明其表达越弱。我们推断姜黄素能够降低EC-109细胞表达cyclin D1、cyclin E。
综上所述,我们推断姜黄素能够降低食管癌EC-109细胞表达cyclin D1、cyclin E,使细胞停滞于G0/G1期,起到抑制细胞增殖作用。但细胞周期阻滞只能部分解释姜黄素抑制食管癌EC-109细胞增殖,流式细胞仪检测到的亚二倍体凋亡峰提示诱导凋亡也是姜黄素的作用机制之一,这也被我们前期研究证实,但姜黄素抗肿瘤作用的分子信号途径还远未被了解,有待今后进一步深入研究。
[1] Reuter S,Eifes S,Dicato M,et al.Modulation of anti-apoptotic and survival pathways by curcumin as a strategy to induce apoptosis in cancer cells〔J〕.Biochem Pharmacol,2008,76(11):1340.
[2] Tong QS,Zheng LD,Lu P,et al.Apoptosis-inducing effects of curcumin derivatives in human bladder cancer cells〔J〕.Anticancer Drugs,2006,17(3):279.
[3] Tharakan ST,Inamoto T,Sung B,et al.Curcumin potentiates the antitumor effects of emcitabine in an orthotopic model of human bladder cancer through suppression of proliferative and angiogenic biomarkers〔J〕.Biochem Pharmacol,2010,79(2):218.
[4] Boonrao M,Yodkeeree S,Ampasavate C,et al.The inhibitory effect of turmeric rcuminoids on matrix metalloproteinase-3 secretion in human invasive breast carcinoma cells〔J〕.Arch Pharm Res,2010,33(7):989.
[5] 胡 辉,荆绪斌,蔡先彬,等.姜黄素损伤线粒体诱导食管癌Ec-109细胞凋亡的研究〔J〕.中华肿瘤防治杂志,2010,17(6):434.
[6] Nagahara T,Okano J,Murawaki Y.Mechanisms of anti-proliferative effect of JTE-522,a selective cyclooxygenase-2 inhibitor,on human liver cancer cells〔J〕.Oncol Rep,2007,18(5):1281.
[7] 李 芬,弥 漫,李新华,等.苹果粗多糖抑制胃癌腺细胞SGC7901细胞增殖的研究〔J〕.中国肿瘤临床,2010,37(15):850.
[8] Mattern J,Büchler MW,Herr I.Cell cycle arrest by glucocorticoids may protect normal tissue and solid tumors from cancer therapy〔J〕.Cancer Biol Ther,2007,6(9):1345.
[9] Fehm T,Mueller V,Marches R,et,al.Tumor cell dormancy:implications for the biology and treatment of breast cancer〔J〕.AP MIS,2008,116(7):742.
[10] 马俊芬,江亚南,赵继敏,等.曲古菌素A对食管癌EC1细胞增殖和细胞周期的影响及其分子机制〔J〕.世界华人消化杂志,2009,17(34):3534.
[11] 阮星星,肖若芝,王立琳,等.索拉非尼通过下调细胞周期蛋白D1诱导急性髓细胞白血病细胞凋亡的实验研究〔J〕.中华临床医师杂志,2009,3(11):1850.
[12] Masamha CP,Benbrook DM.Cyclin D1 degradation is sufficient to induce G1 cell cycle arrest despite constitutive expression of cyclin E2 in ovarian cancer cells〔J〕.Cancer Res,2009,69(16):6565.

