培养Schwann细胞用于构建毛囊神经嵴干细胞定向分化饲养层
周红利,张艳,任应博,林森*
(1.成都医学院人体解剖与组胚教研室,四川 成都 610083;
2.成都医学院“发育与再生”四川省重点实验室,四川 成都 610083;3.四川大学华西医院临床医学院毕业后继续教育部,四川 成都 610041)
毛囊神经嵴干细胞(neural crest stem cell,NCSC)定位于毛囊上部隆突区(bulge),具有缓慢的细胞增殖周期,超微结构为未分化状态,是具有多向分化潜能的多能成体干细胞,可分化为皮脂腺、表皮细胞等细胞,具有可定向分化为Schwann细胞(Schwann cells,SCs)的能力,为神经修复带来希望[1,2]。干细胞巢为毛囊干细胞提供免受如分化信号、凋亡信号等各种刺激的隐蔽环境,以维持干细胞特性和储量。在干细胞巢的调控下,干细胞被周期性激活,产生祖细胞或短暂增殖细胞(transit amplifying cell,TA cell)。因此,维持干细胞静止与激活状态的平衡是干细胞巢的标志性功能[3]。毛囊干细胞一旦离开干细胞巢,隆突区来源的NCSC便增殖、分化或死亡。对干细胞的研究表明,在原代或初期培养阶段,干细胞依赖于饲养层细胞及其分泌的生长因子,否则它们的存活率和克隆形成率不高,由此认为,饲养层条件是干细胞培养初期的一个关键因素。选择合适的饲养层细胞、适当的细胞因子组合以及适量的剂量,进一步对干细胞的体外培养和扩增等方法进行优化,有望解决干细胞研究中存在的所用细胞纯度低、难以获得体外高纯度、高活力的细胞等问题,为干细胞研究提供简单可行的实验室培养和扩增方法,建立经济可靠的培养技术,从而为干细胞的临床应用研究建立资源。
SCs包绕周围神经轴突并形成髓鞘,是周围神经系统(PNS)中特有的神经胶质细胞,是周围神经再生过程中的重要种子细胞,并因此成为周围神经系统损伤修复领域中的研究热点。SCs能够分泌多种神经营养因子,产生细胞外基质及细胞粘附分子,为轴突的再生提供良好的微环境,经基因转染的SCs在脊髓损伤中有重要作用[4]。另外,研究表明将SCs移植到中枢神经系统(central nervous system,CNS)可以诱导CNS再生[5,6]。本研究以SCs作为干细胞分化的饲养层诱导NCSC定向分化,为神经再生提供可靠微环境,现将结果报道如下。
1 材料与方法
1.1 动物
SD乳鼠(5~7d龄)由四川大学华西医学中心实验动物中心(SPF)提供。
1.2 主要试剂和设备
胎牛血清(Gibco公司)、DMEM/F12培养液(Gibco公司)、2mg/ml四氮唑盐(MTT)液(beyotime中国)、二甲基亚砜(DMSO,分析纯)、0.25%胰酶(Sigma公司)、0.125%胶原酶(Sigma公司)、多聚赖氨酸(Sigma公司);二抗荧光抗体(Invitrogen公司);神经胶质纤维酸性蛋白(GFAP)和钙结合蛋白S100抗体(Santa Cruz公司);ELISA试剂盒(BD公司)。防淬剂、封片剂(DAKO公司);CO2培养箱(THERMO公司)、酶标仪(BIORAD公司)、解剖显微镜(Olympus公司)、相差显微镜(Olympus公司)、激光共焦显微镜(Olympus公司)。
1.3 实验方法
1.3.1 原代NCSC培养、鉴定及饲养层诱导分化 参照张艺等[7]的培养方法,在解剖显微镜下,使用26号针头将5~7 d龄的SD乳鼠单个触须毛囊从唇部触须皮片中分离。在添加青霉素和链霉素的D-Hanks液中漂洗2次,洗掉脂肪滴以及血渍。转移到0.25%分散酶(dispase)中室温孵2h。用含20%胎牛血清的DMEM/F12培养液抑制终止消化,在无菌D-Hanks液中漂洗2次,重新于解剖显微镜下分别将单个毛囊的结缔组织鞘剥离,只保留含外根鞘、内根鞘、毛干和隆突区的裸毛囊。从每只鼠中分离40根左右,在超净台中将毛囊转移到培养瓶中。放少量DMEM/F12培养基(3∶1)使裸毛囊能够贴于瓶底,于37℃、5%CO2培养箱中翻转培养4 h,之后使瓶中培养基达到3mL,常规方式培养。分别于培养的第1~8d观察毛囊隆突区细胞的生长形态以及特性,测量原代细胞克隆的直径,取平均值。加入含10ng/ml碱性成纤维细胞生长因子(basic fibroblast growth facfor,bFGF)、10ng/ml表皮细胞生长因子(epidermal growth factor,EGF)的神经嵴干细胞培养液,调整细胞浓度,以1×105个/ml接种于24孔培养板。视细胞的生长情况,隔日补充添加以上生长因子或每2d半量换液。培养24h后取3孔细胞行常规细胞计数,求平均值,然后每24h按照同样的方法操作计数,根据计数的结果取对数绘制生长曲线。以神经嵴干细胞特异性标志物nestin和p75NTR鉴定该细胞是否为NCSC。1.3.2 原代Schwann细胞培养及饲养层条件选择 参照文献[8,9]的方法,取新生SD乳鼠,断头处死,75%乙醇浸泡消毒,无菌条件下取出双侧臂丛及坐骨神经,置于无血清培养基的培养皿中,培养皿放在4℃冰块上,去除表面的污血,在解剖显微镜下仔细剥离神经外膜及其粘连组织,剪成0.1~0.2mm大小的组织块,移入含0.25%胰蛋白酶和0.125%胶原酶混合液的离心管,在37℃恒温消化15~20min,用吸管轻轻吹打,待组织块分散后以等量含20%FBS的DMEM/F12培养液中止消化,1500r/min下离心5min,加入适量含20%FBS的DMEM/F12培养液,种植于预先涂布有多聚赖氨酸的35mm培养皿中,置于37℃、5%CO2培养箱培养。种植24h后,更换含阿糖胞苷的20%FBS的DMEM/F12培养液,阿糖胞苷终浓度为5μg/ml,48h后更换含有20ng/ml bFGF的培养液。细胞迁移并长满皿底后,将组织块移入新培养皿中,反复3次后将得到的纯化原代SCs放置于装有5mL DMEM/F12培养液的培养瓶中,置于37℃、5%CO2培养箱中培养。
1.3.3 间接免疫荧光法检测S100和GFAP表达以鉴定SCs及纯度 参照文献[10]的方法,反复传代后,取对数生长期细胞,并用0.125%胰蛋白酶消化,制成单细胞悬液。将SCs接种到预先经多聚赖氨酸处理的无菌盖玻片上(12孔板),每孔加入2mL含10%FBS的DMEM/F12培养液,置CO2培养箱中培养。待细胞覆盖玻片70%~80%时,弃去培养基加入冷丙酮固定10min后,将盖玻片取出,磷酸盐缓冲液(phosphate buffer solution,PBS)洗3次,每次5min,然后滴加50μL/片GFAP和S100抗体(稀释比例为1∶100),湿盒中4℃过夜;次日复温后用PBS振洗3次(10min/次),避光加入荧光标记的IgG羊抗鼠抗体(Invitrogen),37℃孵育60min,PBS洗3次,每次5min,最后加入荧光染料Hochest33342染色5min,PBS洗2次,每次5min。在准备好的在载玻片上滴一滴防淬剂,约15μL,将盖玻片有细胞的一面向下成45°扣在载玻片防淬剂上,赶走留下的气泡封片。最后在激光共焦显微镜下,488nm的荧光下扫图。在镜下每张随机选取5个视野,计数细胞总数和S100阳性细胞,并计算SCs纯度。SCs纯度=S100阳性细胞/细胞总数×100%。期间,加入二抗荧光抗体及以后的实验过程均要求避光操作。
1.3.4 MTT检测饲养层SCs对培养基血清浓度的依赖性参照文献[11]的方法。取对数生长期SCs,消化并稀释至4×105个/mL的密度,然后转移至75mL的培养瓶,于37℃、5%CO2培养箱中培养,24h后换液。待细胞长满瓶底后,在培养瓶中加入0.125%胰蛋白酶3mL消化,在解剖显微镜下监测,当SCs突起回缩、突起形成的网络断裂时加含血清的培养液终止。以吸管轻轻吹打至单细胞悬液,1500 r/min离心5min,加入适量的DMEM培养液,以血细胞计数板于显微镜下计数,用含的10%FBS DMEM/F12稀释至1.0×106个/ml细胞密度接种于96孔板,每孔200μL,约1.0×105个细胞,置37℃、5%CO2培养箱中培养。次日小心吸去培养液,设4个实验组,每组6孔,即无血清组、MTT试剂组、含 5%FBS 的 DMEM/F12 组、含 10%FBS 的DMEM/F12组、含20%FBS的 DMEM/F12组。每孔加200μL相应的培养液置37℃、5%CO2培养箱继续培养。48 h后每孔加入2mg/ml MTT 50μL,在37℃、5%CO2培养箱孵育4h后,轻轻吸去培养液,每孔加DMSO 150μL,置振荡器上振荡10min,在酶标仪波长为490nm波长处测量其吸光度(A)值,取平均值,同时绘制SCs生长曲线。
1.3.5 NCSC饲养层制备 待SCs长到铺满瓶底80%~90%时,加入含10~40mg/L丝裂霉素C的DMEM/F12培养液,在37℃孵箱培养2~16h后,用PBS荡洗3次,使用MTT法测定丝裂霉素C对SCs存活的影响。获取丝裂霉素C最适浓度后,利用0.25%胰蛋白酶消化细胞,以5×105个细胞接种到0.1%明胶包被的培养瓶中,24h后备用。用同一规格的培养皿,机械法将NCSC克隆切成3~16块,转移到铺有饲养层的培养皿中,选择最佳作用时间和浓度。
1.3.6 ELISA检测SCs分泌的神经营养因子 取第3代SCs接种到96孔板,每孔加入细胞悬液200μL。培养5d后,将各孔加入收集好的培养液50μL与稀释液50μL混匀后封口,室温孵育2h。用洗涤液将各孔充分洗涤5次,用滤纸印干。每孔再加入酶标抗体工作液100μL,并重新封口。继续室温孵育1h后,同上,洗涤测试孔后,每孔加入底物液A和B共100 μL,室温避光反应30min。最后,每孔加入100μL终止液混匀。用酶联免疫监测仪检测450nm处吸光度值。
2 结果
2.1 NCSC形态学观察及鉴定
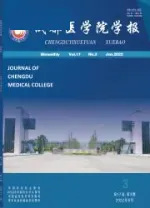
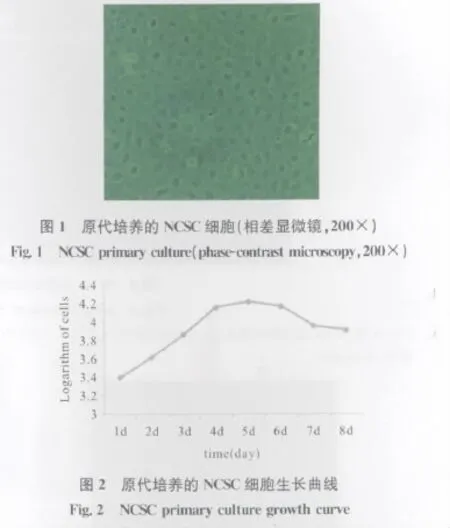
培养原代NCSC镜下发现细胞呈铺路石样结构,核质比小,透亮,内容物少,细胞之间连接紧密,呈现集落样干细胞样形态(图1)。细胞生长曲线分析显示NCSC在培养的第4~5天达到高峰,随后逐渐平稳下降(图2)。经神经嵴干细胞特异性标志物nestin和p75NTR鉴定,该细胞为NCSC(图3)。
2.2 SCs的形态学观察及生长状态
SCs原代细胞接种40~72h后,细胞从组织块中爬出,镜下细胞呈双极长梭形,核卵圆居中,胞体较小细长,排列紧密(图4)。传代培养细胞形态均一,增殖旺盛,细胞生长曲线分析显示SCs在培养的第6d达到高峰,随后逐渐平稳下降(图5)。
2.3 SCs标志物S100和GFAP的免疫组织化学鉴定
激光共焦显微镜下扫描,培养细胞多数为S100和GFAP阳性细胞(图6),经计数,培养细胞中SCs纯度为95%。
2.4 SCs对血清的依赖性
MTT比色试验结果显示,含0%和5%FBS培养液组的吸光度值与含10%和20%FBS培养液组相比显著增高,0%和5%FBS培养液组的吸光度值差异无统计学意义(图7)。
2.5 SCs饲养层条件
在2、4h时间点,10~40mg/L丝裂霉素C剂量对细胞存活无明显影响;而在8、16h,SCs存活明显下降,尤其是使用20和40mg/L剂量情况下(图8)。为此选择10mg/L丝裂霉素C处理2h,使SCs处于休克状态,以建立饲养层。
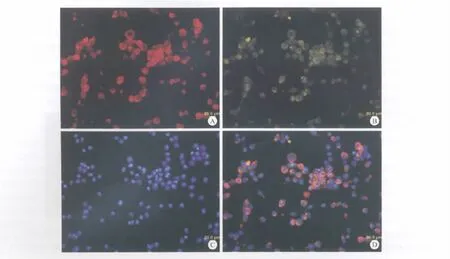
图3 NCSC细胞的形态及nestin和p75NTR鉴定Fig.3 Identification of NCSC by nestin and p75NTR
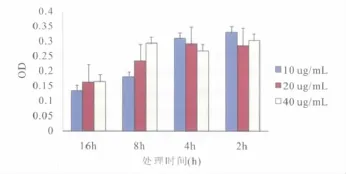
图8 丝裂霉素C处理饲养层细胞的量效关系Fig.8 Dose-effect relationship by mitomycin C on treated Schwann cell(feed layer)
2.6 ELISA检测饲养层SCs分泌细胞因子
在饲养层建立的0~8d,NGF和BDNF的水平呈现逐渐上升趋势(图9),其中NGF在0~4d间上升速度较快,以后趋于平稳;BDNF在0~3d间上升速度较快,以后趋于平稳。因此,种植NCSC可在饲养层建立后的第3d开始。
2.7 SCs与毛囊神经嵴干细胞共培养
利用3d的饲养层SCs对NCSC进行诱导,将NCSC克隆分散培养到SCs饲养层上。经过连续4d培养,发现NCSC受到饲养层影响,形态发生改变,由最初的铺路石样变为有短突起状,细胞呈现近似梭形。激光共焦显微镜下扫描,培养细胞多数为S100和GFAP阳性细胞,可同时表达S100和GFAP(图10)。
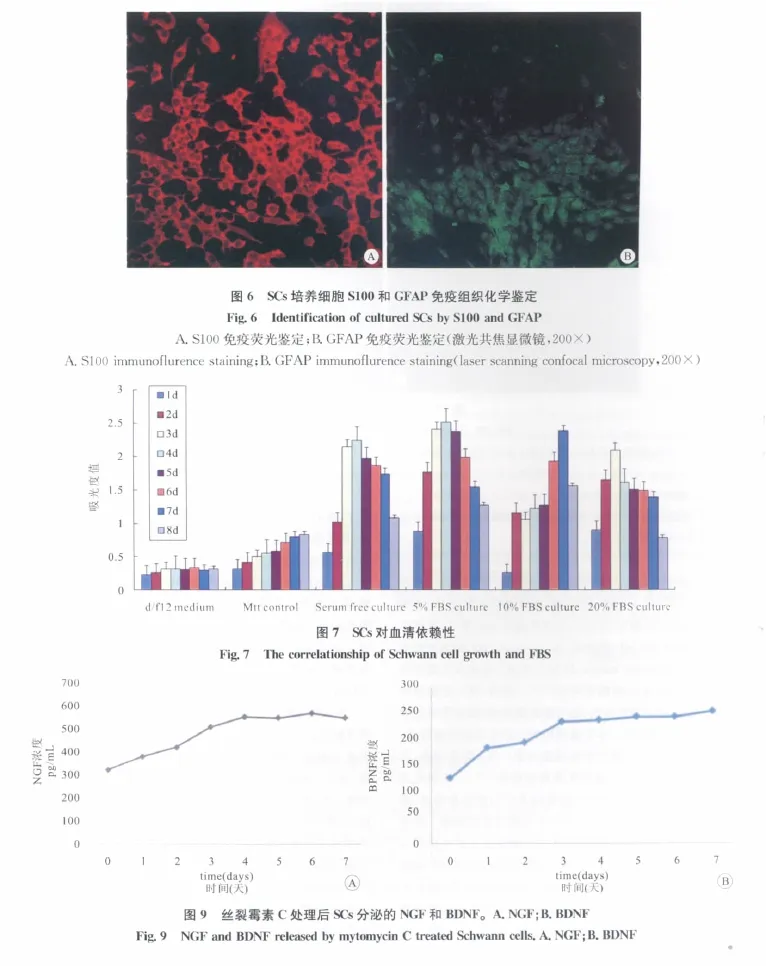
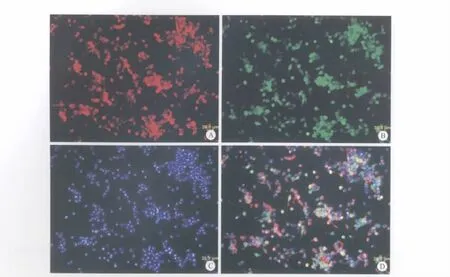
图10 饲养层共培养NCSCFig.10 Coculture of feed layer cell and NCSC
3 讨论
SCs的功能非常活跃,能分泌多种物质如分泌神经营养因子NGF、BDNF、CTNF、FGF等,其分泌物可促进PC12细胞分化,促进运动神经元存活,为再生提供先决条件;其产生的细胞粘附分子(Cell adhesion molecules,CAM)和细胞外基质成分(Extracellular matrix,ECM),不仅为轴突再生提供良好的环境,同时也引导轴突再生[12-15]。此外,SCs还能分泌细胞外基质,促进神经生长,参与基底膜构成,在血管生长和成熟中起着重要作用。本实验利用SCs的生长和分泌特性,可定向诱导NCSC向神经胶质细胞分化。SCs体外培养,其生长情况与培养基中血清的浓度密切相关[16,17]。本研究发现,无血清培养基可作为SCs构建饲养层的最佳培养基,既保留了细胞活性,又避免了血清对干细胞分化的影响。在培养的前7d,SCs增殖情况稳定,这一发现更正了以往研究认为胶质细胞需有血清才能存活的结论,为进一步研究干细胞提供了有利工具。为摸索最适的制备饲养层的条件,我们采用不同浓度丝裂霉素C处理SCs,发现10mg/L的剂量为理想化条件,可使细胞稳定存活,但不增殖,为NCSC饲养层的构建创造了有利条件。在激光共焦显微镜下,SCs表达GFAP,进一步证实了本实验培养纯化的SCs具有一定活性。
为证实处于非增殖状态的SCs仍然能够分泌神经营养因子,我们采用ELISA检测饲养层细胞的分泌情况,结果发现,虽然饲养层的SCs已停止增殖,但是仍具有分泌能力,可在培养的前7d稳定分泌NGF和BDNF,这个结果也为后续研究提供了有利条件。NGF是神经营养因子家族中最早发现、兼有神经元营养和促突起生长双重生物学功能的一种细胞生长调节因子,对中枢和周围神经元的发育、分化、生长、再生和功能特性的表达均具有重要的调控作用。NGF除了保护周围神经损伤后的上位脊髓神经元,以利轴突再生外,还具有促非神经组织的血管生成作用[18]。
SCs作为饲养层,与神经干细胞、成肌细胞、纹状体组织等多种组织或细胞共培养。与单一的普通培养相比较,SCs促进了神经干细胞分化,并促进其生长;与成肌细胞混合移植,促进了成肌细胞的增殖和分化,可提高成肌细胞移植后的融合性;促进了共培养纹状体神经突起的生长及细胞的迁移,为神经退行性疾病的移植治疗提供了新方法[19-22]。我们采用SCs作为饲养层的方法,共培养NCSC,能够将其特异性地诱导分化为神经胶质细胞,表达S100和GFAP。GFAP是构成神经胶质细胞的主要细胞骨架蛋白,是SCs表面的标志蛋白,其表达的高低可以反映胶质细胞的功能状态[23,24]。该研究结果为NCSC的组织工程应用提供了可靠稳定的基础和来源。
目前,SCs正越来越多地被运用于神经修复、构建载体细胞等。本研究对SCs的原代培养技术方法及其生长活性做了综合性的初步评价,并能够诱导多能干细胞NCSC定向分化,为进一步实验研究打下了良好的基础。在临床上,自体来源的NCSC避免了伦理和社会问题,理论情况下可以取之不尽用之不竭。因此采用定向诱导的NCSC细胞移植可应用于促进坐骨神经、脊髓、视神经的再生并修复中枢神经脱髓鞘损伤,前景非常广阔。
[1]Biernaskie J.Human hair follicles:“bulging”with neural crest-like stem cells[J].J Invest Dermatol,2010,130(5):1202-1204.
[2]Kloepper JE, Tiede S, Brinckmann J, et al.Immunophenotyping of the human bulge region:the quest to define useful in situ markers for human epithelial hair follicle stem cells and their niche[J].Exp Dermatol,2008,17(7):592-609.
[3]连小华.毛囊干细胞研究新进展[J].局解手术学杂志,2010,19(3):157-158.
[4]孔金海.基因转染Schwann细胞在脊髓损伤中的应用[J].国际病理科学与临床杂志,2006,26(3):266-268.
[5]Dezawa M.Central and peripheral nerve regeneration by transplantation of Schwann cells and transdifferentiated bone marrow stromal cells[J].Anat Sci Int,2002,77(1):12-25.
[6]孙晓宁.Schwann细胞对于周围神经再生的功能与作用[J].内蒙古民族大学学报,2010,25(1):105-107.
[7]张艺,杨恬.毛囊Bulge细胞培养与生物学特性的研究[J].第三军医大学学报,2004,26(16):1499-1500.
[8]李锋,何晶,丁文龙.体外培养Schwann氏细胞纯化方法的探讨[J].解剖科学进展,2006,12(2):156-159.
[9]孙沫逸,罗小龙,董绍忠,等.Schwann细胞标志物GFAP在涎腺腺样囊性癌中的表达意义[J].第四军医大学学报,2003,24(11):1017-1019.
[10]祝加学,沈尊理,秦金保,等.快速纯化新生大鼠许旺细胞的新方法[J].组织工程与重建外科杂志,2010,6(3):141-144.
[11]武雷,罗艳芬,秦建强.Schwann细胞的培养技巧[J].福州总医学学报,2007,14(1、2):120-124.
[12]严恒林,沈馨亚.Schwann氏细胞的功能研究进展[J].解剖学进展,1995,1(3):189-195.
[13]Ryletr RJ,Williams LR.Role of neurophins in cholinergie neuron fuction in the adult and aged CNS[J].TINS,1994,17:486.
[14]肖玉周,朱家恺,顾熊飞.许旺细胞分泌的蛋白对运动神经元营养作用[J].中华显微外科杂志,2001,24(3):189-191.
[15]杜婵,杨德梅,姜保国.原代培养Schwann细胞对PC12细胞促分化作用的研究 [J].中华手外 科杂志,2007,23(3):187-189.
[16]朱浩.高效的Schwann细胞体外培养方法[J].解剖科学进展,2007,13(2):144-147.
[17]Hood B,Levene HB,Levi AD.Transplantation of autologous Schwann cells for the repair of segmental peripheral nerve defects[J].Neurosurg Focus,2009,26(2):E4.
[18]邸金,胡盛寿,周建业,等.Schwann细胞分泌VEGF浓度的实验研究[J].中国分子心脏病学杂志,2009,9(5):287-290.
[19]阎华,马景镒,李兰英,等.大鼠神经干细胞和Schwann细胞体外共培养生长特性[J].天津医药,2006,34(1):36-38.
[20]廖华,余磊,熊绍虎,等.与Schwann细胞联合培养的成肌细胞生物学特性研究[J].中华骨科杂志,2003,23(11):682-687.
[21]罗丽,周红雨,成肌细胞与Schwann细胞混合移植治疗肌营养不良的初步研究[J].四川大学学报(医学版),2011,42(1):101-105.
[22]夏鹰,江澄川,汪洋.Schwann细胞对共培养不同发育阶段纹状体生长的影响[J].中华实验外 科杂志,2005,22(9):1111-1112.
[23]梁媛,赵心,刘佳丽.许旺细胞检测与鉴定方法的新进展[J].中国实用医药,2008,3(10):199-200.
[24]王剑,杜劲松,张信英,等.成人骨髓基质干细胞体外诱导为许旺细胞的实验研究[J].中风与神经疾病杂志,2003,20(6):525-528.