基于磁共振表观弥散系数分布的淋巴结良恶性鉴别方法研究
李 琢,薛华丹,何泳蓝,雷 晶,金征宇
近年来肿瘤已成为人类健康重要威胁之一,转移是恶性肿瘤的重要特征之一,淋巴结分期是肿瘤TNM分期的重要组成部分,而TNM分期对肿瘤的治疗、监测及预后均有着重要的作用。现代影像手段诸如超声、计算机断层成像(CT)、磁共振成像(magnetic resonance imaging, MRI)、单光子发射计算机断层成像术(single-photon emission computed tomography, SPECT)和正电子发射断层成像术(positron emission tomography, PET)为淋巴结良恶性的诊断提供了巨大的帮助[1-3]。大多数影像手段主要依靠淋巴结的解剖形态包括大小、形状和强化特征进行诊断。当前,弥散加权成像(diffusion weighted imaging, DWI)已经被证实在肿瘤的诊断,尤其是良恶性的鉴别中有着至关重要的作用,并且为鉴别淋巴结转移与否提供了巨大的帮助[1-2,4-6]。尽管如此,利用DWI诊断淋巴结转移在不同研究者中仍然有着很大的差异,Sumi等[7]的研究表明良性淋巴结的表观弥散系数(apparent diffusion coefficient, ADC)值低于恶性淋巴结。而Abdel Razek等[8]的观察表明,转移淋巴结的ADC值更低。在临床实践中我们也发现不同经验程度的医师判断结果有较大的差异,所以希望通过研究获得一种以DWI为基础的更为客观、有效的判断良恶性淋巴结的方法。
本研究以VX2肿瘤动物模型为基础,利用计算机形态学方法尝试对肿瘤多b值DWI图像所得到的ADC值分布图进行分析,并最终利用病理作为金标准相对照,评价各种方法对淋巴结转移的诊断能力。
1 材料与方法
1.1 材料
健康雄性新西兰兔21只,体重2.0±0.5 kg,由北京协和医院动物中心提供;完全弗氏佐剂购于Sigma公司,VX2瘤株购于中国医学科学院基础医学研究所细胞中心。
1.2 动物模型的建立
21只兔随机分成两组,炎症模型组10只,肿瘤模型组11只。本动物实验方案经过了北京协和医院伦理委员会的审核,并同意进行本实验。
炎性淋巴结模型:以3%戊巴比妥钠(30 mg/kg)经耳缘静脉麻醉后,在兔双脚足垫处分别注射0.5 ml完全弗氏佐剂,注射后2周后,触诊确定淋巴结肿大情况,并行磁共振观察其肿大情况及成像特征。
淋巴结肿瘤转移模型:浓度为1.2×107/ml的VX2瘤株单细胞悬液,2 ml注射器吸取,1 ml每侧,于兔双侧小腿肌肉处接种,三到四周后,触诊确定淋巴结肿大情况,并行磁共振观察其肿大情况及成像特征,最终以病理结果确定其转移与否。
淋巴结直径大于5 mm纳入实验研究。
1.3 磁共振成像扫描参数及方案
扫描前从兔耳缘静脉注射3%戊巴比妥钠(30 mg/kg)麻醉。扫描采用GE Signal Excite HD 1.5 T超导型磁共振扫描仪,8通道头颈相控阵线圈,2D快速自旋回波(FSE)获得T2加权像(T2WI)(重复时间(TR):2400 ms,回波时间(TE):70.6 ms,回波链长度:16,层厚:3 mm,层间距:0 mm,激励次数:4,视野(FOV):18 cm×18 cm以及短T1反转恢复的回波平面弥散加权成像(TR:4500 ms, TE:71.5 ms,反转时间:160 ms,层厚:4 mm,层间距:-1 mm,激励次数:4,FOV:16 cm×16 cm,矩阵:512×512,弥散因子b值:20、150、800 s/mm2。
1.4 图像分析
采用Matlab平台下自主开发分析程序,用于利用线性回归通过多b值计算ADC值,并对其进行不同方法的分析与统计。
利用以下公式,以不同b和其作对应的信号强度(S)进行线性回归,求得ADC值,绘制其分布图:
ln S=ADC×(-b)+c (c为常数)
由两名多年从事放射科肿瘤影像学工作的医师在不知道病理的情况下,分别在ADC分布图中勾勒淋巴结最大横断面的整个淋巴结的外轮廓,并依照其各自经验标记其所认为的淋巴结皮髓质分界及淋巴结髓质中心。
计算最大横断面ADC值平均值。并通过下列三种方法对淋巴结的良恶性进行判断:
方法 1:计算所勾勒的淋巴结皮质区与髓质区所有像素的平均ADC的比值。
方法 2:以标记的中心为圆心,每一像素(如图1中#号所示)距标记的中心的距离为dc,其所在径线中心距淋巴结边缘的距离为r,计算ADC值随(r-dc)/r变化的线性回归的斜率。
方法 3:利用形态学方法,每一像素距所标记的淋巴结边缘的最小距离为d,其相应的径线上边缘具形态学骨架的最小距离为r[9]。计算ADC值随d/r变化的线性回归的斜率。
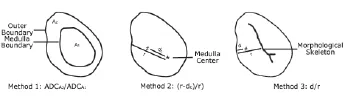
图1 三种不同的ADC图分析方法Fig 1 Three different methods for ADC map analysis
如图2所示,为实际磁共振图像上的绘制操作情况,左图为其相应的T2WI结构像,右图为DWI图像,同时利用20、150、800三个b值的DWI图像及ADC图相互参考,从外到内绘制出:淋巴结外轮廓、皮髓质分界及髓质区中心。其中b=20的图像中有较好的解剖结构,而b=800及ADC图中能跟好的表现其精细结构及病变特征。部分DWI图像中无法辨别基本解剖结构的将参照相对应的T2WI图像。图2中左图为T2WI图像,中图为DWI图像(b=800),右图为ADC图。
1.5 组织病理学检查
处死实验兔,取淋巴结,朝向腘窝方向为前面,与磁共振扫描方向同向横断面切开,切片厚度3 μm,用4%中性甲醛固定,石蜡包埋,经行苏木精-伊红染色法(HE染色),并在显微镜下观察,注意炎症性淋巴结的皮质区、副皮质区及髓索的比例差异及肿瘤转移性淋巴结中瘤巢的大小。病理结果由一名病理科医师与一名放射科医师共同读片记录。
1.6 统计学处理
采用SPSS 13.0统计学软件,根据病理结果将炎症模型兔的炎症淋巴结与肿瘤转移模型兔的转移性淋巴结的整个淋巴结的平均ADC值进行比较,采用独立样本的t检验(P<0.05)判断其是否存在差异。根据病理结果为金标准对三种的图像分析方法的进行比较,分别绘制其最终计算值的ROC曲线并计算其相应的曲线下面积(area under curve, AUC)及约登指数(约登指数=敏感性+特异性-1),及其相对应的最佳临界值。
2 结果
2.1 动物模型的建立及其病理诊断结果
共41枚直径大于5 mm的淋巴结纳入本研究,其中包括19枚炎性淋巴结和22枚转移淋巴结。炎性淋巴结表现为不同的增生形态:皮质增生型(9枚),副皮质增生型(5枚)和髓质增生型(5枚)。转移淋巴结显示了不同程度的巢样的肿瘤细胞侵犯(19枚,侵犯程度30%~80%)或者全淋巴结侵犯(3枚)。
2.2 平均ADC值的比较
在ADC分布图中选取整个淋巴结,计算其平均ADC值。炎症淋巴结组为(1.42±0.31)×10-3mm2/s,转移淋巴结组为(1.54±0.36)×10-3mm2/s,均符合正态分布,经t检验,两组无明显统计学差异(t=1.210,P=0.234)。
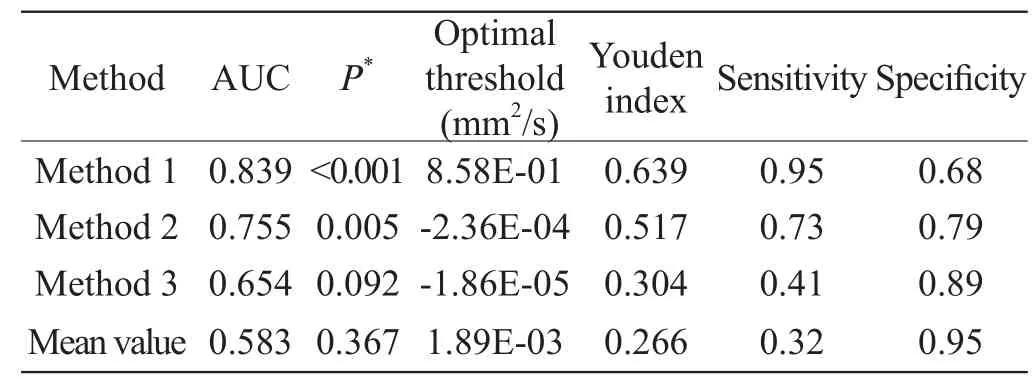
表1 不同方法间的ROC分析Table 1 ROC analysis of different methods
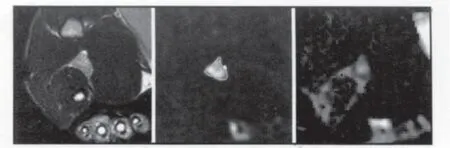
图2 人工绘制淋巴结轮廓及中心的过程Fig 2 The procedure of manual delineation of the boundary and center of lymph node
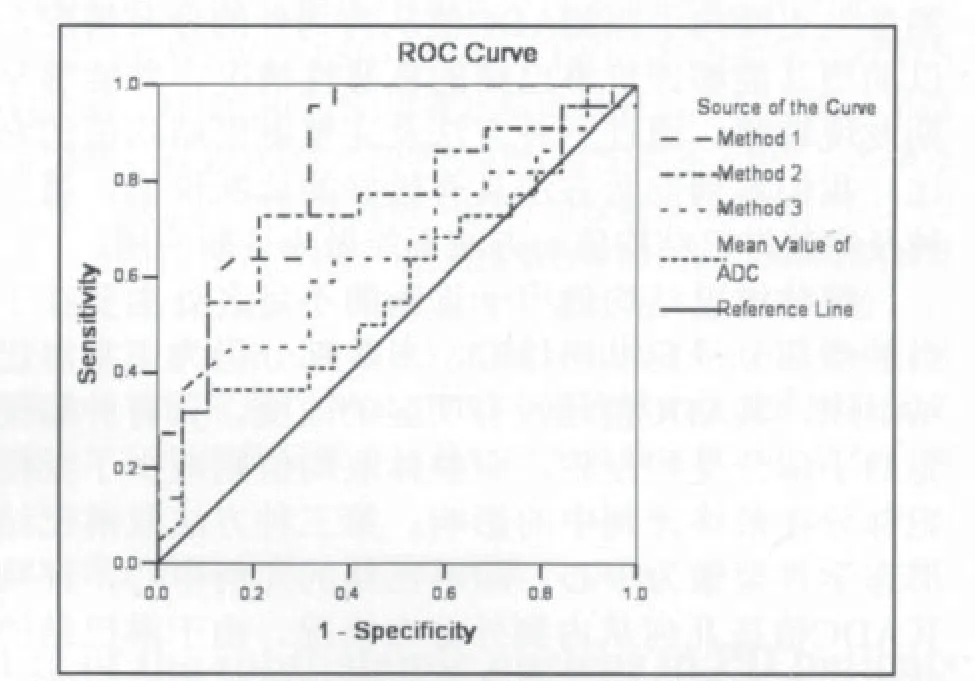
图3 三种方法及完整淋巴结的ADC均值的ROC曲线Fig 3 ROC curves of 3 different method and mean ADC of whole lymph node
2.3 不同图像分析方法间的比较
以病理结果为金标准,对三种分析方法及完整淋巴结的ADC平均值绘制ROC曲线如图3所示。三种方法及完整淋巴结均值的AUC分别为0.839、0.755、0.654和0.583;其最大约登指数分别为0.639、0.517、0.304和0.266,所对应的诊断阈值分别为0.86、-2.4×10-4、 -0.2×10-4和1.89×10-3mm2/s,其相应的判断淋巴结良恶性的敏感性和特异性见表1。
3 讨论
鉴别淋巴结的良恶性是影像学在疾病的治疗及预后分析方面的重要作用及优势所在。尽管如此,如何精确的评估淋巴结的情况,尤其是肿瘤转移情况,始终是放射学界重要的研究课题。CT及FDGPET都是最为常见的鉴别淋巴结良恶性的方法,磁共振成像因其有很高的软组织分辨力,已经越来越多的被应用于淋巴结良恶性的诊断[10-11]。近年来,DWI被广泛的应用于这一领域。DWI是一种磁共振的运动敏感性成像方法,能够探测水分子在体内的微观扩散运动。DWI反映了组织除横向及纵向弛豫以外的重要组织特征,因此,微小的组织学变化就能被DWI所探测。以往的研究已经证明评估组织ADC值是一个很好的评价淋巴结的手段[4]。尽管如此,依赖ADC值的淋巴结评估很大程度上依靠放射科医师的经验,并且继往的研究中[7-8]也存在一定的差异。
本研究试图通过不同的方法对淋巴结的ADC值分布进行分析,从而获得一种更为客观的指标来基于ADC值分布评估淋巴结良恶性。在以往的工作经验中,我们发现淋巴结的转移多从淋巴结包膜下开始,逐渐累积髓索,所以我们所设计的三种方法的测量上更倾向于探测ADC值从内到外的分布情况,以期望其能够评价淋巴结的良恶性情况,并能够早期发现转移。通过三种方法及完整淋巴结均值的对比,我们看到前两方法具有较好的诊断价值,第三种及完整淋巴结均值的方法不能做为诊断应用。
整体淋巴结均值用于诊断的不足之处主要在于当肿瘤部分侵犯淋巴结时,多数部分仍为正常淋巴结组织,其ADC值还没有明显的改变,只有肿瘤侵犯的小部分受到侵犯,而整体取均值则减少了受侵犯部分在最终评判中的影响。第三种方法取淋巴结形态学骨架做为中心,即淋巴结的几何中心,评判其ADC值按几何从内到外分布情况。由于淋巴结的结构并非对称结构,尤其在受肿瘤侵犯的淋巴结,其生长更不规则,故评价ADC值随几何的内外分布的变化情况,虽然一定程度的减少了人工判断的操作,但其结果也未令人满意。
第一、二种方法表现了较好的敏感性及特异性,有一定的临床评价价值,为今后计算机辅助评价淋巴结良恶性的研究提供了一定的思路,但其中也存在一定的不足,值得今后进一步探讨。在第二种方法中对于小病变的判断表现了其局限性,由于其最终的斜率值是所有径线上斜率值的均值,所以病变组织特征一定程度地被正常组织所掩盖。而第一种方法中,皮髓界限的确定更多的是依靠观察者对内外信号强度的差异进行判断,一方面对观察者仍有一定的要求。
另一方面,对于结构紊乱的转移淋巴结其界限很难判断。由于肿瘤转移部分淋巴结已失去其原有形态,其实际已经不存在真正组织病理学意义上的皮髓质分界,这时诊断医师所划分的界限实际是图像中的灰度差异较大的区域。但这一差异也能够使其外部ADC与内部ADC的比值变得更小。也能够被判断为肿瘤转移。
本研究是在淋巴结ADC图分析方向上的一个初步尝试,从其中获得了一些经验,其中以下几点值得在未来的研究和实践中予以关注。首先,在未来的方法设计中应一定程度的突出局部ADC值减低区的权重,使异常部分不易被正常淋巴结所淹没。其次,由于淋巴结侵犯程度不同,部分淋巴结的结构层次已消失,并且正常淋巴结中也存在皮髓质增生程度的差异,所以是否应将不同侵犯程度及不同皮髓质增生程度不同的淋巴结单独分层分析,并且如何从图像上自动化或半自动的将其准确并合理的进行分层分组,都是今后值得探讨的问题。相信在不远的未来,我们会提出更能符合临床需求的分析方法,并服务于临床工作。
综上所述,利用ADC分布情况利用计算机辅助判断淋巴结的良恶性,具有一定的临床应用潜力,能够客观的对淋巴结性质进行判别,具有一定的敏感性及特异性。
[References]
[1]Nagamachi S, Wakamatsu H, Kiyohara S, et al. Comparison of diagnostic and prognostic capabilities of18F-FDG-PET/CT, ¹³¹I-scintigraphy, and diffusion-weighted magnetic resonance imaging for postoperative thyroid cancer. Jpn J Radiol, 2011, 29(6): 413-422.
[2]Chen W, Jian W, Li HT, et al. Whole-body diffusionweighted imaging vs. FDG-PET for the detection of nonsmall-cell lung cancer. How do they measure up? Magn Reson Imaging, 2010, 28(5): 613-620.
[3]Lind P, Kohlfürst S. Respective roles of thyroglobulin,radioiodine imaging, and positron emission tomography in the assessment of thyroid cancer. Semin Nucl Med, 2006,36(3): 194-205.
[4]Holzapfel K, Duetsch S, Fauser C, et al. Value of diffusionweighted MR imaging in the differentiation between benign and malignant cervical lymph nodes. Eur J Radiol, 2009,72(3): 381-387.
[5]Liu Y, Liu H, Bai X, et al. Differentiation of metastatic from non-metastatic lymph nodes in patients with uterine cervical cancer using diffusion-weighted imaging. Gynecol Oncol,2011, 122(1): 19-24.
[6]Fornasa F, Pinali L, Gasparini A, et al. Diffusion-weighted magnetic resonance imaging in focal breast lesions: analysis of 78 cases with pathological correlation. Radiol Med,2011, 116(2): 264-275.
[7]Sumi M, Sakihama N, Sumi T, et al. Discrimination of metastatic cervical lymph nodes with diffusion-weighted MR imaging in patients with head and neck cancer. AJNR Am J Neuroradiol, 2003, 24(8): 1627-1634.
[8]Abdel Razek AA, Soliman NY, Elkhamary S, et al.Role of diffusion-weighted MR imaging in cervical lymphadenopathy. Eur Radiol, 2006, 16(7): 1468-1477.
[9]Gonzalez RC, Woods RE. Digital image processing using MATLAB. 2nd edtion. USA: Gatesmark Publishing, 2009: 486-534.
[10]Deron PB, Bonte KM, Vermeersch HF, et al. Lymph node metastasis of squamous cell carcinoma from an unknown primary in the upper and middle neck: impact of (18)f-fluorodeoxyglucose positron emission tomography/computed tomography. Cancer Biother Radiopharm, 2011,26(3): 331-334.
[11]Dighe S, Purkayastha S, Swift I, et al. Diagnostic precision of CT in local staging of colon cancers: a meta-analysis.Clin Radiol, 2010, 65(9): 708-719.

