犬肝纤维化MR弥散加权成像及VEGF表达与病理对照研究
章雅琴,李从蕊,胡跃群,骆 雷,廖云杰,王 维
肝纤维化是各种慢性肝病向肝硬化发展的必经阶段。肝纤维化的早期诊断及严重程度判定在慢性肝病的早期治疗和预后判断中有重要意义。以小动物如鼠、兔等为主的肝纤维化模型,肝脏体积小,耐受力差,死亡率高;且成模时间短,多在12~18周左右,与人类慢性肝病的致病过程有一定差别。在基于小动物模型肝纤维化形态学的传统影像方法研究中,未发现比较敏感和特异的指标。
本研究拟利用中华田园犬模型模拟人慢性肝纤维化过程,在建立肝纤维化的过程中,动态进行肝脏DWI成像、血管内皮生长因子(VEGF)检测并与常规病理结构改变进行对照分析;在肝纤维化动态改变过程中,从分子水平对其结构变化进行评价。对评价肝纤维化的指标进行探索,以期提高肝纤维化的影像诊断水平。
本实验符合科学技术部2006年《关于善待实验动物的指导性意见》的要求[1],已经过本院伦理委员会同意。
1 材料与方法
1.1 犬肝纤维化模型的制备
健康雄性中华田园犬,12只,体重9~12 kg,24月龄,普通喂养2周后,随机分为2组,实验组10只,对照组2只。实验组腹腔注射50% CCl4植物油混合剂,注射剂量按0.125 ml/kg体重,每周2次;6月后根据动物的饮食、体重反应情况,剂量调整为0.15 ml/kg;高脂低蛋白喂养,以自来水为饮料。对照组采用普通喂养,腹腔注射相同剂量的生理盐水,每周2次。每4周行MR扫描及肝穿刺活检1次,共获得48组动物肝脏与病理对照的资料。
1.2 MR扫描方法及图像后处理
采用德国西门子公司的Siemens Magnetom Avanto 1.5 T超导型磁共振成像仪,体部相控阵线圈,于扫描前30分钟肌肉注射3%戊巴比妥钠(1~1.5 ml/kg体重)将动物麻醉,取左侧卧位,用腹带加压腹部,腹、背侧各放一沙袋固定,将肝脏置于线圈中心。常规T1WI、T2WI扫描,DWI采用单次激发平面回波成像序列,弥散敏感梯度b值取800 s/mm2,具体参数:TR=6400 ms,TE=105 ms, 矩阵192×160,层厚5.0 mm,层间距0 mm, FOV 168 mm×283 mm,激励次数(NSA)1次。
常规T1WI、T2WI扫描图像:观察肝脏大小、形态、边缘、各叶比例,肝实质信号均匀度,脾脏大小的改变,有无腹水。
DWI图像:使用磁共振仪配套计算机软件进行后处理,软件自动产生ADC伪彩图。利用ROI技术在ADC图像上测得肝脏表观弥散系数(ADC)。ROI为手工画出,面积100~200 mm2,同时避免靠近肝脏边缘、避开大血管、胆管及伪影,ROI应大于100个像素。选取3个不同层面,每个层面取3个肝脏感兴趣区(肝左叶1个,肝右叶2个),将9个测得值取算数平均值,作为肝脏ADC值;并计算相应感兴趣区的指数表观弥散系数(eADC值)。ADC值与eADC值的计算公式为:ADC=In(S低/S高)/(b高-b低),eADC=S高/S低。S高为b高=800 s/mm2时的DWI图像上肝脏的信号值。S低为b低=0 s/mm2时肝脏的信号值。In为自然对数。由ADC值与eADC值计算公式可推导出:eADC=e-b*ADC。
1.3 肝脏组织病理学
每次MR扫描结束后立即通过超声引导下穿刺取得肝组织,病理取材尽量与MR中ROI设置层面相对应,并用10%福尔马林溶液固定,48 h内石蜡包埋做成4 μm连续切片,按常规程序进行HE染色、Masson染色及VEGF免疫组织化学染色。
肝纤维化分期采用如下标准[2]:0期:无纤维化;1期:汇管区纤维化扩大,局限于窦周和小叶内纤维化;2期:汇管区周围纤维化,纤维间隔形成,小叶结构保留;3期:纤维间隔伴小叶结构紊乱,无肝硬化;4期:假小叶形成,早期肝硬化。
VEGF判定标准参照Park等[3]的方法:先用低倍镜(40倍)观察整个切片,选定VEGF染色最强处,然后在200倍光镜下计数100个细胞,阳性染色细胞<5%为阴性(-);5%~50%为阳性(+);>50%为强阳性(++)。
1.4 统计学分析
统计学分析采用SPSS 13.0软件包,P<0.05认为有统计学意义。
所有计量资料用mean±S表示,ADC值及eADC值与肝纤维化程度的相关性,用Spearman相关分析;ADC值及eADC值在不同程度纤维化分期间差异,先采用单因素方差分析,存在显著性差异,再用LSD法进行多重比较。
VEGF的表达以等级形式表示:阴性(-)、阳性(+)、强阳性(++)。采用秩和检验其在肝纤维化各期中的表达水平差异。
2 结果
2.1 肝脏大体标本改变
动物制模周期为1年,实验终止后的大体病理显示:肝脏质地变硬,失去光泽,边缘圆钝;肉眼观:肝脏表面凹凸不平,呈小结节状(图1)。
2.2 MR-DWI肝脏形态影像表现与病理对照
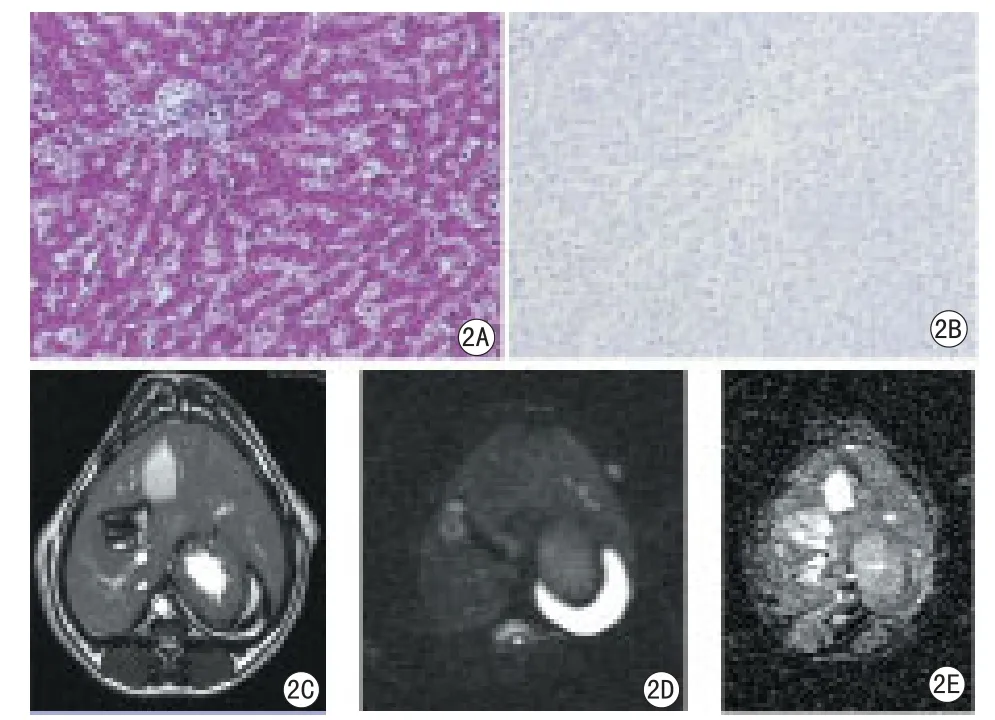
图2 正常犬肝脏MR成像及病理组图。正常犬肝组织肝小叶结构完整;未见明显胶原组织沉积;未见明显VEGF阳性着色细胞;MRI示肝脏大小、形态正常,边缘光滑锐利,实质信号均匀。2A:Masson染色100倍;2B:VEGF染色 100倍;2C:T2WI;2D:DWI图像;2E:ADC图Fig 2 The liver of normal dog MRI and pathology. In the control group, the structure of liver lobule is normal, no signi fi cant collagen deposition; no signi fi cant VEGF positive cells; The size and morphology of liver are normal, smooth edges, the signal of liver parenchyma is homogenous in MRI.
随造模时间延长,实验组活检标本病理显示:纤维化程度逐渐加重,肝脏汇管区、中央静脉周围及肝窦壁纤维沉积增多并向外延伸,逐渐形成纤维间隔,进而肝小叶结构紊乱,部分肝小叶正常结构消失,形成假小叶,出现早期肝硬化,各期肝纤维化模型:S0 (n=10)、S1 (n=9)、S2 (n=9)、S3(n=10)、S4 (n=10),见表1;同时血管内皮生长因子表达水平亦呈逐渐增高趋势(表2);但是MR-DWI肉眼观肝脏大小、形态及各叶比例未见明显异常,形态学不能显示出正常肝脏与纤维化肝脏之间的差别(图2~6)。
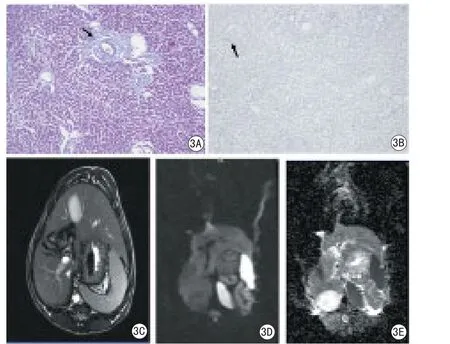
图3 肝纤维化S1期犬肝脏MRI成像及病理组图。肝纤维化S1期汇管区可见轻度增生的胶原纤维;可见散在VEGF阳性着色细胞;MRI示肝脏大小、形态未见异常,边缘光滑锐利,实质信号均匀。3A:Masson染色100倍;3B:VEGF染色100倍;3C:T2WI;3D:DWI图像;3E:ADC图Fig 3 Liver fi brosis-S1 MR imaging and pathology. Fibrosis-S1 a few of collagen fibers located in portal area; A few VEGF positive cells; the size and shape are abnormal, smooth edges, the signal of liver parenchyma is homogenous in MRI.
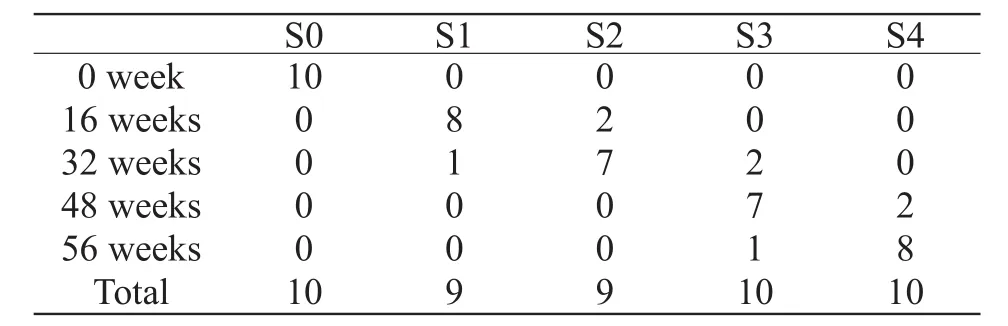
表1 实验组制模不同时期肝纤维化程度对照表Tab 1 Comparsion liver fi brosis of the experimental group in different stage of molding
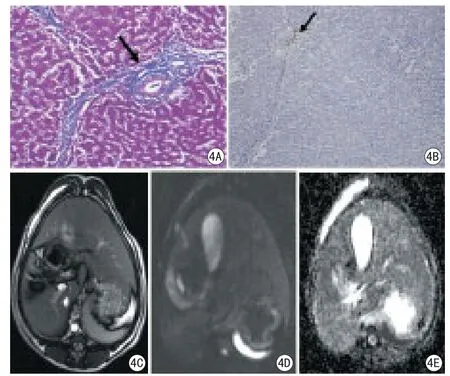
图4 肝纤维化S2期犬肝脏MRI成像及病理组图。肝纤维化S2期胶原纤维向小叶内延伸,但小叶结构仍保持完整;VEGF阳性着色细胞增多;MRI示肝脏大小、形态未见异常,边缘光滑锐利,实质信号均匀。4A:Masson染色200倍;4B:VEGF染色100倍;4C:T2WI;4D:DWI图像;4E:ADC图Fig 4 Liver fibrosis-S2 MR imaging and pathology. Fibrosis-S2 collagen fibers extend to the lobules, but the structure of liver lobule is still intact;VEGF positive cells increased; The size and shape are abnormal, smooth edges, the signal of liver parenchyma is homogenous in MRI.
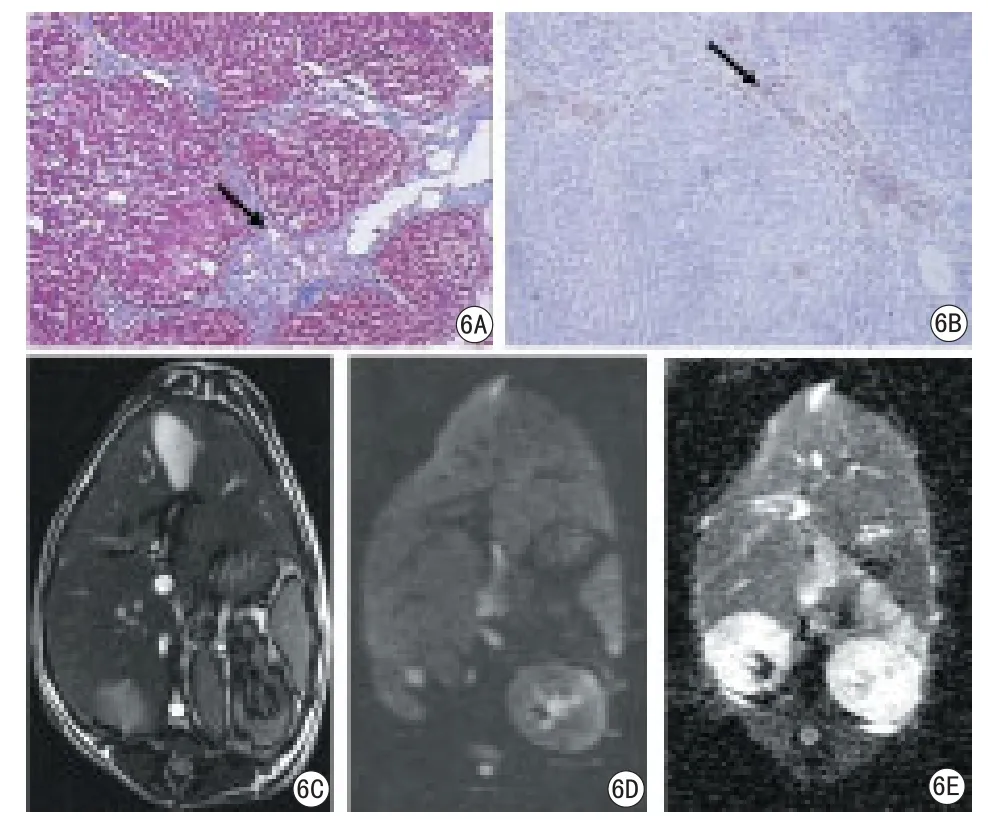
图6 肝纤维化S4期MRI成像及病理组图。肝纤维化S4期汇管区、肝窦壁、中央静脉周围及肝小叶内可见明显纤维化,部分假小叶形成,出现早期肝硬化改变;纤维带内异型增生肝细胞及血管腔内容物VEGF强阳性表达。MRDWI肝脏大小、形态未见异常,边缘光滑锐利,实质信号均匀。6A:Masson染色100倍;6B:VEGF染色100倍;6C:T2WI;6D:DWI图像;6E:ADC图Fig 6 Liver fi brosis-S4 MR imaging and pathology. Fibrosis-S4,around portal area, walls of sinusoids, central veins and the liver lobules are significant fibrotic, some pseudo-lobule formation;Strong positive expression of VEGF is much in the the fi ber band and vascular lumen. The size and shape are abnormal, smooth edges, the signal of liver parenchyma is homogenous in MRI.
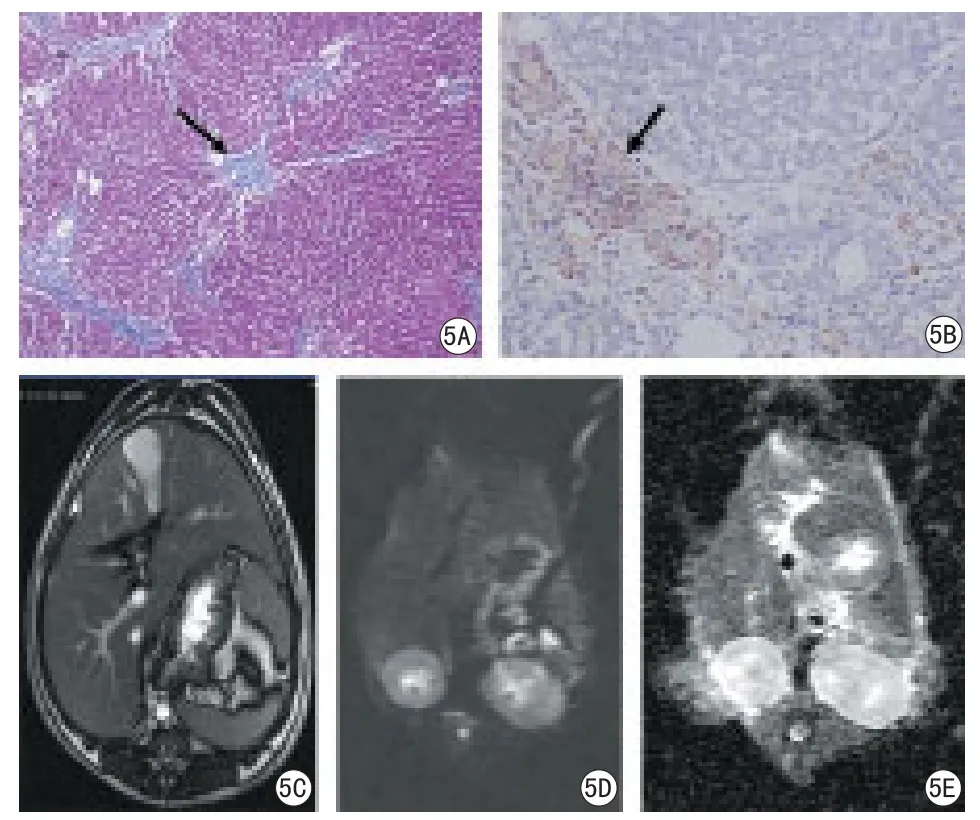
图5 肝纤维化S3期犬肝脏MRI成像及病理组图。肝纤维化S3期肝脏淤血,肝细胞肿胀,胶原纤维明显向小叶内延伸形成纤维间隔,肝小叶结构紊乱;VEGF阳性着色细胞明显增多呈阳性表达,以纤维带内显著;MR-DWI肝脏大小、形态未见异常,边缘光滑锐利,实质信号均匀。5A:Masson染色100倍;5B:VEGF染色200倍;5C:T2WI;5D:DWI图像;5E:ADC图Fig 5 Liver fi brosis-S3 MR imaging and pathology. Fibrosis-S3, liver congestion, liver cell swelling, collagen fibers is significantly extented to the lobular, fibrous septa is formed; Lobules of liver is disorder; VEGF positive cells are significantly increased, especially in the fiber band; the size and shape are abnormal,smooth edges, the signal of liver parenchyma is homogenous in MRI.
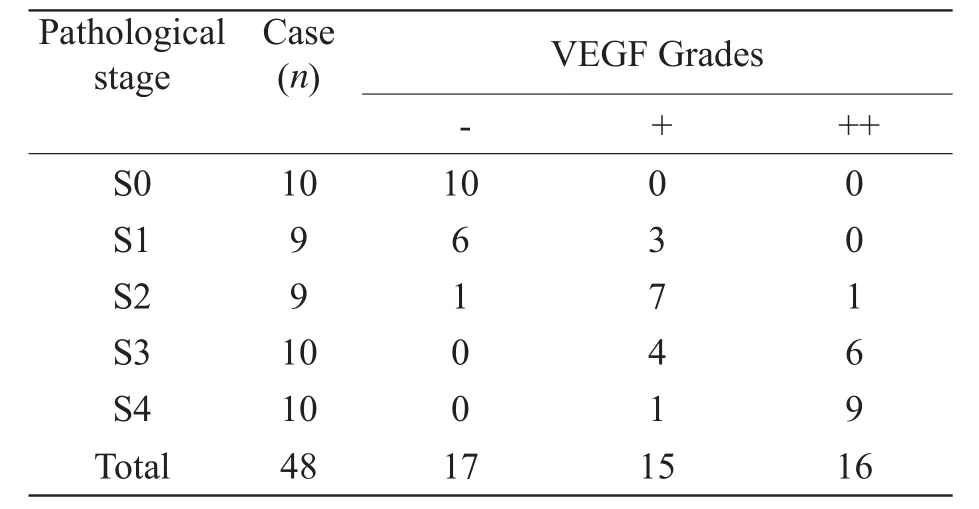
表2 犬肝纤维化各期VEGF表达水平对照表Tab 2 Comparsion liver fi brosis stages of VEGF expression
2.3 DWI ADC值与EADC值与肝纤维化程度的关系
随肝纤维化程度加重,ADC值逐渐减低,eADC值依次增高,差异有统计学意义(P<0.05),见表3,ADC值与肝纤维化程度显著负相关(P<0.01);EADC值与肝纤维化程度显著正相关(P<0.01),见表4。
2.4 ADC值与EADC值在肝纤维化诊断中的价值
将ADC值的1100或eADC值的0.42视为诊断肝纤维化的阈值,则ADC值区分正常肝脏与肝纤维化的特异性为90%,敏感性为97.4%;EADC区分正常肝脏与纤维化的特异性为81.8%,敏感性为99.3%,见表5。
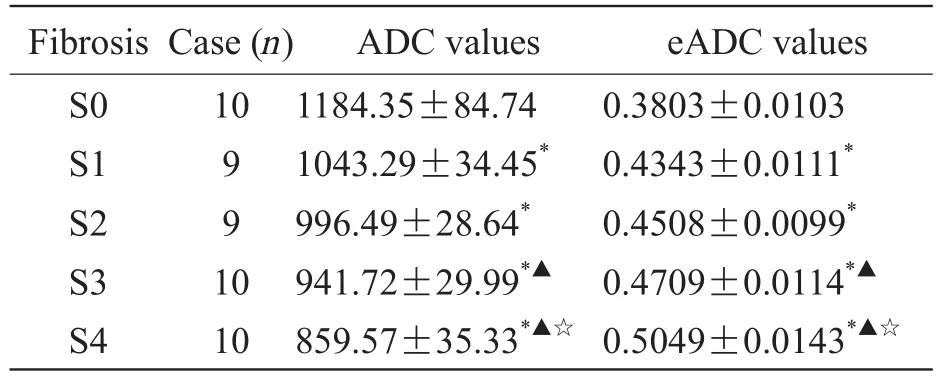
表3 不同程度纤维化分期组间ADC值、eADC值结果Tab 3 The results of ADC values and eADC values in varying degrees of fi brosis
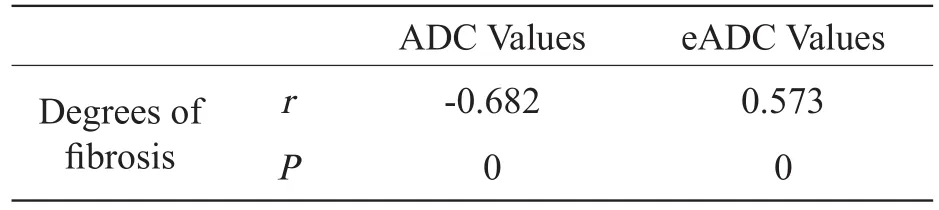
表4 ADC值、eADC值与纤维化程度的相关性Tab 4 The correlation between ADC values (eADC values)and fi brosis
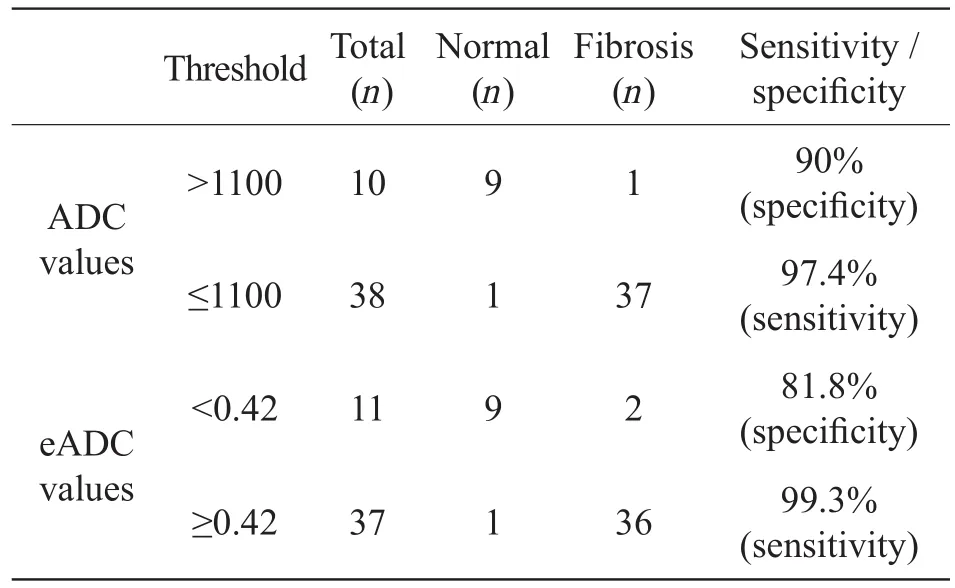
表5 ADC值与EADC值在肝纤维化诊断中的价值Tab 5 Diagnostic value of ADC values and eADC values in hepatic fi brosis
3 讨论
3.1 肝纤维化动物模型的制备
目前文献中所选用的实验动物多以小动物如鼠、兔等为主,但鼠、兔肝脏体积小,耐受力差,死亡率高;且成模时间短,多在12~18周左右,不符合人类慢性肝病的致病过程。本研究选用犬作为肝纤维化动物模型,相对啮齿类小动物,其饲养简单,生命力强,肝脏体积大,有利于影像学观察及肝穿病理检测,从而可以对肝纤维化进程进行动态观察与评估。另外本实验采用腹腔注射小剂量、低浓度的CCl4植物油溶液,配合高脂低蛋白饮食的制模方法,虽制模周期长,但肝纤维化进展稳定,模拟了从肝细胞变性-肝纤维化-早期肝硬化的全过程,更接近人类慢性肝病的发生,同时降低实验动物死亡率,且成活时间长,便于动态观察肝纤维化进展,并获得纤维化各期模型,有利于进一步研究肝纤维化病理与影像学的相关改变。
3.2 DWI对肝纤维化的诊断价值
DWI是基于组织内水分子的弥散运动。机体内水分子的运动会受到细胞膜及组织间质中大分子的限制;而不同的组织结构和分子环境对水分子热运动的限制程度不同,DWI通过检测机体组织内水分子的运动状态来反映组织的结构功能特点[4-5]。研究表明ADC值可以量化反映组织的病理变化[6-7]。但是肝纤维化及肝硬化对ADC值的影响还未取得一致的意见。大多数学者[8]研究认为肝纤维化时由于细胞外间隙内大量纤维组织弥漫性增生、沉积,限制了水分子的扩散运动导致ADC值减小。而杨正汉等[9]认为ADC值降低的主要原因可能是因为纤维组织的增生影响了肝脏微循环,导致肝实质内血流灌注减少所致。不少国内外学者[10-14]研究发现,肝纤维化时ADC值也较正常减低,肝纤维化程度增加与肝实质ADC值的下降之间呈显著负相关。
在本实验中,通过大动物的慢性肝纤维化的动态研究显示,虽肝纤维化程度加重,但常规MR平扫未见肝脏大小、形态及信号异常,从形态学上不能显示出正常肝脏与纤维化肝脏之间的差别。但通过DWI成像,随着肝纤维化程度的加重,ADC值逐渐降低,EADC值逐渐升高;且不同程度纤维化组间ADC值、EADC值差异亦有统计学意义。ADC值的大小与纤维化程度呈显著负相关,EADC值的大小与纤维化程度呈显著正相关。DWI参数可以对不同程度肝纤维化做定量分析,且其敏感性及特异性较高,统计结果显示:将ADC值的1100或EADC值的0.42 为诊断肝纤维化的阈值,有一定价值。因此,ADC值及EADC值是不同程度纤维化较有意义的评价指标。
结合现有文献分析,肝纤维化时ADC值下降可能与下列因素有关:①由于细胞外间隙内大量纤维组织弥漫性增生、沉积,限制了水分子的扩散运动;②增生紊乱的纤维组织影响了肝脏微循环,导致肝内血流灌注减少;③肝纤维化过程中同时伴有肝细胞水肿变性、炎细胞增多亦限制水分子运动。
3.3 肝纤维化过程中VEGF的改变
VEGF与各种肝病的关系逐渐受到重视,其在各种肝病中的作用已被广泛研究,并证实VEGF在肝窦内皮细胞的生长,对肝细胞再生以及良、恶性肝病的发生发展均起重要作用。研究表明,肝细胞表达的血管生长因子是肝纤维化进展的关键因素[15]。严家春等[16]研究认为VEGF在肝内血管增生、改建中起到关键作用,而肝内微循环血管破坏、炎症、阻塞及增生病变和肝窦毛细血管化,则是引起肝坏死、肝纤维化的最主要原因之一。本实验结果发现随肝纤维化程度加重血管内皮生长因子表达水平明显增高。肝纤维化时肝内血流灌注减少,氧分压降低,缺氧导致VEGF的表达上调,VEGF诱导肝细胞、肝窦内皮细胞、血管内皮细胞有丝分裂,有利于肝纤维化。
本实验结果表明,DWI比传统形态影像能更早地反映肝纤维化病变。随肝纤维化程度加重,肝脏ADC值下降,eADC值升高,ADC值及eADC值与肝纤维化程度具有良好的相关性,提示DWI具有定量分析肝纤维化严重程度的能力。随肝纤维化进展,VEGF表达水平增高,因此调整VEGF的表达强度,改善肝组织血液淤积缺氧,是抗肝纤维化治疗中亟待研究解决的重要课题。
[1]The Ministry of Science and Technology of the People's Republic of China. Guidance suggestion of caring laboratory animals. 2006-2009.中华人民共和国科学技术部.关于善待实验动物的指导性意见.2006-2009.
[2]Chinese Society of Hepatology of Liver fibrosis group.Consensus on evaluation of the diagnosis and efficacy of hepatic fibrosis. Chinese Journal of Hepatology, 2002,10(5): 327-328.中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识.中华肝脏病杂志, 2002, 10(5): 327-328.
[3]Park YN, Kim YB, Yang KM, et al. Increased expression 0f vascular endothelial growth factor and angiogenesis in the early stage of multistep hepatocarcinogenesis. Arch Pathol Lab Med, 2000, 124(7): 1061-1065.
[4]Chenevert TL, Brunberg JA, Pipe JG. Anisotropic diffusion in human white matter: demonstration with MR techniques in vivo. Radiology, 1990, 177 (2): 401-405.
[5]Laghi A, Catalano C, Assael FG, et a1.Diffusion-weighted echo-planar sequences for the evaluation of the upper abdomen: technique optimization. Radiol Med, 2001,101(4): 213-218.
[6]Ichikawa T, Haradome H, Hachiya J. et al. Diffusionweighted MR imaging with a single-shot echo-planar sequence: debection and characterization of focal hepatic lesions. AJR, 1998, 170(2): 397-402.
[7]Chan JH, Tsui EY, Luk SH, et al. Diffusion-weighted MR imaging of the liver: distinguishing hepatica bscess from cystic or necrotic tumor. Abdom Imaging, 2001, 26 (2):161-165。
[8]Amano Y, Kumazaki T, Ishihara M. Single-shot difusionweighted echo-planar imaging of normal and cirrhotic livers using a phased-array multicoil. Acta Radiol, 1998, 39(4):440-442.
[9]Yang ZH H, Xie JX, Zhou C, et al. Evaluation of Liver Cirrhosis with Diffusion-weighted MR Imaging: An Experimental Study. Chin J Med Imag Technology, 2002,18(9): 849-851.杨正汉,谢敬霞,周诚,等.肝硬化组织表观扩散系数改变及其可能机制的实验研究.中国医学影像技术, 2002,18(9): 849-851.
[10]Koinuma M, Ohashi I, Hanafusa K, et a1. Apparent diffusion coefficient measurements with diffusionweighted magnetic resonance imaging for evaluation of hepatic fi brosis. Magn Reson Imaging, 2005, 22(1): 80-85.
[11]Boulanger Y, Amara M, Lepanto L, et al. Diffusionweighted MR imaging of the liver of hepatitis C patients.NMR Biomed, 2003, 16(3): 132-136.
[12]Aube C, Racineux PX, Lebigot J, et al. Diagnosis and quantification of hepatic fibrosis with diffusion weighted MR imaging: Preliminary results. J Radiol, 2004, 85(3):301-306.
[13]Bachir T, Anuj JT, Mariela L, et al. Diffusion-Weighted MRI for Quantification of Liver Fibrosis: Preliminary Experience. AJR 2007, 189(4): 799-806.
[14]Oner AY, Celik H, Oktar SO, et a1.Single breath-hold diffusion-weighted MRI of the liver with parallel imaging:initial experience. Clin Radiol, 2006, 61(11): 959-965.
[15]Corpechot C, Barbu V, Wendum D, et al. Hypoxia-induced VEGF and collagen I expressions are associated with angiogenesis and fibrogenesis in experimental cirrhosis.Hepatology, 2002, 35(5): 1010-1021.
[16]Yan JC, Shao XA, Chen WB, et al. Expression change in vascular endothelial growth factor in hepatic tissues of hepatitis B patients[J],Med J Chinese People's Liberation Army, 2005, 30(12):1064-1067.严家春,邵先安,陈文笔,等.乙型肝炎肝组织血管内皮生长因子的表达变化.解放军医学杂志, 2005, 30(12):1064-1067.

