蓝靛果中花色苷含量的测定及其体外抗氧化性
刘奕琳,王振宇,2*
(1.东北林业大学 林学院,哈尔滨 150040;2.哈尔滨工业大学 食品科学与工程学院,哈尔滨150090)
花色苷是一类具有苯并吡喃结构的类黄酮化合物,具有预防心脏病、抗大脑炎症、抗癌、延缓衰老、抗辐射、清除自由基、抗氧化等多种功效[1-3]。蓝靛果是一种蓝黑色的浆果,含有丰富的天然绿色无毒的色素,是天然色素的良好来源。马自超[4]鉴定了蓝靛果色素中的主要成份是花青定-3-葡萄糖,其他少量成份是花青定-3,5-双葡萄糖、花青定-3-芸香糖、花青定-3-龙胆二糖、芍药定-3-葡萄糖。本实验通过pH 示差法[5]测定蓝靛果干物质中花色苷的含量,并测定其对羟自由基、超氧自由基、DPPH自由基和ABTS自由基的清除能力。
1 材料与方法
1.1 实验材料
蓝靛果(Loniceraedulis),采摘于大兴安岭;无水乙醇;乙酸钠;氯化钾;盐酸;DPPH Sigma公司、ABTS Sigma公司、无水乙醇、FeSO4、H2O2、水杨酸钠、焦性没食子酸、铁氰化钾、三氯乙酸、三氯化铁。
1.2 实验仪器
电热恒温鼓风干燥箱;粉碎机;电子分析天平;旋转蒸发仪;离心机;精密pH计;紫外分光光度计。
1.3 实验方法
1.3.1 蓝靛果花色苷的提取
将蓝靛果烘干后用粉碎机粉碎,取10g蓝靛果粉末,用200mL 60%乙醇溶液在常温下浸提1h,将提取物在4000r/min离心10min后真空抽滤,滤饼再重复浸提2次,合并3次上清液,在40℃下真空旋转蒸发浓缩,定容至250mL得花色苷提取液。取少量花色苷提取液,稀释至一定体积,进行光谱扫描,确定其测定波长。
1.3.2 pH示差法的原理及缓冲液的配制
花色苷的颜色随pH值的改变而发生变化,而干扰物质的特征光谱不随pH的改变而变化。为了让pH示差法更准确更灵敏,选择的2个pH处测定的花色苷的吸光值差异最显著,并且花色苷相当稳定。pH为1时,花色苷以2-苯基苯并吡喃的形式存在。pH为4.5时,花色苷以甲醇假碱的形式存在,因此选择pH为1.0和4.5[6]
pH4.5的缓冲液的制备:准确称取1.64g乙酸钠用蒸馏水定容100mL,用盐酸调pH(4.5±0.1)。
pH 1的缓冲液的制备:准确称取1.49gKCl用蒸馏水定容至100mL。准确量取1.7mL盐酸用蒸馏水定容至100mL,配制成0.2mol/L盐酸溶液,将KCl溶液与盐酸溶液以25∶67的比例混合。用KCl溶液调pH(1.0±0.1)。
1.3.3 平衡时间的确定
因为花青素在溶液介质中存在4种结构形式,这4种结构形式在某一pH下处于动态平衡,当pH改变时,动态平衡发生转移,总的趋势是pH降低时,平衡向红色的2-苯基苯并吡喃阳离子移动;pH升高时平衡向蓝色醌式移动。一定时间后达到一个新的平衡。因此提取液用缓冲液稀释后,必须先静置一段时间,等动态平衡处于稳定后,才能测定吸光值。
分别移取2份2mL花色苷提取液,分别用pH1.0和pH4.5的缓冲溶液定容至50mL,在所选择的测定波长下测定吸光值,每隔10min测定一次吸光值,直至稳定。
血液中甘油三酯含量反映了机体对脂类的利用情况,甘油三酯含量越低意味着对机体脂肪的利用率越高。本试验添加过瘤胃脂肪后,处理组甘油三酯含量均较对照组低(P>0.05),说明处理组脂肪利用率较对照组高。
1.3.4 经验公式的选择
花色苷含量(%,w/w)=(A/εL)×MW×DF×V/Wt×1000
式中:A-吸光度;ε-矢车菊花素-3-葡萄糖苷的消光系数,26900;DF-稀释因子;MW-矢车菊花素-3-葡萄糖苷的分子量,449.2;V-最终体积,mL;Wt-产品重量,mg;L-光程,1cm;A=ApH1.0-ApH4.5。
1.3.5 抗氧化指标的测定
1.3.5.1 羟自由基清除能力的测定。参照徐建国等[7]采用的水杨酸钠络合法略作改动,测定样品清除羟自由基的能力。反应体系中依次加入样品液1mL,浓度为6mmol/L FeSO4溶液2mL,浓度为6mmol/L H2O2溶液2mL,将反应体系混合均匀放置10min,再加入浓度为6mmol/L水杨酸钠溶液2mL,静置30min后于510nm波长下用蒸馏水调零,并测定吸光值A1;将上述体系中的水杨酸钠溶液用相同体积的蒸馏水代替,其他操作相同,测定吸光值A2;将上述体系中的样品溶液用相同体积的蒸馏水代替,其他操作相同,测定吸光值A0。羟自由基清除率(%)=[1-(A1-A2)/A0]×100%。
1.3.5.2 超氧自由清除能力的测定。参照郭雪峰[8]方法略作改动,测定样品清除超氧自由基的能力。反应体系中依次加入浓度为50mmol/L Tris-HCl溶液5.7mL,样品溶液0.2mL,浓度为6mmol/L邻苯三酚溶液0.1mL,将混合物反应4min,滴入2滴HCl终止反应,在320nm波长下测定吸光值A1;将邻苯三酚用等体积的蒸馏水代替,其他操作相同,测定吸光值A2;将样品溶液用等体积的蒸馏水代替,其他操作相同,测定吸光值A0。超氧自由基清除率(%)=[1-(A1-A2)/A0]×100%。
1.3.5.3 DPPH自由基清除能力的测定。参照Blois等[9]的方法略作改动,测定样品清除DPPH自由基的能力。配制0.2mmol/L DPPH乙醇溶液,放在棕色试剂瓶中于4℃保存,在试管中加入2mL DPPH乙醇溶液及2mL样品溶液,混合均匀在室温避光放置30min,于517nm波长下用无水乙醇调零,并测定吸光值A1;将DPPH乙醇溶液用等体积的无水乙醇代替,其他操作相同,测定吸光值A2;将样品溶液用等体积无水乙醇溶液代替,其他操作相同,测定吸光值A0。DPPH自由基清除率(%)=[1-(A1-A2)/A0]×100%。
1.3.5.4 ABTS自由基清除能力的测定。参照 Wanwisa等[10]方法略作改动,测定样品清除ABTS自由基的能力。用2.6mmol/mL过硫酸钾溶液溶解ABTS甲醇溶液,配制成7.4mmol/mL ABTS储备液,室温避光静置12~24h后4℃保藏。现用时取1mL储备液用甲醇稀释54.7倍,在734nm吸光值为0.700±0.020,甲醇调零。在试管中加入2.850mL ABTS测定液及0.150mL样品溶液,混合均匀在室温避光放置2h,于734nm波长下用甲醇调零,并测定吸光值A1;将ABTS测定液用等体积的蒸馏水代替,其他操作相同,测定吸光值A2;将样品溶液用等体积甲醇溶液代替,其他操作相同,测定吸光值A0。ABTS自由基清除率(%)=[1-(A1-A2)/A0]×100%。
2 结果与分析
2.1 测定波长的确定
蓝靛果花色苷的提取液经稀释后,经光谱扫描如图1所示,确定其最大吸收波长为531nm。
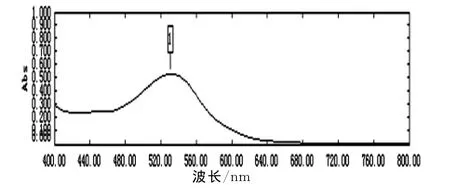
图1 光谱扫描曲线
2.2 平衡时间的确定

表1 蓝靛果花色苷在缓冲溶液中的吸光值与时间变化关系
2.3 蓝靛果干物质中花色苷的含量
由表1中的数据,取平衡时间60min,根据经验公式计算得花色苷的含量(%,w/w)=(A/εL)×MW×DF×V/Wt×1000=(1.500-0.328)×0.250×25×449.2×1000/(26900×10×1)=12.232mg/g。
2.4 清除羟自由基的能力
羟基自由基(·OH)是化学性质最活泼的一种自由基,建立一种Fenton反应产生羟基自由基的方法,以VC作为阳性对照组,测定其清除率如图2所示。
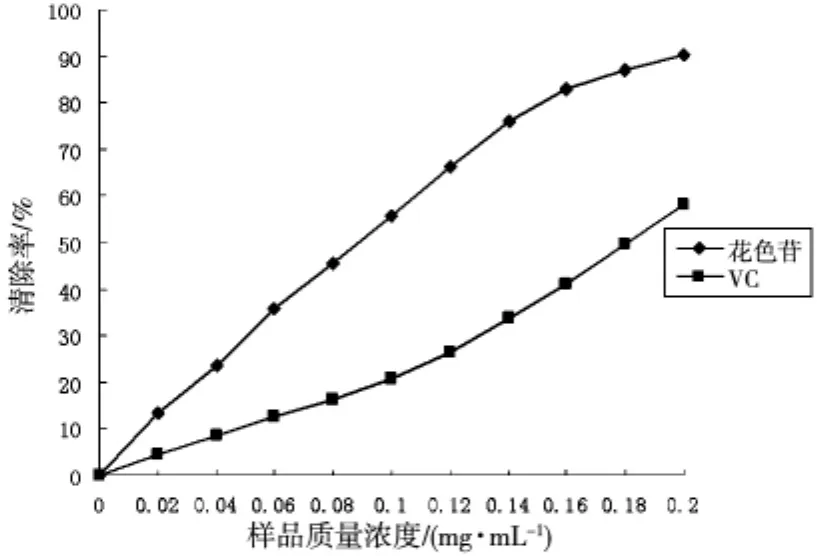
图2 样品对羟自由基的清楚能力
由图2可以看出,花色苷对羟自由基的清除率随质量浓度的增加而增大,并呈现明显的量效关系,而且清除率比VC对照组高,当质量浓度为0.2mg/mL时,花色苷的清除率为90.35%,VC的清除率为58.31%,可见蓝靛果花色苷对羟自由基有极强的清除能力。
2.5 清除超氧自由基的能力
超氧阴离子自由基(O2—·)是生物体中产生量最多的一种氧自由基。由邻苯三酚的方法,以VC作为阳性对照组,测定其清除率如图3所示。

图3 样品对超氧自由基的清除能力
由图3可以看出,花色苷对超氧自由基的清除率随质量浓度的增加而增大,并呈现明显的量效关系,但清除率比VC对照组低,当质量浓度为0.2mg/mL时,花色苷的清除率为87.35%,VC的清除率为97.53%,可见蓝靛果花色苷对超氧自由基有一定的清除能力。
2.6 清除DPPH自由基的能力
二苯基苦味肼基自由基(DPPH·)是一种稳定的以氮为中心的自由基,花色苷等抗氧化剂能与其结合使溶液颜色变淡,以VC作为阳性对照组,测定其清除率如图4所示。
由图1可以看出,花色苷对DPPH自由基的清除率随质量浓度的增加而增大,并呈现明显的量效关系,但清除率比VC对照组低,当质量浓度为0.2mg/mL时,花色苷的清除率为84.39%,VC的清除率为96.74%,可见蓝靛果花色苷对DPPH自由基有较强的清除能力。
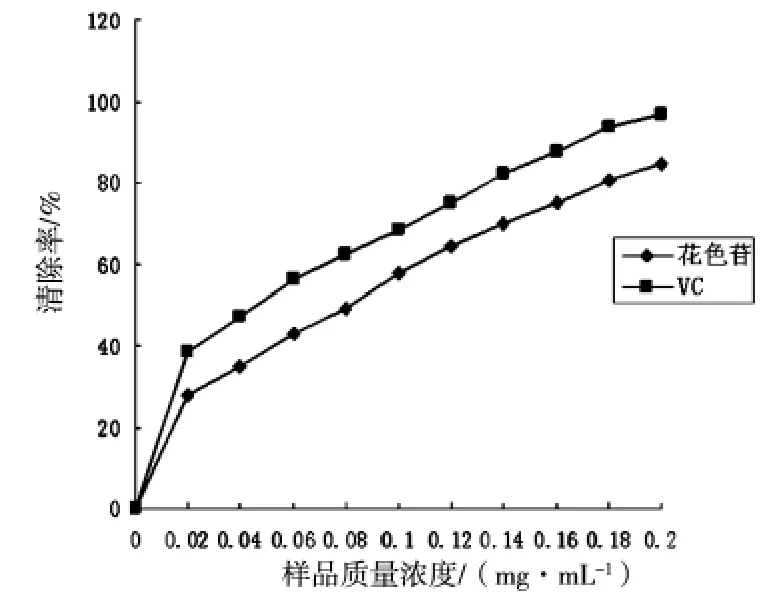
图4 样品对DPPH自由基的清除能力
2.7 清除ABTS自由基的能力
ABTS[2,2'-边氮基-双(3-乙基苯并噻吡咯啉-6磺酸)]是一种供氢体。该方法作为一种用于体外测定物质总抗氧化能力的新方法,以VC作为阳性对照组,测定其清除率如图5所示。

图5 样品对ABTS自由基的清除能力
由图5可以看出,花色苷对ABTS自由基的清除率随质量浓度的增加而增大,并呈现明显的量效关系,而且清除率比VC对照组高,当质量浓度为10μg/mL时,花色苷的清除率为87.98%,VC的清除率为60.52%,可见蓝靛果花色苷对ABTS自由基有极强的清除能力。
3 结论
蓝靛果是具有花色苷的一种浆果,实验用pH示差法测定花色苷含量,方法可靠准确,结果显示其花色苷在干物质中的含量为12.232mg/g,可见其含量丰富。
蓝靛果花色苷对四种自由基都具有较强的清除能力,对于羟自由基和ABTS自由基的清除能力较VC阳性对照组强,而对于超氧自由基和DPPH自由基的清除能力较VC阳性对照组低,实验表明,蓝靛果花色苷具有较强的抗氧化性,可以作为天然绿色的抗氧化剂,广泛应用于食品、化妆品、药品等领域,具有很大的发展前景。
[1]李韬,张宏宇,吕玉璋.花色苷类色素的研究进展[J].农业科技与装备,2010(5):23-26.
[2]倪勤学,霍艳荣,陆国权.花色苷保健功能的研究进展[J].安徽农业科学,2010,38(35):20025-20028.
[3]Nozomu Matsunaga,Kazuhiro Tsuruma,etal.Inhibitory Actions of Bilberry Anthocyanidins on Angiogenesis[J].Phytother Res,2010,24(1):42-47.
[4]马自超.蓝靛果中花青素色素的研究[J].中国野生植物资源,1996(2):1-3.
[5]孙建霞,张燕,孙志健,等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学,2009,30(5):263-26.
[6]Lee J,Durst RW,Wrolstad RE.Determination of total monomeric anthocyanin pigment content of fruit juices,beverages,natural colorants,and wines by the pH differential method:collaborative study[J].J AOAC Int,2005,88(5):1269-1278.
[7]徐建国,胡青平.决明子水提物体外清除自由基活性的研究[J].食品科学,2006,27(6):73-7.
[8]郭雪峰,岳永德,汤锋,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[9]Blois ms.Antioxidant determinations by the use of a stable free radical[J].Nature,2002,26:1199-1200.
[10]Wanwisa B,Soottawat B,Wonnop V,et al.Antioxidative activity of Mungoong,an extract paste,from the cephalothorax of white shrimp(Litopenaeus vannamei)[J].Food Chemistry,2008,106:185-193.

