洋葱皮总黄酮纤维素酶法提取及抗氧化研究
陈 佳,徐怀德,*,米林峰,包 蓉
洋葱皮总黄酮纤维素酶法提取及抗氧化研究
陈 佳1,徐怀德1,*,米林峰2,包 蓉1
(1. 西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2. 榆林市产品质量监督检验所,陕西 榆林 719000)
采用中心组合试验设计研究纤维素酶法辅助提取洋葱皮中总黄酮的工艺条件,并对洋葱皮总黄酮的抗氧化活性进行测定。结果表明:洋葱皮总黄酮最佳提取工艺为纤维素酶用量0.52%、pH5.0、提取温度48℃、提取时间105min、料水比(g/mL)1:40,在此条件下,提取率为2.32%。洋葱皮总黄酮清除DPPH自由基和羟自由基的IC50分别为3.751、4.267μg/mL;同时洋葱皮黄酮还原能力较强,高于茶多酚。洋葱皮总黄酮抗氧化性强,是一种天然有效的抗氧化剂。
洋葱皮;总黄酮;纤维素酶;提取;抗氧化活性
洋葱(Allium cepa L.)为百合科葱属植物,世界洋葱产量约4.4亿吨,仅次于西红柿,约占世界蔬菜总量的10%[1]。洋葱皮中除含有丰富的蛋白质、色素、多糖外,还含有4.4%黄酮类物质[2]。洋葱食用和加工过程中产生2%~3%洋葱皮,数量相当可观,如不加以利用,将造成资源的浪费和环境污染。
黄酮类化合物具有抗氧化、治疗心脑血管疾病、抗癌、抗炎等作用[3-6]。洋葱最外层表皮中槲皮素含量最高,同时黎乃维等[7]研究表明同一品种洋葱中的黄酮含量从外鳞叶到内鳞叶依次降低。洋葱总黄酮提取、黄酮含量测定及性质的初步鉴别已有文献报道[8-11],但酶法提取洋葱皮中总黄酮的研究未见报道。与传统提取方法相比,酶法提取具有无毒性、效率高、条件温和等优势[12],本研究通过纤维素酶法辅助提取洋葱皮总黄酮,探讨洋葱皮总黄酮的抗氧化性,为洋葱皮总黄酮开发利用提供一定参考。
1 材料与方法
1.1 材料与试剂
黄皮洋葱(山东海洋食品营养研究所),取其外表皮,洗净后于真空干燥箱中55℃烘干、粉碎、过40目筛,制成洋葱皮粉备用。
芦丁标品 中国药品生物制品检定所;纤维素酶(60000 U/g) 西安沃尔森生物技术有限公司;其他试剂均为分析纯。
1.2仪器与设备
ALC-210.3型电子天平 德国赛多利斯公司;HHS6双列六孔型电热水浴锅、FWl00型高速万能粉碎机、KQ-B30型气流烘干器 北京科伟有限公司; SHB-III循环水式多用真空泵 郑州长城科贸有限公司;DHG-9070A型热恒温鼓风干燥箱 上海精宏实验设备有限公司;PHS-3C型精密pH计 上海精密科学仪器有限公司;R-200型旋转蒸发仪;UV-1700型紫外-可见分光光度计。
1.3 方法
1.3.1 标准方程的建立
AlCl3显色法[13]:精密称取105℃条件干燥至质量恒定的芦丁标品10mg,用50%乙醇溶解,摇匀,定容至100mL,得到0.1mg/mL芦丁标准品溶液,作为贮备液备用。分别精密吸取上述芦丁标准液0、2.0、3.0、4.0、5.0、6.0、7.0mL于25mL比色管中,加入1.5% AlCl38mL和醋酸-醋酸钠缓冲液(pH5.5) 4mL,并用50%乙醇水溶液定容至刻度,摇匀,静置0.5h。在波长415nm下测吸光度,以吸光度为纵坐标,以显色液中芦丁的质量(mg)为横坐标,绘制标准曲线:A=31.77x +0.006,R2=0.9997。
1.3.2 洋葱皮总黄酮的制备和含量测定
准确称取1g洋葱皮样品,加入一定量的纤维素酶和醋酸-醋酸钠缓冲溶液,在不同条件下进行酶解反应。反应后将提取液煮沸5min,使酶灭活,过滤。将滤液真空浓缩至原液的1/3,定容至50mL,待测。
取各组不同试验条件下所得的定容样液1mL,按照标准曲线建立的方法,测出其吸光度,根据标准曲线,求出提取液中总黄酮的含量,并计算黄洋葱皮中总黄酮提取率。

式中:A为吸光度;V1为样品定容的体积;V2为待测样液的体积;m为原料质量。
1.3.3 洋葱皮总黄酮酶法提取的试验设计

表1 洋葱皮总黄酮酶法提取中心组合试验因素水平表Table 1 Variables and their coded levels in CCD design
根据预试验及单因素试验结果,固定料水比为1:40,选取纤维素酶用量、提取时间、pH值和提取温度作为中心组合试验因素,中心组合试验数据使用Design Expert 7.0软件,见表1。
1.3.4 洋葱皮总黄酮的抗氧化性研究
本实验选清除DPPH自由基、·OH的能力以及还原力作为测定洋葱皮总黄酮抗氧化能力的指标,同时以茶多酚为对照,比较同一质量浓度下抗氧化能力的强弱。
1.3.4.1 清除DPPH自由基的测定方法[14-15]
将洋葱皮总黄酮粗提物稀释成不同的质量浓度梯度,各取2mL不同质量浓度的黄酮溶液于试管中,再加入2mL 0.04mg/mL DPPH自由基溶液,混合均匀,反应20min,3500r/min离心10min,取上清液在波长517nm处测其吸光度(Ai);另各取2mL不同质量浓度的黄酮溶液于试管中,分别加入无水乙醇2mL,反应20min,3500r/min离心10min,取上清液在波长517nm处测其吸光度(Aj);以2mL 0.04mg/mL DPPH自由基溶液和2mL无水乙醇反应做为参比,其吸光度记为A0。计算黄酮对DPPH自由基的清除率(E)(DPPH自由基)。

1.3.4.2 清除·OH的测定方法[16]
将洋葱皮总黄酮提取物用双蒸水配制成不同质量浓度梯度,各取2mL不同质量浓度的黄酮溶液,依次加入2mL 6mmol/L FeSO4、2mL 6mmol/L H2O2,混匀后静置10min,再加入2mL 6mmol/L水杨酸,混匀,静置30min,在波长510nm处测其吸光度(Ai),当用双蒸水代替水杨酸时的吸光度(Aj)。空白对照组以双蒸水代替黄酮溶液吸光度(A0)。计算黄酮对羟自由基的清除率(E)(·OH)。

1.3.4.3 总黄酮还原力的测定[17]
取2.5mL不同质量浓度总黄酮溶液,加入0.2mol/L磷酸缓冲液(pH6.6) 2.5mL及含1%铁氰化钾水溶液2.5mL,50℃水浴20min后急速冷却,加入含10%三氯乙酸水溶液2.5mL,于3000r/min离心10min,取上清液5mL,加蒸馏水4mL及含0.1%三氯化铁水溶液1mL,混匀后10min于波长700nm处测定吸光度。吸光度越大,则说明还原能力越强。
2 结果与分析
2.1 中心组合试验设计结果分析

表2 洋葱皮总黄酮提取中心组合试验设计与结果Table 2 CCD arrangement and corresponding experimental results
中心组合试验结果见表2,采用Design Expert软件对表2试验数据进行回归分析,得到洋葱皮总黄酮提取率对编码因素二次多项回归方程:

由表3可知,P模型<0.0001,试验所选用的二次多项模型极显著,失拟项不显著(P= 0.0547>0.05),其校正调整决定系数R2=0.8885,该模型能解释88.85%响应值的变化,因此该模型拟合程度较好,可以用此模型对酶法提取洋葱皮总黄酮进行分析和预测。
表4方程回归系数显著性检验表明:模型一次项X3(P<0.01)差异高度显著;二次项X12、X22、X32和X42(P<0.0001)差异极显著,一次项X1、X4(P<0.05)差异显著,交互项X2X3、X3X4(P<0.05)差异显著。

表3 回归方程方差分析Table 3 Analysis of variances for total flavonoid yield with various extraction conditions
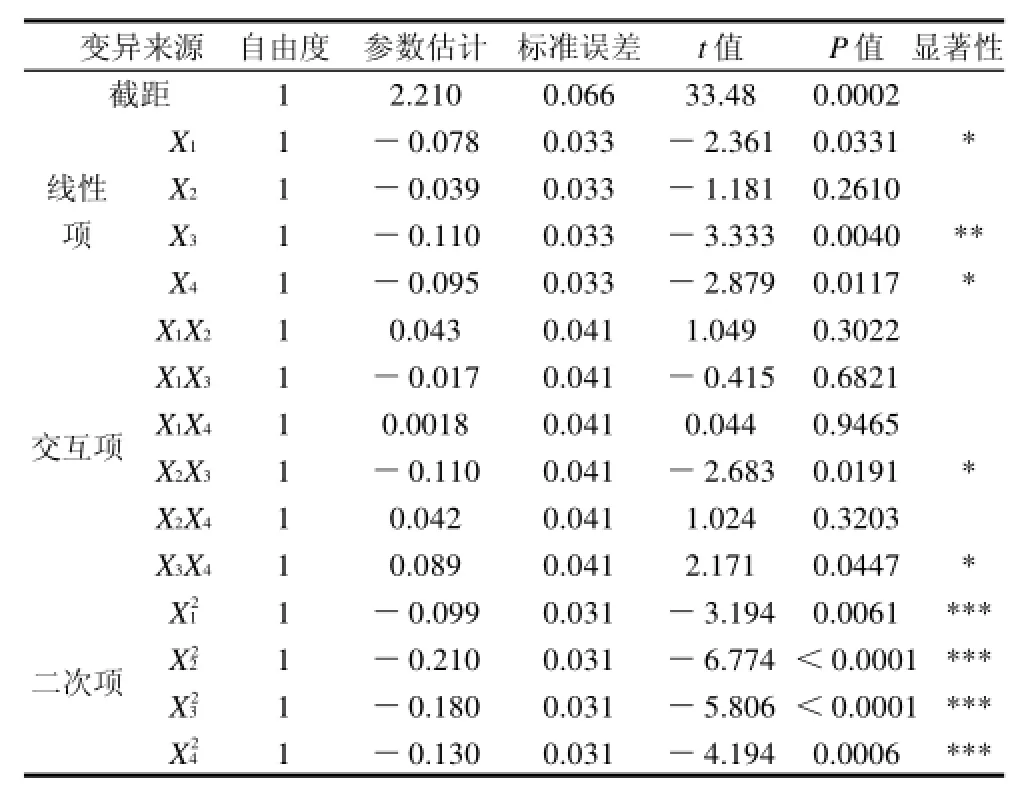
表4 回归方程模型系数显著性分析Table 4 Variance analysis of fitted regression equation predicting total flavonoids yield
2.2 主因素效应分析
在纤维素酶辅助提取情况下,提取温度对洋葱皮总黄酮提取率影响最大,其次是加酶量和提取时间,然后是pH值。
2.3 交互因素效应分析
将方程(5)中的任意两个因素固定在零水平,对余下的两个因素按照所得的二元二次回归方程进行Design Expert软件编程运算,结果表明交互项X2X3、X3X4作用显著,其响应面及等高线如图1~2所示,2组图直观地反映了各因素对响应值的影响。


图1 pH值(X2)与提取温度(X3)对总黄酮提取率的影响Fig.1 Response surface plot showing the effects of pH value and extraction temperature on total flavonoids yield
从图1可得出:总黄酮提取率随着pH值的增大先增后减,在pH5.0左右能获得较高的提取率;总黄酮提取率随着提取温度的增大先增后减,在提取温度50℃左总黄酮的提取率最高。由图1可以确定最佳水平范围即pH4.8~5.0,提取温度为45~50℃。
在pH值的不同水平下,随着提取温度的升高,总黄酮提取率改变的变异度不同;在提取温度的不同水平下,随着pH值的增加,总黄酮提取率改变的变异度亦不同。

图2 提取温度(X3)与提取时间(X4)对总黄酮提取率的影响Fig.2 Response surface plot showing the effects of extraction temperature and time on total flavonoids yield
通过图2可得出:总黄酮提取率随着提取温度的增大先增后减,在提取温度50℃左右总黄酮的提取率最高。总黄酮提取率随着加酶量的增大先增后减,在加酶量为0.5%左右可以得到较高的提取率。
2.4 最佳提取条件的确定
通过响应面回归方程经Design-Expert 7.0软件分析,得出洋葱总黄酮最佳提取工艺为加酶量0.524%、pH4.96、提取温度48.1℃、提取时间105min、料水比1:40,其提取率预测可达到2.26%。实际中验证以加酶量0.52%、pH5.0、提取温度48℃、提取时间105min为提取参数,得到洋葱皮总黄酮提取率为2.32%(n=3),与理论预测值相比相对误差<3%,因此,采用响应面优化得到的提取工艺参数准确可靠。
2.5 洋葱皮总黄酮的抗氧化性分析
2.5.1 洋葱皮总黄酮对DPPH自由基清除效果

图3 洋葱皮总黄酮质量浓度对DPPH自由基清除率影响曲线Fig.3 Concentration dependent DPPH radical scavenging effect of onion peel flavonoids
从图3可以看出:在1~10μg/mL 范围内,洋葱皮总黄酮对清除DPPH自由基有较好的量效关系。在1~10μg/mL范围内,随着洋葱皮总黄酮质量浓度的增加,其清除DPPH自由基的能力逐步增强。经过数据模拟曲线的方程得到:洋葱皮总黄酮清除DPPH自由基的IC50为3.751μg/mL,而茶多酚的IC50为2.976μg/mL,洋葱皮总黄酮的IC50约是茶多酚的1.3倍。因此,虽然洋葱皮总黄酮清除DPPH自由基效果稍差于茶多酚,但是洋葱皮总黄酮仍然表现出很强的清除DPPH自由基的能力。
2.5.2 洋葱皮总黄酮对·OH清除效果

图4 洋葱皮总黄酮质量浓度对·OH清除率影响曲线Fig.4 Concentration dependent hydroxyl radical scavenging effect of onion peel flavonoids
由图4可看出:10~100μg/mL范围内随着洋葱皮总黄酮质量浓度的增加其清除·OH的能力增强。在10~40μg/mL范围内,洋葱皮总黄酮对·OH的清除效果稍高于茶多酚。但随着质量浓度的增大,洋葱皮总黄酮的清除率显著高于茶多酚。经过数据模拟曲线的方程得到:洋葱皮总黄酮清除·OH的IC50为4.267μg/mL,而茶多酚清除·OH的IC50为1.350μg/mL,洋葱皮总黄酮的IC50约是茶多酚的3.2倍。
2.5.3 洋葱皮总黄酮还原力的测定

图5 洋葱皮总黄酮的还原力Fig.5 Concentration dependent reducing power of onion peel flavonoids
由图5可看出,洋葱皮总黄酮和茶多酚随质量浓度的增大其吸光度逐渐增加,洋葱皮总黄酮的增大趋势大于茶多酚,由此可见洋葱皮总黄酮的还原力极强。经SAS分析,洋葱皮总黄酮的还原力与质量浓度呈直线相关,其回归方程为:y= 0.0181x+0.1085,R2=0.9981;茶多酚的还原力也与质量浓度呈直线关系,其回归方程为:y= 0.0148x+0.1388,R2=0.9967。因此,洋葱皮总黄酮还原力强于茶多酚。
3 结 论
3.1 采用中心组合设计试验和响应面分析分别研究纤维素酶用量、pH值、提取温度、提取时间4因素对洋葱皮总黄酮提取率的影响。洋葱皮总黄酮提取率的回归方程为:Y1=2.210-0.078X1-0.039X2-0.110X3-0.095X4+0.043X1X2-0.017X1X3+0.002X1X4-0.110X2X3+0.042X2X4+0.089X3X4-0.099X12-0.210X22-0.180X32-0.130X42。
3.2 洋葱皮总黄酮酶法提取最佳工艺为纤维素酶用量0.52%、pH5.0、提取温度48℃、提取时间105min、料水比(g/mL)1:40,此条件下洋葱皮黄酮的提取率可达到2.32%。3.3洋葱皮总黄酮具有较强的清除DPPH自由基和·OH的能力,其IC50分别为3.751、4.267μg/mL,且洋葱皮总黄酮对DPPH自由基的抑制能力大于·OH;同时洋葱皮黄酮还原能力较强,高于茶多酚。说明洋葱皮黄酮具有良好的抗氧化作用,是一种天然有效的抗氧化剂。
[1]GRIFFITHS G, TRUEMAN L, CROWTHER T, et al. Onions a global benefit to health[J]. Phytotherapy Research, 2002, 16(7): 603-615.
[2]白明生, 陈彦云, 李国旗. 洋葱皮总黄酮的超声波提取工艺研究[J].食品科技, 2008, 33(12): 190-193.
[3]YAO Lihu, JIANG Yueming, SHI J, et a1. Flavonoids in food and their health benefits[J]. Plant Foods for Human Nutrition, 2004, 59(3): 113-122.
[4]蔡为荣, 顾小红, 汤坚. 仙人掌皮黄酮提取工艺优化[J]. 农业工程学报, 2008, 24 (6): 299-303.
[5]WOLFRAM S. Effects of green tea and EGCG on cardiovascular and metabolic health[J]. Am Coil Nutr, 2007, 26(4):373-388.
[6]KOOK S H, SON Y O, JANG Y S, et al. Inhibition of c-Jun Nterminal kinase sensitizes tumor cells to flavonoid. Induced-apoptosis through down-regulation of Jun[J]. Toxicol Appl Pharmacol, 2008, 227(3): 468-476.
[7]黎乃维, 赵玉平, 杨建荣, 等. 水浸提法提取洋葱黄酮类化合物的工艺条件研究[J]. 食品科技, 2007(3): 110-113.
[8]王莹, 王泽南, 王婷. 洋葱皮黄酮类物质提取工艺的研究[J]. 食品研究与开发, 2006, 27(11): 87-89.
[9]侯冬岩, 回瑞华, 刘晓媛, 等. 洋葱皮中黄酮化合物的超声提取与光谱分析[J]. 食品科学, 2006, 27(9): 172-174.
[10]高岐, 刘宏文. 洋葱中总黄酮的微波提取法[J]. 食品工业科技, 2008, 29(1): 218-219.
[11]SOTOFT M, CHRISTENSEN J H, NIELSEN J, et al. Pressured liquid extraction of flavonoids in onions. method development and validation [J]. Talanta, 2009, 80(1): 269-278.
[12]苏东林, 单杨, 李高阳, 等. 酶法辅助提取柑桔皮总黄酮的工艺优化研究[J]. 农业工程学报, 2008, 24(4): 240-245.
[13]何书美, 刘敬兰. 茶叶中总黄酮含量测定方法的研究[J]. 分析化学研究简报, 2007, 35(9): 1365-1368.
[14]AMAROWICZ R, NACZK M, SHAHIDI F. Antioxidant activity of various fractions of non-tanin phenolics of canola hulls[J]. Jagnc Food Chem, 2000, 48(7): 2755-2759.
[15]李艳伏, 徐怀德, 陈金海. 木瓜蛋白酶酶解核桃粕蛋白产物抗氧化活性研究[J]. 中国食品学报, 2008, 8(5): 8-13.
[16]吴琼英, 贾俊强. 柚皮黄酮的超声辅助提取及其抗氧化性研究[J]. 食品科学, 2009, 30(2): 29-33.
[17]莫开菊, 柳圣, 程超. 生姜黄酮的抗氧化活性研究[J]. 食品科学, 2006, 27(9): 110-114.
Enzymatic Extraction and Antioxidant Activity of Onion Peel Flavonoids
CHEN Jia1,XU Huai-de1,*,MI Lin-feng2,BAO Rong1
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. Supervision and Examination Station of Product Quality of Yulin City, Yulin 719000, China)
The central composite design (CCD) method was employed to study the cellulase-assisted extraction process of total flavonoids from onion peel, and their antioxidant activities were also evaluated. The results showed that the optimum extraction conditions were obtained as follows: cellulose added at a ratio of 0.52% to hydrolyze onion peel suspended in a 40-fold volume of water adjusted to pH 5.0 for 105 min. The extraction rate of flavonoids under these extraction conditions was 2.32%. Moreover, antioxidation experiments showed that flavoniods from onion peel had very strong scavenging effects on DPPH free and hydroxyl radicasl, and the corresponding IC50values were 3.751μg/mL and 4.267μg/mL. Meanwhile, onion peel flavonoid showed stronger reducing power when compared to tea polyphenols. These findings suggest that onion peel flavonoids are a group of strong antioxidants and have promising application prospects in healthcare foods and drugs.
onion peel;total flavonoids;cellulase;extraction;antioxidant activity
TS255
A
1002-6630(2011)04-0037-05
2010-03-25
陈佳(1986—),男,硕士研究生,研究方向为天然产物提取分离。E-mail:chenjia198684@126.com
*通信作者:徐怀德(1964—),男,副教授,研究方向为软饮料、果品蔬菜贮藏与加工、天然产物提取。E-mail:xuhuaide@yahoo.com.cn

