大孔树脂对红心萝卜花色苷的纯化
董周永,阿 嘎,赵国建,王笑丹,闫琳娜
大孔树脂对红心萝卜花色苷的纯化
董周永1,阿 嘎1,赵国建2,王笑丹1,闫琳娜1
(1.吉林大学生物与农业工程学院,吉林 长春 130022;2.山西师范大学食品科学与工程系,山西 临汾 041000)
比较6种大孔吸附树脂对红心萝卜花色苷的吸附解吸效果,研究AB-8型大孔树脂对红心萝卜花色苷的吸附与解吸条件。结果表明,AB-8型大孔树脂是纯化红心萝卜花色苷较适合的树脂类型;红心萝卜花色苷在AB-8型树脂上的吸附平衡时间4h,吸附最适温度20℃,花色苷溶液的最适吸附pH3.0,解吸时宜选用75%乙醇溶液。经纯化后的萝卜花色苷为紫黑色粉末,色价为47.8,是纯化前的12倍。
红心萝卜;花色苷;纯化;大孔树脂
红心萝卜(Raphanus sativus L.)系十字花科作物,其肉质根中含有丰富的花色苷和类黄酮物质,具有很高的营养保健价值。大量研究表明,果蔬中的花色苷具有较强的清除自由基[1-3]、抗氧化[4-6]、抗癌[7-9]、预防心血管疾病[10]、减肥[11]等多种生理功能。因此,从果蔬中提取天然的花色苷类色素物质已经成为目前的研究热点之一。由于大孔树脂分离纯化与传统纯化工艺相比,具有工艺简单、效率高、生产成本低、再生方便等诸多优点,已经成为当前分离纯化天然产物的主流方法[12]。目前有关花色苷类物质的分离纯化已有较多的研究报道,但萝卜花色苷纯化的研究却鲜见报道。为此本实验比较色素纯化常用的6种大孔树脂对红心萝卜花色苷的吸附分离效果,从中筛选出较为合适的红心萝卜花色苷分离纯化树脂类型,并对其吸附解吸性能进行研究,以期为红心萝卜花色苷类天然抗氧化物质的工业化生产提供技术依据。
1 材料与方法
1.1 材料、试剂与仪器

表1 6种大孔树脂的物理参数Table 1 Physical parameters of 6 kinds of macroporous resins
红心萝卜(青皮红心萝卜) 长春市磐石路综合市场。
大孔树脂:HPD-700、HPD-722、HPD-100、HPD-80大孔树脂 沧州宝恩化工有限公司;AB-8、D-101大孔树脂 天津市海光化工有限公司。具体型号及物理参数见表1。
NaOH、HCl、乙醇等均为国产分析纯。
TDL-4A型离心机 上海菲恰尔分析仪器有限公司;JA3003A型电子天平 上海精天电子仪器有限公司;RE-52型旋转蒸发仪 上海亚荣生化仪器厂;TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司。
1.2 方法
1.2.1 红心萝卜花色苷提取液的制备
1.2.1.1 供试液的制备
新鲜红心萝卜洗净,去皮,萝卜果肉破碎。加入3倍体积60%乙醇溶液,用2mol/L盐酸调其pH值至3.5,在60℃浸提3h后过滤,收集滤液,于50℃下减压浓缩,冷藏备用。
1.2.1.2 红心萝卜花色苷提取液吸收光谱的测定
红心萝卜花色苷溶液进行适当稀释,用2mol/L盐酸调其pH值至3.5,用紫外-可见分光光度计对其在200~800nm波长范围内进行扫描,确定萝卜花色苷的最大吸收峰。
1.2.2 树脂类型的筛选
1.2.2.1 树脂预处理
6种大孔树脂用蒸馏水洗净,分别在烧杯内加入高于树脂层10cm无水乙醇浸泡24h,充分溶胀,用无水乙醇淋洗直至洗出液加适量水无白色浑浊现象为止,再用蒸馏水洗至无醇,滤出树脂。
1.2.2.2 树脂吸附率和解析率的测定
准确称取6种预处理过的树脂各1g,置于250mL具塞磨口三角瓶中。准确量取pH3.5花色苷溶液100mL,于508nm波长处测其吸光度(A1)。然后将其分别加入到三角瓶中,置恒温振荡器上于30℃振荡24h,充分吸附后,过滤,测滤液的吸光度(A2)。将滤出的树脂加入到100mL、70%乙醇溶液中,置振荡器上于60℃振荡24h,充分解吸后过滤,测滤液的吸光度(Ak),将Ak转化成同质量浓度时水溶液对应的吸光度(A3),计算各树脂的吸附率(α)和解吸率(β)。

1.2.3 大孔树脂对萝卜花色苷的吸附性能
1.2.3.1 温度对大孔树脂吸附效果的影响
准确称取0.5g经过预处理的大孔树脂,置于带塞锥形瓶中,各加入50mL、pH3.0花色苷溶液(A508nm=0.910),于不同温度下100r/min振荡吸附,测定上清液508nm处的吸光度,作吸光度随时间的变化曲线,确定温度对树脂吸附性能的影响。
1.2.3.2 红心萝卜花色苷在AB-8上的吸附平衡时间
准确称量0.5g经过预处理的大孔树脂,置于带塞锥形瓶中,各加入50mL、pH3.0花色苷溶液(A508nm=0.910),于20℃恒温振荡吸附,每隔1h取上清液测定吸光度A508nm,连续测定6h,作吸光度随时间的变化曲线,确定红心萝卜花色苷在AB-8上吸附平衡时间。
1.2.3.3 pH值对大孔树脂吸附效果的影响
用2mol/L盐酸将萝卜花色苷溶液调配至不同pH值,加入一定量经活化的树脂于室温下静置吸附4h后,测上清液吸光度,并计算树脂的吸附率,确定吸附最佳pH值。
1.2.4 洗脱剂体积分数的确定
称取1g已饱和吸附花色苷的树脂置于三角瓶中,分别加入pH3.0不同体积分数的乙醇溶液50mL,恒温振荡器100r/min振荡1h后,于508nm波长处测定各溶液的吸光度,以吸光度表示花色苷的解吸量。
1.2.5 AB-8对红心萝卜花色苷的纯化
将处理好的AB-8大孔树脂湿法装柱(1.5cm× 30cm),将已制备的花色苷的粗提液用蒸馏水稀释3倍,以10mL/min的流速通过层析柱至吸附达饱和,再以蒸馏水洗脱树脂至流出液无混浊现象,然后以75%乙醇溶液洗脱,收集洗脱液,于50℃下减压浓缩得深紫红色浆状物质,干燥得到粉末状固体。
1.2.6 红心萝卜花色苷的色价测定[13]
精确称取0.10g花色苷提取物,用pH3.0柠檬酸缓冲液定容至100mL,稀释一定倍数,在508nm处测定其吸光度,并计算色价
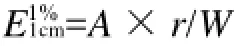
式中:A为样品溶液的吸光度;r为测定吸光度时所吸样品的稀释倍数;W为样品的质量/g。
2 结果与分析
2.1 红心萝卜花色苷提取液光谱扫描曲线
在200~800nm波长范围内对红心萝卜花色苷提取液进行扫描,光谱扫描曲线如图1所示。

图1 红心萝卜花色苷吸收光谱图Fig.1 Absorption spectrum of anthocyanins from red-core radish
从图1可以看出,在紫外吸收光区有多个吸收峰,这可能是由于提取液中含有其他杂质所致;在可见光区508nm波长处有一个非常明显的吸收峰出现,这与资料基本相符[14],所以本实验采用508nm作为检测波长。
2.2 最佳吸附树脂的确定
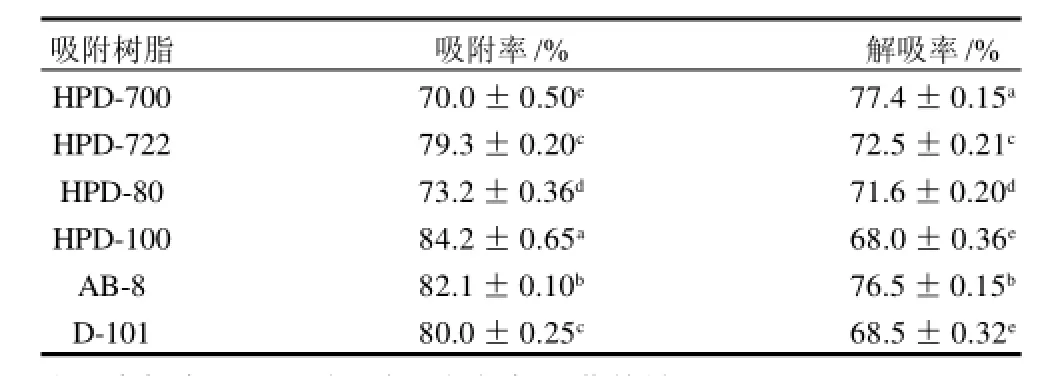
表2 大孔树脂对红心萝卜花色苷的吸附及解吸性能Table 2 Adsorption and desorption properties of macroporous resin towards anthocyanins from red-core radish
本研究选用色素纯化常用的6种大孔树脂对萝卜花色苷进行纯化,数据处理和统计采用DPS v6.55软件包进行处理,结果以(x±s)表示(表2)。数据经单因素方差分析,各型号树脂间的两两比较采用LSD法。结果表明,6种树脂的吸附率除HPD-722和D-101之间不显著外,其余各树脂间均达到极显著差异(P<0.01)。而解吸率除HPD-100与D-101差异不显著外,其他各组间差异也均达到极显著差异(P<0.01)。由表2可知,不同型号的树脂对花色苷的吸附程度不同,吸附率最大的是HPD-100,其次为AB-8,HPD-700的吸附率最低。解吸附率最大为HPD-700,其次为AB-8。这可能是由于花色苷类物质属弱极性化合物,但又有一定的极性和亲水性,因而有利于弱极性或非极性树脂的吸附。此外,其吸附能力大小还与比表面积等关系密切。同时,解吸率也是衡量大孔树脂分离天然产物的重要技术参数之一。综合吸附率和解吸率两个参数,认为AB-8型大孔吸附树脂对萝卜花色苷具有较好的吸附效果,故确定AB-8为本实验的最佳树脂。
2.3 温度对AB-8树脂吸附效果的影响
花色苷类物质在低温下的稳定性较好,故本实验只研究了20~60℃之间温度对AB-8树脂吸附效果的影响。

图2 温度对AB-8树脂吸附效果的影响Fig.2 Effect of temperature on adsorption efficiency of resin AB-8
由图2可知,温度越高,红心萝卜花色苷的吸光度下降越快。这可能由于红心萝卜花色苷在AB-8大孔吸附树脂上的吸附是靠分子间作用力,属于物理吸附。温度升高,有效成分在树脂上的吸附作用降低,在溶液中的溶解度增大,致使花色苷在大孔吸附树脂上的吸附速度和吸附量降低,因此,在吸附阶段,以20℃作为吸附温度较合适。
2.4 红心萝卜花色苷在AB-8上吸附平衡时间

图3 AB-8大孔树脂对红心萝卜花色苷随时间的吸附趋势线Fig.3 Adsorption curve of resin AB-8 towards anthocyanins from red-core radish
图3 为AB-8树脂对花色苷吸附过程中花色苷溶液的吸光度随时间的变化规律。从图3可以看出,在吸附起始阶段花色苷溶液的吸光度下降迅速,2h后下降速度趋于缓慢,4h后吸光度基本不变。这说明在起始阶段AB-8树脂对花色苷的吸附率增加较快,但随着时间的延长大孔树脂在单位时间内的吸附量逐渐减小,吸附逐渐趋于饱和,在4h时吸附基本达到平衡,吸附率不再增加。
2.5 pH值对AB-8树脂吸附效果的影响

图4 不同pH值条件下AB-8大孔树脂对花色苷的吸附效果Fig.4 Adsorption capacity of resin AB-8 towards anthocyanin from red-core radish under various pH conditions
溶液pH值对花色苷的结构与颜色影响很大,由于花色苷类物质在酸性条件下比较稳定,故本实验只测定pH2.0~6.0时AB-8树脂的吸附能力。由图4可知,当pH3.0时吸附率最高,之后随pH值的增加吸附率逐渐下降。这可能是由于花色苷在酸性条件下主要以稳定的黄烊盐形式存在,而随着pH值的逐渐增加花色苷存在的4种结构形式的比例不同[15-16]而造成极性的差异,从而影响了吸附量。所以调pH3.0进行吸附,效果较佳。2.6乙醇体积分数对AB-8树脂解吸率的影响
洗脱剂具有使大孔树脂溶胀、减弱被吸附物质与树脂之间吸附力的作用,并可溶解被吸附物质。乙醇体积分数对树脂吸附花色苷的洗脱效果影响较大,本研究进行不同体积分数乙醇的洗脱效果实验。当树脂吸附红心萝卜花色苷溶液至上清液吸光度不变时,认为树脂已吸附饱和。用蒸馏水分别清洗吸附饱和的树脂后,用不同体积分数的乙醇进行静态洗脱,结果如图5所示。在测定前将各洗脱液调整至相同乙醇体积分数和pH值,以减少因花色苷在不同乙醇体积分数和酸碱度条件下的吸收误差。

图5 乙醇体积分数对解吸效果的影响Fig.5 Effect of ethanol concentration on desorption efficiency
由图5可知,随着乙醇体积分数上升,溶液的吸光度也随着增加,当乙醇体积分数75%时,吸光度达到最高,但当乙醇体积分数超过75%时,溶液的吸光度又逐渐变小。乙醇体积分数过高或过低,解吸效果都会下降。溶液的吸光度越高,说明解吸效果越好。因此选用75%乙醇作为洗脱剂。
2.7 纯化前后红心萝卜花色苷的色价比较

表3 纯化前后花色苷色价的比较Table 3 Comparison on color value of anthocyanins before and after purification
按1.2.1.1节方法,红心萝卜花色苷提取液经减压浓缩、干燥后得到的花色苷粗提物为紫黑色膏状物,由于含有较多的单糖及其他脂溶性杂质,纯度较低且容易吸潮。而经AB-8大孔树脂纯化后的萝卜花色苷为紫黑色粉末,按1.2.6节方法测定其色价,其值为47.8,是纯化前的12倍,说明采用AB-8大孔树脂能有效纯化红心萝卜花色苷。
3 结 论
AB-8型大孔树脂是分离纯化萝卜花色苷较为适宜的树脂类型。其对萝卜花色苷吸附平衡时间为4h,吸附最适温度20℃,最适吸附pH3.0,解吸时宜选用75%乙醇溶液。经纯化后的萝卜花色苷为紫黑色粉末,其色价为47.8,是纯化前的12倍。
[1]杨磊, 贾佳, 祖元刚. 蓝莓总花色苷匀浆的提取条件优化及抗氧化活性[J]. 食品科学, 2009, 30(20): 27-33.
[2]LACHMAN J, HAMOUZ K, SULC M, et al. Cultivar differences of total anthocyanins and anthocyanidins in red and purplefleshed potatoes and their relation to antioxidant activity[J]. Food Chemistry, 2009, 114 (3): 836-843.
[3]李洋, 钦传光, 牛卫宁, 等. 几种天然植物花色苷体外清除自由基活性比较研究[J]. 食品科学, 2009, 30(7): 91-94.
[4]WANG Haibo, NAIR M G, STRASBURG G M, et al. Antioxidant and antiinflammatory activities of anthocyanins and their aglycon, cyanidin, from tart cherries[J]. J Nat Prod, 1999, 62(2): 294-296.
[5]徐金瑞, 张名位, 刘兴华, 等. 黑大豆种皮花色苷体外抗氧化活性研究[J]. 营养学报, 2007, 29(1): 54-57.
[6]EINBOND L S, REYNERTSON K A, LUO Xiaodong, et al. Anthocyanins antioxidant from edible fruits[J]. Food Chemistry, 2004, 84(1): 23-28.
[7]LALA G, MALIK M, ZHAO Cuiwei, et al. Anthocyanin-rich extracts inhibit multiple biomarkers of colon cancer in rats[J]. Nutr Cancer, 2006, 54(1): 84-93.
[8]CHEN Peini, KUO W H, CHIANG C L, et al. Black rice anthoeyanins inhibit cancer cells invasion via repressions of MMPs and u-PA expression [J]. Chemico Biological Interactions, 2006, 16(3): 218-229.
[9]MICHAEL N, GABRIELE N, KAMMERER D R, et al. Cancer cell antiproliferation activity and metabolism of black carrot anthocyanins[J]. Innovative Food Science and Emerging Technologies, 2007, 8(3): 365-372.
[10]徐金瑞. 黑大豆种皮花色普抗动脉粥样硬化及其抗氧化机理研究[D].杨凌: 西北农林科技大学, 2006.
[11]胡艳, 郭红辉, 王庆, 等. 黑米花色苷提取物对高脂膳食诱导大鼠肥胖形成的影响[J]. 食品科学, 2008, 29(2): 376-379.
[12]罗艳玲, 欧仕益. 大孔树脂在食品活性成分分离中的应用[J]. 食品与机械, 2005, 21(5): 81-83.
[13]中国标准出版社第一编辑室. 中国食品工业标准汇编: 食品添加剂卷[M]. 北京: 中国标准出版社, 1997.
[14]王晓梅, 徐为民, 曹士锋, 等. 红心萝卜花色苷稳定性的研究[J]. 食品科学, 2008, 29(7): 98-100.
[15]石碧, 狄莹著. 植物多酚[M]. 北京: 科学出版社, 2000.
[16]GALINDO A O, EBELING P W, WROLSTAD R E, et al. Purification and identification of capulin (Prunus serotina Ehrh) anthocyanins[J]. Food Chemistry, 1999, 65(2):201-206.
Purification of Anthocyanins from Red-core Radish by Macroporous Resin
DONG Zhou-yong1,A Ga1,ZHAO Guo-jian2,WANG Xiao-dan1,YAN Lin-na1
(1. College of Biological and Agricultural Engineering, Jilin University, Changchun 130022, China;2. Department of Food Science and Engineering, Shanxi Normal University, Linfen 041000, China)
The adsorption and desorption effects of 6 kinds of macroporous resins on anthocyanins from red-core radish were compared. The adsorption and desorption properties of resin AB-8 on anthocyanins from red-core radish were further investigated. Results indicated that the adsorption equilibrium time of anthocyanins on resin AB-8 was 4 h. The highest adsorption capacity of resin AB-8 towards anthocyanins from red-core radish was achieved under the conditions of pH 3 and 20 ℃. In addition, 75% ethanol could provide the best desorption effect on anthocyanins from resin AB-8. The purified anthocyanins obtained under the optimal conditions were purple dark powder with color value of 47.8, which exhibited 12-fold enhancement compared with the color value of anthocyanins before purification.
red-core radish;anthocyanins;purification;macroporous resin
TS209
A
1002-6630(2011)04-0021-04
2010-04-19
吉林大学青年教师科研启动基金项目(450080011100)
董周永(1982—),男,讲师,博士,主要从事农产品深加工及其功能性成分研究。
E-mail:dongzhouyong3421@163.com

