鲍曼不动杆菌OXA基因的检测及ISAba1对其表达的影响
孙艳霞,聂大平
(1. 盘锦市第一人民医院 检验科,辽宁 盘锦 124010; 2. 大连医科大学 附属第二医院 检验科,辽宁 大连 116027)
鲍曼不动杆菌(Acinetobater baumannii, AB)是一种临床常见的条件致病菌,在院内感染中占有很大比重,广泛存在于自然界及人体的呼吸道、口腔、黏膜、皮肤等部位,引起菌血症、肺炎、伤口感染、泌尿系等的重度感染[1]。随着抗菌药物的广泛使用,多药耐药的鲍曼不动杆菌在世界范围内暴发流行的趋势日益严重,尤其在重症监护病房[2]及烧伤病房[3-4],给临床治疗带来极大困难。鲍曼不动杆菌耐药机制是多方面的,如β-内酰胺酶的产生,药物流出泵的形成,外膜蛋白的改变,整合子的作用等,其中对亚胺培南的耐药主要是由于产生了碳青霉烯酶。OXA-23,OXA-24,OXA-51,OXA-58基因在临床分离的鲍曼不动杆菌中较常见,而其表达依赖于OXA基因上游的插入序列1(ISAba1)提供强启动子[5]。本实验通过对临床110株鲍曼不动杆菌OXA基因的研究及探讨ISAba1对OXA-23表达的影响,了解其耐药机制,期待其能在临床治疗及控制耐药株的产生和扩散等方面提供有力依据。
1 材料和方法
1.1 临床菌株
110株鲍曼不动杆菌(其中对亚胺培南敏感株为13株,耐药株为97株)于2008年7月-2010年3月分离自大连医科大学附属第二医院及大连市第三人民医院住院患者,无重复株。常规鉴定菌种,纸片扩散法进行药敏试验。
1.2 标准菌株及抗菌药物
质控菌株为大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853;转化的感受态细胞为大肠埃希菌TOP10(购自天根生化公司) 。
抗菌药物:药敏纸片购自OXOID公司,亚胺培南/西司他丁(IMP)购自美国默克公司。
1.3 主要分子生物学试剂
2×Taq PCR Master Mix,普通DNA产物纯化试剂盒,pGM-T克隆试剂盒均购自天根生化公司;250 bp DNA Ladder Marker,溴乙锭(EB),MH琼脂,琼脂糖均购自大连宝生物工程有限公司;PCR引物[1]合成,测序均由大连宝生物工程有限公司完成。本实验中所用引物见表1。
1.4 耐药基因检测方法
1.4.1 模板DNA的制备: 模板煮沸法制备PCR扩增模板:将在M-H平板上培养过夜的细菌菌落混悬于2 mL的8.5 g/L的NaCl中,使成5个麦氏单位,13000 r/min离心2 min,沉淀重悬于200 μL无菌重蒸馏水,并置K10CD干式恒温器煮10 min。13000 r/min离心10 min,取上清液保存于-20 ℃备用[1]。
1.4.2 PCR扩增 (采用25 μL体系): 多重PCR检测OXA基因(blaOXA-23-like、blaOXA-24-like、blaOXA-51-like、 blaOXA-58-like):94 ℃预变性4 min;94 ℃变性40 s,54 ℃退火40 s,72 ℃延伸50 s,35个循环;72 ℃延伸6 min。
同源性分析(肠杆菌科基因组内重复序列聚合酶链反应ERIC-PCR):94 ℃预变性4 min;94 ℃变性60 s,58 ℃退火60 s,72 ℃延伸90 s,35个循环;72 ℃延伸6 min。
ISAba1-OXA-23、ISAba1-OXA-51、OXA-23、OXA-51基因完整序列的扩增:取非同源性鲍曼不动杆菌以ISAba1上游引物和OXA-23、OXA-51下游引物分别扩增ISAba1-OXA-23 、ISAba1-OXA-51,同时取OXA-23、OXA-51上下游引物扩增OXA-23,OXA-51。94℃预变性4 min;94 ℃变性50 s,52 ℃退火60 s,72 ℃延伸90 s,35个循环;72 ℃延伸7 min。
1.4.3 琼脂糖凝胶电泳: PCR产物采用1.2%琼脂糖凝胶电泳,100 V,30 min,Marker为250 bp DNA Ladder Marker,凝胶置300 nm紫外灯下观察结果,并进行凝胶成像系统扫描成像。
1.4.4 PCR产物纯化: 用天根生化公司普通DNA产物纯化试剂盒,按说明书进行PCR产物纯化。
1.4.5 基因序列: OXA-23,OXA-51,OXA-58,ISAba1-OXA-23完整序列测定由大连宝生物工程有限公司完成,并与GENBANK注册的相应基因序列进行比对。

表1 PCR扩增引物
1.5 转化实验
1.5.1 PCR产物连接: PCR产物OXA-23及ISAba1-OXA-23使用pGM-T连接试剂盒按照产品说明书连接。
1.5.2 连接产物转化: 连接后质粒使用pGM-T转化试剂盒按照产品说明书转化。
1.6 亚胺培南/西司他丁对实验菌株的MIC测定
亚胺培南(西司他丁)对实验菌株及转化子采用琼脂对比稀释法测定其MIC,对照CLSI规定的MIC标准判定耐药、中介、敏感。
2 结 果
2.1 多重PCR检测OXA-碳青霉烯酶编码基因
多重PCR检测到OXA-23,OXA-51,OXA-58基因,未检测到OXA-24基因。110株鲍曼不动杆菌OXA基因检出与对亚胺培南耐药的关系见表2 。
多重PCR电泳结果见图1。OXA-碳青霉烯酶基因在鲍曼不动杆菌中广泛存在,以OXA-23、OXA-51为主,OXA-58较为少见,尚未发现OXA-24;临床上同时携带OXA-23和OXA-51两种基因的鲍曼不动杆菌较多见。
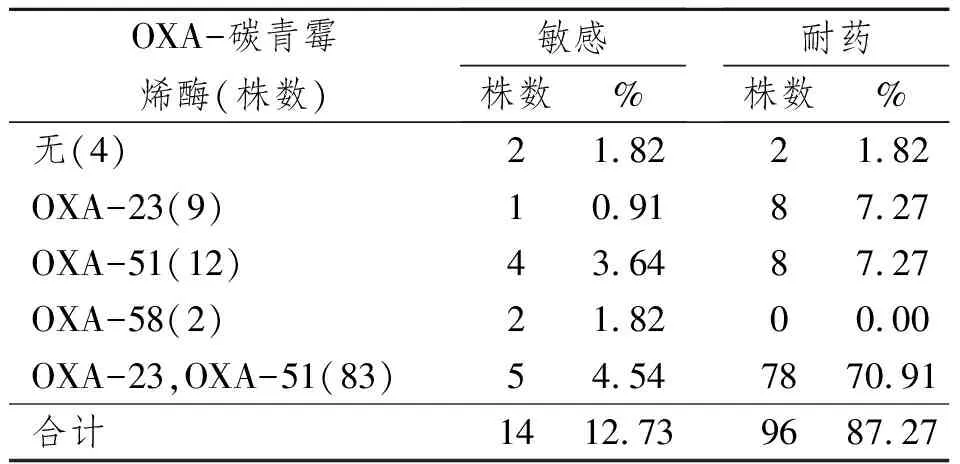
表2 110株鲍曼不动杆菌OXA基因检出与对IMP耐药的关系
2.2 同源性分析
110株菌株中有18个克隆株。其中,第2孔道菌株为流行株,110株临床分离的菌株中有51株为该菌株,占实验总菌数的46.36%,并且分离自多个病区的多种标本,其它菌株散在分布,结果见图2。
2.3 转化实验结果
2.3.1 PCR扩增OXA基因完整序列: 选取非同源的临床实验菌株进行OXA基因完整序列扩增,得到OXA-23、OXA-51、ISA-OXA-23基因序列,长度分别为1067 bp、825 bp、2036 bp,未扩增出ISA-OXA-51基因序列,选取的12株OXA-23阳性中对应扩增出ISA-OXA-23阳性菌株9株,见图3。

图1 多重PCR扩增OXA基因
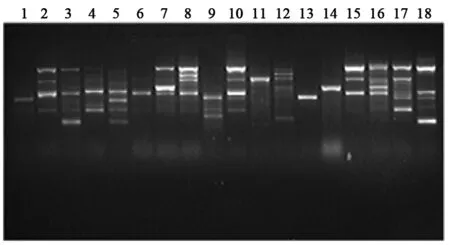
图2 同源性分析
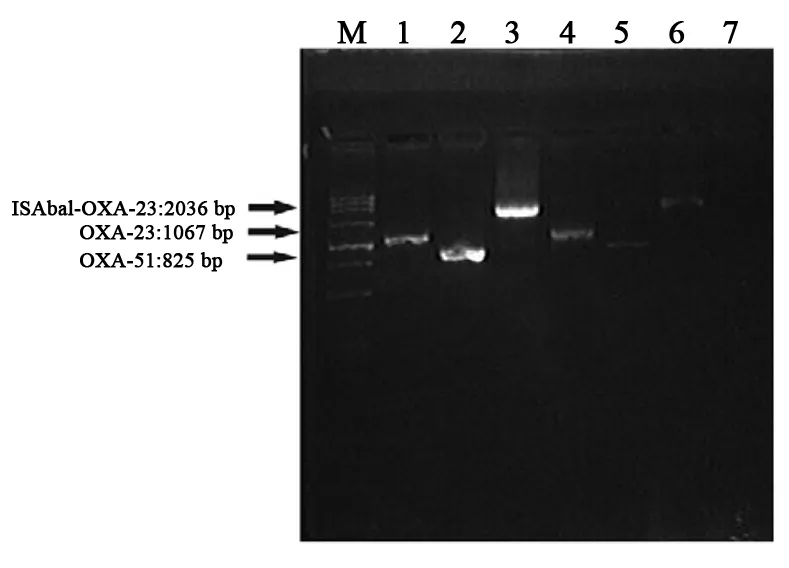
图3 转化子和对应临床分离菌株PCR扩增片段
2.3.2 耐药基因序列测定: 随机选取ISAba1-OXA-23,OXA-23,OXA-51实验菌株PCR产物由大连宝生物工程有限公司测序,结果经GenBank网上同源性比较,分别与注册号为GQ861439.1,EF534259.1,GQ914991.1的鲍曼不动杆菌一致,一致性分别为100%,100%和100%。
2.3.3 转化实验:分别将转化子OXA-23,ISAba1-OXA-23进行相应PCR扩增,其产物与对应的临床菌株PCR产物进行琼脂糖凝胶电泳分析,得到的片段长度与对应的临床实验菌株片段大小一致,见图3。
2.4 亚胺培南对临床菌株及转化子的MIC结果
临床实验菌株OXA-23、ISA-OXA-23 和OXA-51 MIC值分别为256、128、128;TOP10(pGM ISAba1-OXA-23)MIC值为0.5,另一转化子TOP10(pGMOXA-23)MIC值为0.125,TOP10(pGMOXA-51)MIC值为0.25。
3 讨 论
多药耐药的鲍曼不动杆菌已经作为一个广泛流行的临床问题出现[9],这种趋势与包括鲍曼不动杆菌在内的院内感染的不动杆菌属的流行具有一致性。来自美国全国医院感染监控系统的数据显示,该国的重症监护病房(ICU)内与不动杆菌属相关联的肺炎感染率从1983年的3%上升至2003年的7%[10]。耐碳青霉稀类的鲍曼不动杆菌于1991年首先在美国被发现,随后报道了多起由耐亚胺培南的AB引起的医院暴发流行。近年来,该菌在呼吸道的分离率在30%以上[11]。碳青霉烯酶OXA-23的产生是鲍曼不动杆菌多重耐药的最常见机制[12]。在欧洲,其耐药程度明显与插入序列ISAba1提供的强启动程序导致碳青霉烯酶的过表达有关[13];在欧美地区,观察到不同的带有ISAba1和OXA-23结构的转座子的结构支持这一假说,鲍曼不动杆菌对碳青霉烯类药物高水平耐药基因可能是其通过转座子基因介导的基因转移从与其共生的生物体获得。
本研究在110株菌中检测到单纯OXA-23阳性率为8.18%(9/110);单纯OXA-51阳性率为10.91%(12/110);OXA-58阳性率为1.82%(2/110);OXA-23和OXA-51同时阳性率为75.45%(83/110);未检测到OXA-24。上述菌株对亚胺培南的耐药率高达87.27%,说明鲍曼不动杆菌对碳青霉烯类药物具有极高的耐药率。鲍曼不动杆菌对碳青霉烯类抗生素的耐药机制主要包括:产生B类、D类β-内酰胺酶,外膜蛋白(OMP)的丢失,青霉素结合蛋白(PBP)的改变及外排机制[14]。为了探讨ISAba1对OXA类酶表达的影响,本实验分别将不带有ISAba1和带有ISAba1序列的OXA-23片段转化到大肠埃希氏菌TOP10中,以避免B类、D类β-内酰胺酶,外膜蛋白(OMP)的丢失,青霉素结合蛋白(PBP)的改变及外排机制等因素对于鲍曼不动杆菌对碳青霉烯类药物耐药的影响,通过比较两株转化子对亚胺培南的最低抑菌浓度的不同来观察ISAba1对OXA酶表达的影响。结果显示,两者的MIC分别为0.125和0.5,并无明显差别。而Lin YC等[15]将ISAba1-bla(OXA-23) 和 ISAba1-bla(OXA-66)分别转化到A. baumannii ATCC 15151 (CIP 70.10)中,可导致OXA-23,OXA-66的高表达。表明在鲍曼不动杆菌中 ISAba1为blaOXA-23的表达提供强启动子。但在大肠埃希菌中,ISAba1的存在并未对OXA酶的表达产生影响,这可能是该菌的内部环境不能满足ISAba1启动OXA-23基因的条件所致。
OXA-51是鲍曼不动杆菌的重要标志[16]。本文OXA-51阳性为95株,表明86.3%的菌株可确定为鲍曼不动杆菌,单纯OXA-51耐药、OXA-23耐药OXA-58耐药的情况均有报道[17],本实验中,不含OXA基因、单纯OXA-23、OXA-51基因耐药的临床菌株分别为1.82%、7.27%、7.27%,未检测到单纯OXA-58的耐药菌株。并且在检测的12株OXA-23阳性的耐药菌株中,有9株检测到ISAba1基因序列,这些都表明ISAba1对OXA-23表达可能起重要作用,同时也存在其他机制。
大连地区鲍曼不动杆菌对碳青霉烯耐药主要原因是产生OXA-23基因。ISAba1位于OXA-23基因的上游,大肠杆菌中单纯OXA-23基因和有ISAba1-OXA-23片段未对OXA酶的表达产生大的影响。
参考文献:
[1] Woodford N,Ellington MJ,Coelho JM, et al. Multiplex PCR for genes encoding prevalent OXA carbapenemases in Acinetobacter spp [J].Int J Antimicrob Agents,2006,27(4):351-353.
[2] Denton M, Wilcox MH, Parnell P, et al. Role of environmental cleaning in controlling outbreak of Acinetobacter baumannii on a neurosurgical intense care unit [J]. J Hosp Infect,2004, 56(2):106-110.
[3] Bergogene-Berezin E, Towner KJ. Acinetobacter spp. as nosocomial pathogens: microbiological, clinical, and epidemiological features[J]. Clin Microbiol Rev,1996, 9(2):148-165.
[4] Roberts SA, Findlay R,Lang SD. Investigation of an outbreak of multi-drug resistant Acinetobacter baumannii in an intensive care burns unit.[J]. J Hosp Infect,2001,48(3):228-232.
[5] Adams-Haduch JM,Paterson DL,Sidjabat HE.Genetic Basis of Multidrug Resistance in Acinetobacter baumannii Clinical Isolates at a Tertiary Medical Center in Pennsylvania[J].Antimicrob Agents Chemother,2008,52(11):3837-3843.
[6] 张永,陈全清,钟政荣,等. 鲍氏不动杆菌blaOXA-23 基因定位及临床意义[J].中华医院感染学杂志,2007,12(12):1465-1468.
[7] 朱建铭,吴晋兰,姜如金,等. 碳青霉稀酶在多重耐药鲍曼不动杆菌中流行[J].中国人兽共患病学报, 2008,24(11):1080-1082.
[8] 张哲,蒋晓飞,吕元.鲍曼不动杆菌基因同源性研究[J].现代实用医学, 2005,17(11): 674-676.
[9] Munoz-Price LS, Weinstein RA. Acinetobacter infection[J].N Engl J Med, 2008, 358(12):1271-1281.
[10] Gaynes R, Edwards JR. Overview of nosocomial infections caused by gram-negative bacilli[J]. Clin Infect Dis,2005,41(6):848-854.
[11] Hanlon GW.The emergence lf multidrug resistant Acinetobacter species; a major concern in the hospital setting[J].Lett Appl Microbiol,2005,41(5):375-378.
[12] Perez F, Hujer AM, Hujer KM, et al. Global challenge of multidrug-resistant Acinetobacter baumannii. Antimicrob[J].Antimicrob Agents Chemother, 2007,51(10):3471-3484.
[13] Corvec S, Poirel L, Naas T, et al. Genetics and expression of the carbapenem-hydrolyzing oxacillinase gene bla OXA-23 in Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2007, 51(4):1530-1533.
[14] 李国钦.耐碳青霉烯鲍曼不动杆菌研究进展[J].中国感染控制杂志,2008,7(2):140-143, 139.
[15] Lin YC,Hsia KC,Chen YC,et al. Genetic basis of multidrug resistance in Acinetobacter clinical isolates in Taiwan[J]. Antimicrob Agents Chemother, 2010,54(5):2078-2084.
[16] 郭萍,王辉,陈端,等.OXA51 样D类碳青霉稀酶在鲍曼不动杆菌广泛分布[J].中华检验医学杂志,2007,11(5):505-509.
[17] Kulah C,Mooij MJ,Comert F,et al.Characterisation of carbapenem-resistant Acinetobacter baumannii outbreak strains producing OXA-58 in Turkey[J].Int J Antimicrob Agents, 2010,36(2):114-118.

