二色补血草硫氧还蛋白过氧化物酶基因LbTPx的克隆及其表达1)
刁桂萍 杨传平 王玉成
(东北林业大学,哈尔滨,150040)
二色补血草(Limonium bicolor)属蓝雪科补血草属,2年生草本植物,是我国北方的一种重要牧草资源。它能在pH值8.5~9.0的碱性土壤中正常生长,是一种泌盐植物,具有较强的抗盐能力,不必改良土壤即可直接种植,是进行植物耐盐碱基因克隆的理想材料之一[1]。
有氧环境下,各种生物的代谢产物中普遍含有活性氧(ROS)。ROS能与蛋白质、脂类和DNA反应,分别引起酶活降低、膜透性增强及突变增加[2]。ROS一旦超出了植物的清除能力,会造成植物体氧化损伤[3]。近来认为硫氧还蛋白过氧化物酶(TPx)可能是ROS代谢中未被发现的重要环节。TPx属于过氧化物酶超家族(Prx)中的一员,广泛存在于原核和真核生物体中。它以硫氧还蛋白作为电子供体去除机体内的活性氧类物质(ROS),不仅具有强大的抗氧化功能,而且在维持机体氧化还原平衡、细胞凋亡、增殖等方面都具有调节作用[4-6]。本文克隆了二色补血草的 LbTPx基因,对该基因的序列进行了分析,并用实时定量RT-PCR分析了该基因在NaCl、CdCl2、CuSO4、ZnCl2和 ABA 等 5 种胁迫下不同时间的表达情况。
1 材料与方法
1.1 二色补血草LbTPx基因的克隆及序列测定
已构建了0.4 mol/L NaHCO3胁迫下的二色补血草叶片及嫩茎的cDNA文库,通过对文库克隆的随机测序和EST分析获得LbTPx基因的全长cDNA序列。采用NCBI的开放读码框寻找程序,确定该基因的开放读码框;用NCBI的Conserved Domains工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白的保守区;通过 ExPASY网站(http://www.expasy.org/tools/pi_tool.html)计算蛋白的相对分子质量和理论等电点;用BlastP程序进行同源性搜索,并对具有同源性、不同植物来源的TPx蛋白用ClustalX(1.83)进行多序列比对。
1.2 二色补血草LbTPx基因在非生物胁迫逆境下的表达分析
1.2.1 材料处理
将二色补血草种在温室花盆中,生长基质为沙和草炭土,二者体积比为2∶1。温室的温度为24℃,平均光强为400 μmol·m-2·s-1,相对湿度在 65%~ 75% 之间,每天浇水,保证土壤水分充足。种子萌发生长2个月后,取2月龄的二色补血草幼苗分别用 0.2 mol/L NaCl、150 μmol/L CdCl2、150 μmol/L CuSO4、150 μmol/L ZnCl2和 150 μmol/L ABA 溶液浇灌土壤进行胁迫处理。分别在胁迫后0、6、24、48 h取二色补血草的叶片(地上部分)和根部组织,用蒸馏水清洗,拭干后置于-70℃中保存,用于RNA的提取。
1.2.2 实时定量RT-PCR分析基因的表达
采取 CTAB法[7]提取二色补血草总 RNA,并用 DNaseΙ(Promega公司)消化,去除 DNA。然后参照TaKaRa Prime-ScriptTMRT试剂盒(大连宝生物公司 Code:DRR037S),以消化后的RNA为模板,反转录合成cDNA。将反转录产物稀释10倍,用作定量RT-PCR模板。
实时定量PCR反应试剂盒为SYBR Green Realtime PCR Master mix(Toyobo Co.,Ltd,Osaka,Japan)。反应体系为:2×SYBR Green Realtime PCR Master mix 10 μL,引物各 0.5 μL(浓度为 10 μmol/L),水 7 μL,模板 2 μL。定量 PCR 反应条件为:94℃预变性30 s;94℃ 12 s,58℃ 30 s,72℃ 40 s;81℃读板1 s,45个循环,然后在荧光定量PCR仪上完成RT-PCR。用18S rRNA(EU039827)和β-Tublin(EH793552)基因作为内参基因。引物序列见表1。

表1 荧光定量PCR引物
2 结果与分析
2.1 二色补血草LbTPx基因全长cDNA的获得及序列分析
经BlastX分析显示该基因cDNA全长为1 016 bp,其中:5’非翻译区146 bp,3’非翻译区69 bp。对其ORF进行分析,自147位的ATG起,止于947位的TGA,开放阅读区全长为801 bp,共编码266个氨基酸。通过ExPASY网站(http://www.expasy.org/tools/pi_tool.html)在线分析,计算该基因编码蛋白的分子质量为 47.99×10-24kg,理论等电点为 8.83,此蛋白为碱性蛋白质。二色补血草LbTPx编码区序列及由此推导的氨基酸见表2。
2.2 二色补血草LbTPx基因蛋白质序列保守区预测
用 NCBI的 Conserved Domains 程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白的保守区。如图1所示,根据预测的保守区结果可知,该基因属于2-Cys类Prx家族的硫氧还蛋白过氧化物酶基因,具有一个典型的2-CysPrx亚家族结构域。
2.3 二色补血草LbTPx与其他植物TPx蛋白氨基酸序列同源性
利用Blastp进行蛋白质序列相似性搜索,选择了9种与二色补血草LbTPx蛋白氨基酸序列相似性较高的植物TPx氨基酸序列,用ClustalX(1.83)进行多序列比对分析(见表3)。从多序列比对结果可以看出,氨基酸个数从258~288不等,变化不大。但是这10种植物氨基序列的同源性很低,在60%~65%之间。
2.4 二色补血草LbTPx基因在非生物胁迫中的表达模式
为了研究LbTPx基因在盐、ABA、重金属不同胁迫处理下的表达模式,进行了实时荧光定量PCR(见表4)。由表4可见:在ABA胁迫下,叶中LbTPx的表达量除了在胁迫6 h时表达量略低于0 h外,其余的表达量都显著高于0 h(P<0.01)。而在根中ABA抑制了LbTPx基因的表达。CuSO4处理和NaCl处理时LbTPx基因在根和叶中的表达量明显高于对照0 h(P<0.01),在胁迫24 h时LbTPx基因在叶中的表达量达到最高峰,说明CuSO4和盐胁迫诱导了 LbTPx基因的表达。CdCl2和ZnCl2胁迫时,LbTPx基因在叶中的表达量明显高于0 h,并且随着时间进程而明显上升,在胁迫48 h时达到最大值;但LbTPx基因在根中的表达受到了抑制。总体而言,不同胁迫下,LbTPx基因在根中的表达量总是低于叶部。以上结果说明,LbTPx基因能够对 NaCl、ABA、CuSO4、CdCl2及 ZnCl2等非生物胁迫作出应答。

表2 二色补血草LbTPx编码区序列及由此推导的氨基酸序列

图1 二色补血草LbTPx蛋白保守区预测结果
3 结论与讨论
随着对过氧化物酶研究的不断深入,人们越来越认识到它在生物体内的重要性。过氧化物酶在生物体内的主要功能是细胞脱毒能力,抵抗氧化压力和调节由过氧化氢介导的信号转导和免疫反应。TPx属于过氧化物酶超家族(Prx)中的一员,广泛存在于酵母、真菌、植物、哺乳动物和人类等多种生物体内。研究表明,硫氧还蛋白过氧化物酶能够清除氧自由基而具有抗氧化胁迫的能力。
本研究从二色补血草cDNA文库中分离出一个编码硫氧还蛋白过氧化物酶的基因,将其命名为LbTPx。生物信息学分析表明,LbTPx基因属于2-Cys类Prx超家族成员之一。实时定量PCR结果表明,在不同的非生物胁迫条件下,LbTPx基因的表达模式不同。NaCl和CuSO4胁迫均能诱导LbTPx基因在二色补血草根和叶中的表达;ABA、ZnCl2和CdCl2处理则只能诱导LbTPx基因在二色补血草叶中的表达,而抑制其在二色补血草根中的表达。此外,LbTPx基因在二色补血草叶部器官和根部器官的表达量具有明显的差异,LbTPx在二色补血草叶中的表达量明显高于根中,说明该基因的表达具有一定的组织器官特异性。

表3 二色补血草LbTPx氨基酸序列与其它9种植物TPx氨基酸序列比较
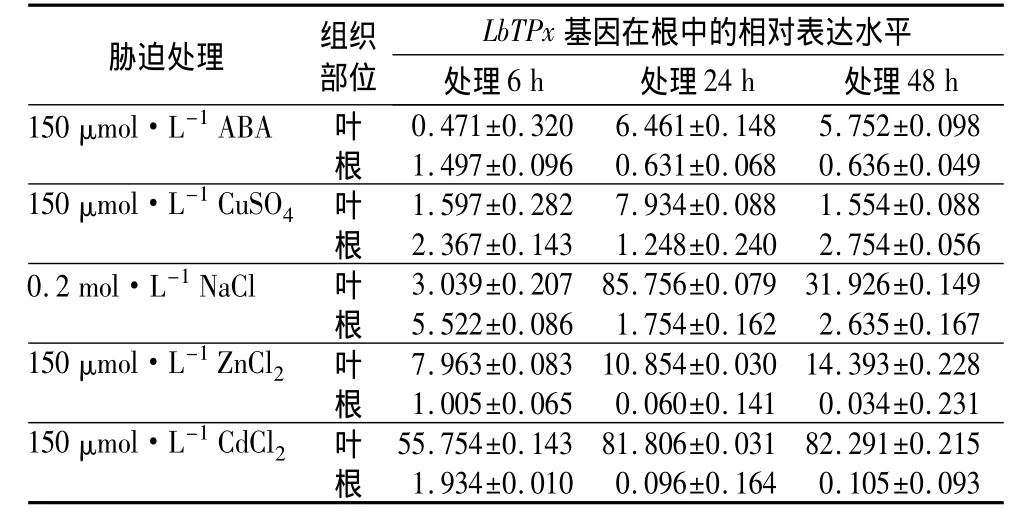
表4 实时定量PCR分析二色补血草中LbTPx基因在根、叶中的表达模式
目前,国内对TPx的研究还刚刚起步,而且已知的植物TPx基因数量不多。因此,从不同植物中克隆TPx基因,并对其在不同逆境下的不同组织中的表达情况进行研究,对进一步了解TPx基因的功能极为必要。本研究克隆了二色补血草的LbTPx基因,并对其在重金属、盐和ABA胁迫条件下的表达情况进行了分析,有助于进一步了解LbTPx基因的功能。
[1]张宝田.耐盐碱的二色补血草[J].植物杂志,2001(5):21.
[2]Hasegawa P M,Bressan P A,Zhu J k,et al.Plant cellular and molecular response to high salinity[J].Anne Rev Plant Physiol Mol Biol,2000,51:463-499
[3]Desikan R,A-H-Mackerness S,Hancock J T,et al.Regulation of the arabidopsis transcriptome by oxidative stress[J].Plant Physiology,2001,127:159-172.
[4]Butterfield L H,Merino A,Golub S H,et al.From cytoprotection to tumor suppression:the multifactorial role of peroxiredoxins[J].Antioxid Redox Signal,1999,1(4):385-402.
[5]Kim H,Lee T H,Park E S,et al.Role of peroxiredoxins in regulating intracellular hydrogen peroxide and hydrogen peroxide-induced apoptosis in thyroid cells[J].Biol Chem,2000,275(24):18266-18270.
[6]Jin D Y,Chae H Z,Rhee S G,et al.Regulatory role for a novel human thioredoxin peroxidase in NF-kappaB activation[J].Biol Chem,1997,272(49):30952-30961.
[7]王玉成,薄海侠,杨传平.胡杨、柽柳总RNA提取方法的建立[J].东北林业大学学报,2003,31(5):99-100.

