低温驯化过程中大青杨叶片差异蛋白质分析1)
李春明
(林木育种国家工程实验室(北京林业大学),北京,10083)
白 卉
(黑龙江省林业科学研究所)
于文喜
(黑龙江省林业科学院)
温度是重要的环境因子之一,主要影响植物分布以及生长、发育等多个生命过程[1]。温带木本植物通过休眠可以避开冬季极端低温,但早春与晚秋季节仍面临低温胁迫风险。通过低温驯化增强抗寒能力是木本植物应对秋季低温胁迫的重要方式之一。该过程主要表现为生长减缓或停止,伴随大量活性氧的生成[2],含水量降低[3]等。另外低温驯化过程会改变基因表达[4-7],主要表现蛋白表达上调,如抗冻蛋白[8],热激蛋 白 (HSP)[9],稳定蛋白[10],晚期胚胎富集蛋白(LEA)[11]等。
大青杨(P.ussuriensis Kom),又称憨大杨、哈达杨。自然分布于我国东北的长白山、小兴安岭林区,材质优良,抗寒性强,是东北三省东部山区森林更新的主要树种之一[12]。在长期进化过程中,大青杨形成了特有的低温适应机制,但对其低温适应机制研究不够深入,暂未见有关大青杨低温分子适应机制方面的研究。蛋白质是生命活动的执行者,直接影响植物的生长发育,通过对大青杨休眠前低温驯化过程中蛋白质差异表达的研究,寻找其低温驯化过程中起作用的重要蛋白质,能够从蛋白质水平研究其低温适应机制,对全面研究大青杨抗寒机理具有重要的理论及实践意义。
1 材料与方法
1.1 植物材料
大青杨为同一无性系,通过硬枝扦插繁殖,于2010年5月初定植于规格为20 cm×16 cm×20 cm的塑料花盆中,置于黑龙江省林业科学研究所温室外,培养基质为V(腐殖土)∶V(河沙)=3∶1,每周浇水2次,10~15 d喷施1次10%MS溶液,培养4个月后开始试验。2010年9月8日、9月21日、10月6日,于上午9:00时至10:00时,选择3株长势一致幼苗,每株取功能叶5~8片,混合后放于冰箱中-80℃保存,用于蛋白质分析。
1.2 实验仪器
Ettan IPGphor II等电聚焦系统、Ettan DALT twelve垂直电泳系统、SE600电泳仪扫描仪、自动染胶仪(美国通用)、高速冷冻离心机(德国Sigma公司)、紫外分光光度计、Powerlook 2100XL UMAX扫描仪(台湾)。
1.3 主要试剂
固相 pH 值 4.0~7.0,24 cm 梯度干胶条、2D-Quant试剂盒、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Bis-Acrylamide),均购自 Amersham Biosciences公司。苯甲基磺酰氟(PMSF)、碘乙酰胺、二硫苏糖醇(DTT)、N'N'N'N'-四甲基乙二胺(TEMED)购自Sigma公司;Trizol购自Invitrogen公司,Tris-base、溴酚蓝、蛋白 Marker、三氯乙酸(TCA)、聚乙烯吡咯烷酮(PVPP)、牛血清白蛋白(BSA)、考马斯亮蓝R-350、低熔点琼脂糖、β-巯基乙醇(β-ME)购自 BBI(Bio Basic Inc,Canada)。胰蛋白酶、酶抑制剂购自德国Roche公司。其它试剂为国产分析纯。所有溶液均用Milli-Q制备的纯水配制。
1.4 实验方法
样品制备:蛋白质提取方法采用三氯醋酸/丙酮沉淀法[13]。
蛋白质样本的定量:应用Amersham Biosciences公司的2D-Quant试剂盒,进行蛋白质样本的定量。具体操作步骤见Amersham Biosciences公司提供的双向电泳原理和方法。
双向电泳:①第一向等电聚焦(IEF)。初始IEF:100 V 1 h,200 V 1 h,500 V 1 h,1 000 V 1 h,1 000~8 000 V 1 h;IEF 到稳定状态:8 000 V 10 h。②IPG胶条平衡和第二向 SDSPAGE电泳。IPG胶条平衡参照Amersham Biosciences公司提供的双向电泳原理和方法,平衡后进行聚丙烯酰胺凝胶,将平衡好的IPG胶条用电泳缓冲液冲洗后胶面朝外小心置于第二向PAGE胶上,在胶的上面加入低熔点琼脂糖封闭液(0.5%琼脂糖,0.002%溴酚蓝溶于SDS电泳缓冲液中),待琼脂糖凝固后即可进行第二向SDS凝胶电泳。电泳条件见表1。

表1 第二向Ettan DALT twelve系统电泳参数
染色:采用考马斯亮蓝染色法[14]。
凝胶扫描:凝胶显色后用UMAX 2100XL扫描仪进行图像扫描,图像扫描仪经强度矫正后,透射扫描2-DE凝胶(光学分辨率300像素,象素深度8bite)。
图像分析:所得2-DE图谱利用PDQuest V 8.0图像分析软件进行分析处理。
蛋白质的胶内酶解:方法参见毕影东方法[15],略有改动,加入酶液后,改水浴为37℃空气浴倒置酶解12~14 h。
蛋白质的质谱分析:Ultraflex TM MALDI-TOF-MS质谱仪检测,获得蛋白点的肽指纹图谱(PMF)信息。
数据分析及Mascot数据库搜索:应用本地服务器上的Matrix server 2.0模块选择毛果杨蛋白库(网站http://www.ncbi.nlm.nih.gov)对 PMF信息进行检索。蛋白选择胰蛋白酶(Trypsin),可变修饰选择(Oxidation),固定修饰选择(Carbamidomethyl),肽段质量标准偏差:±10-4。
蛋白质的生物信息学分析:使用本地Perl程序根据蛋白GI号从毛果杨蛋白数据库(http://genome.jgipsf/poptrl_1/poptrl_1.home.html)中抽提目的序列。应用Blast2Go程序进行Go(gene ontology)分类。
2 结果与分析
2.1 双向电泳图谱
大青杨在9月8日、9月21日、10月6日叶片中蛋白质的双向电泳图谱见图1,在pH值4.0~7.0的范围内3个样品经R-350染色后分别得到了853、988、1192个清晰可分辨的蛋白点。用分析软件PDQuest 8.0对蛋白点进行比较,共获得538个匹配的蛋白点,蛋白点多分布在胶的中上部。

图1 低温胁迫下杨树叶片中蛋白质的双向电泳图谱
2.2 差异蛋白点的选择
使用PDQuest8.0软件,对大青杨3个时期蛋白质点的表达丰度(由软件根据蛋白质点的灰度生成的数量值)进行差异检测,选择相对表达丰度大于200%的蛋白质点作为差异蛋白点,共94个(见图2)。
2.3 差异表达蛋白点质谱鉴定结果
对94个差异蛋白点从胶上回收、酶解后进行质谱鉴定,78个蛋白点得到了完整的肽指纹图谱,在毛果杨与植物蛋白库中进行搜索,其中45个蛋白质得到了鉴定,结果见表2。
已鉴定的45个蛋白中有40个蛋白表达量上调2倍以上,其中有4个蛋白点(19、37、58、90)第1个时期未见表达,后两个时期表达量大增;只有5个蛋白点(53、60、67、72、92)表达量下调2倍以上,蛋白点67在最后1个时期未见表达。另外,出现同一蛋白质出现在蛋白图谱不同位置的现象,蛋白点 4、5、6、7,蛋白点 23、25,蛋白点 39、41,蛋白点 9、67 4 组蛋白肽指纹图谱信息相同,但蛋白点可以通过双向电泳分开(见表2),蛋白点39、41相对分子质量与等电点均有较大差异,其它3组蛋白相对分子质量几乎相同,由于等电点差异而被分开(见图2)。
2.4 蛋白功能分类
植物低温驯化是一个复杂的生理过程,众多蛋白参与这一过程,一个蛋白可能执行多个功能。对已鉴定的45个蛋白进行功能分类,结果表明22个(42%)是胁迫响应蛋白,12个(23%)与呼吸作用相关,9个(17%)与光合作用相关,5个(10%)参与其它生理过程,还有4个(8%)功能未知。
3 讨论
3.1 利用肽指纹图谱鉴定蛋白质
PMF是利用测量酶解肽段相对分子质量并与现有数据库进行比对,进行蛋白质鉴定的一项技术。蛋白点4、5、6、7的PMF信息相同,相对分子质量基本相同,等电点不同,推测这4个蛋白点可能为同一蛋白经翻译后修饰(磷酸化、甲基化、糖基化等)而造成的等电点差异。由于PMF提供的信息有限,不能对翻译后修饰进行鉴定,所以这4个蛋白被鉴定为同一蛋白。类似情况还蛋白点23、25,蛋白点9、67。蛋白点39、41的PMF信息相同,相对分子质量、等电点均不同,推测这两个蛋白可能是由同一基因家族控制的旁系同源基因产物,或者为同一蛋白携带不同信号分子或目标靶序列而形成异构体[16]。
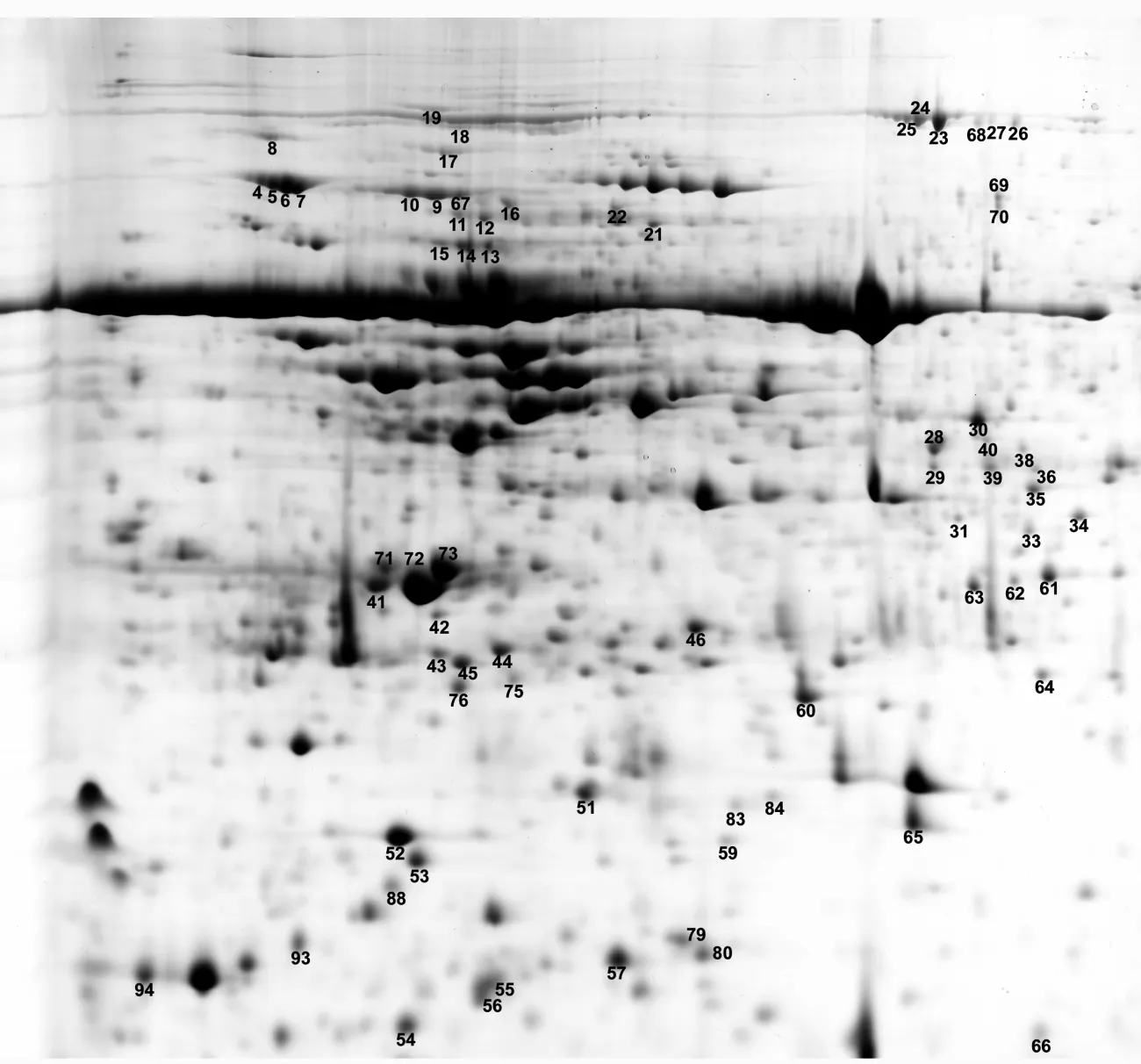
图2 差异蛋白点在胶图上的分布(以大青杨9月8日胶图为例)
3.2 与胁迫相关蛋白
热激蛋白(HSPs)是一类在生物体遭受高温胁迫时合成的保守多肽序列蛋白质[17],又被称为胁迫相关分子伴侣[18]。大量研究表明,低温[19-21]、干旱、盐渍、水淹等多种逆境胁迫也能诱导热激蛋白的积累[22]。热激蛋白参与变性蛋白的重新折叠,防止变性蛋白聚合,参与稳定膜系统等多个生命过程[23-24]。本研究所鉴定的45个蛋白中13个属于热激蛋白/分子伴侣类,10 个属于热激蛋白 70 家族(点 4、5、6、7、9、10、16、39、41、67),1 个属于热激蛋白 90 家族(点 8),2 个属于伴侣蛋白前体(点1、45)。除点67表达量下调外,其它12个蛋白在自然低温驯化过程中表达量均显著上调。表明热激蛋白/分子伴侣蛋白在大青杨低温驯化过程中起到重要作用。
其它与胁迫响应蛋白 9 个(11、12、13、21、22、46、58、90、92),在大青杨自然低温驯过程中,除抗病蛋白(点92)表达量下调外,其余表达量均上调,与前人研究结论基本一致。其中蛋白点21(磷酸甘油酸变位酶)[1]与蛋白点90(ATP合酶)是三羧酸循环关键酶[25],低温驯化过程中,三羧酸循环关键酶表达量上调,会促进下游产物及ATP生成,为大青杨应对低温胁迫提供必需的物质及能量。蛋白点46(抗坏血酸过氧化物酶)与蛋白点58(过氧化还原酶)等抗氧化酶表达量上调,有助于清除大青杨低温胁迫下产生的过量活性氧,该结果与Renaut研究相似[20]。
3.3 与呼吸作用相关蛋白
呼吸作用是植物细胞最基本的生命活动,环境胁迫下,能量代谢加强是植物抵御逆境的基本特征。本研究中,低温胁迫条件下共鉴定出12个与呼吸作用相关蛋白,包括温度敏感丝状胁迫响应蛋白(点11),细胞分裂蛋白(点12),Rubisco β亚基(点13、14),翻译延伸因子G(点17),磷酸甘油酸变位酶(点21),羧化酶前体(点23、25),苹果酸脱氢酶(36),脱氢酶亚基(37),酯酶D(点62),ATP合酶(点90)等在低温胁迫下表达量都显著上调。

表2 低温胁迫下杨树叶片蛋白点质谱鉴定
能量代谢是各种生命活动的基础代谢,不仅为各种生命活动提供必需的ATP,还为众多代谢过程提供中间代谢产物。蛋白点36为苹果酸脱氢酶是三羧酸循环中起重要作用的酶[26],其表达丰度上调会促进能量生成及下游物质的合成,为大青杨低温驯化及抵御低温胁迫提供必要的能量及物质。
3.4 与光合作用相关蛋白
光合作用是绿色植物将光能固定及物质合成的过程,也是各种生命活动的起点。叶绿体是进行光合作用的细胞器,由于低温等逆境胁迫会对叶绿体类囊体膜造成伤害,因此,必将影响植物的光合代谢,从而影响植物的正常生长发育[19]。本研究从大青杨叶片中鉴定与光合作用相关的蛋白包括温度敏感丝状胁迫响应蛋白(点11),细胞分裂蛋白(点12),叶绿体蛋白酶(点22),Rubisco大亚基(点52、61),叶绿体铜锌超氧化物歧化酶(点57),叶绿体放氧蛋白(点71)等7个蛋白在自然低温驯化过程中蛋白表达量显著上调;ATP合酶δ链(点53),叶绿体放氧蛋白(点72)等2个蛋白表达量显著下调。
Xiao等[27]研究表明,抗旱能力差的杨树叶片中Rubisco大亚基在干旱胁迫下表达量下调。Zhao Yan等[25]发现狗牙根叶片在干旱胁迫下,叶绿素结合蛋白、叶绿体放氧蛋白、ATP合酶与Rubisco大亚基表达均下调,直接影响光合作用捕光过程、电子传递及碳同化3个主要过程。本研究中,只有ATP合酶δ链、叶绿体放氧蛋白2个蛋白表达量下调,表明大青杨在自然低温驯化过程中光反应的光合放氧及光合磷酸化过程受到影响。
3.5 其它蛋白及功能未知蛋白
除以上3类主要蛋白外,本研究还鉴定了翻译延伸因子G(点17),前序列蛋白酶(点19)、细胞质动力蛋白重链(点44)、酯酶D(点62)、抗病蛋白(点92)以及4个未知功能蛋白(34、51、60、70)。这些蛋白质在自然低温驯化过程中表达量变化明显,可能执行某种生物学功能。由于目前对这些蛋白功能信息了解有限,它们在大青杨自然低温驯化中的表达变化与其在适应低温胁迫的调节机制和功能还需要进一步的研究。
3.6 蛋白质在大青杨低温驯化过程中的作用
大青杨是黑龙江省乡土树种,在长期进化过程中形成了特有低温适应机制。通过本研究可以推测,蛋白质表达量变化与大青杨低温驯化关系密切。大青杨在低温及短光周期的诱导下,热激蛋白表达量显著上调。热激蛋白一方面作为功能蛋白参与变性蛋白的重新折叠,防止变性蛋白聚合,稳定新生成蛋白质结构等;另外热激蛋白也起到转导胁迫信号并激活相关基因表达的作用。在热激蛋白调节下,大青杨叶片中呼吸作用相关蛋白、抗氧化酶表达量上调,而参与光反应的蛋白表达量则显著下调,进而调整生理状态,逐步完成低温驯化过程,为抵御低温胁迫做好准备,见图3。

图3 蛋白质丰度变化与大青杨低温驯化关系
[1]J Renaut.Proteomics and low-temperature studies:bridging the gap between gene expression and metabolism[J].Physiologia Plantarum,2005,126:97-109.
[2]Prasad T K,Anderson M D,Martin B A,et al.Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen peroxide[J].Plant Cell,1994,6:65-74.
[3]Imanishi H T,Suzuki T,Masuda K,et al.Accumulation of raffinose and stachyose in shoot apices of Lonicera caerulea L.during cold acclimation[J].Sci Hort,1998,72:255-263.
[4]Chen jing,Dennis Doucet.Expression profile matrix of Arabidopsis transcription factor genes suggests their putative functions in response to environmental stresses[J].Plant Cell,2002,14:559 -574.
[5]Guy C.Cold acclimation and freezing stress tolerance:role of protein metabolism[J].Ann Rev Plant Physiol Plant Mol Biol,1990,41:187-223.
[6]Pearce R S.Molecular analysis of acclimation to cold[J].Plant Growth Regul,1999,29:47-76.
[7]Seki M,Narusaka M,Abe H,et al.Monitoring the expression pattern of 1300 Arabidopsis genes under drought and cold stresses by using a full-length cDNA microarray[J].Plant Cell,2001,13:61-72.
[8]Hon W C,Griffith M,Mlynarz A,et al.Antifreeze proteins in winter rye[J].Physiol Plant,1997,100:327-332.
[9]Wisniewski M E.Seasonal patterns of dehydrins and 70-kDa heatshock proteins in bark tissues of eight species of woody plants[J].Physiol Plant,1996,99:496-505.
[10]Wang W.Characterization of SP1,a stress-responsive,boiling soluble,homo-oligomeric protein from aspen[J].Plant Physiol,2002,130:865-875.
[11]Antikainen M,Griffith M.Antifreeze protein accumulation in freezing-tolerant cereals[J].Physiol Plant,1997,100:423-432.
[12]王冰,王建光,姜秀煜,等.阔叶红松林的伴生乡土杨树-大青杨[J].林业科技,2003,28(6):12-15.
[13]Damerval C,de Vienne D,Zivy M,et al.Technical improvments in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J].Electrophoresis,1986,7:52-54.
[14]Rabilloud T.Detecting Proteins separated by 2-D gel electrophoresis[J].Anal Chem,2000,72:48A-55A.
[15]毕影东.樟子松顶芽休眠与萌发转换的蛋白质组学研究[D].哈尔滨:东北林业大学林学院,2010.
[16]Christophe.Mapping the proteome of poplar and application to the discovery of drought-stress responsive proteins[J].Proteomics,2006(24):6509-6527.
[17]Vierling E.The role of heat shock proteins in plants[J].Ann Rev Plant Physiol Plant Mol Biol,1991,42:579-620.
[18]Miernyk J A.The 70 kDa stress-related proteins as molecular chaperones[J].Trends Plant Sci,1997,2:180-187.
[19]Lopez Matas M A.Protein cryoprotective activity of a cytosolic small heat shock protein that accumulates constitutively in chestnut stems and is up-regulated by low and high temperatures[J].Plant Physiol,2004,132:1708-1717.
[20]Renaut J.Responses of Poplar to Chilling Temperatures:Proteomic and Physiological Aspects[J].Plant Biology,2004,6:81-90.
[21]Taylor N L,Heazlewood J L,Day D A,et al.Differential impact of environmental stresses on the pea mitochondrial proteome[J].Mol Cell Proteomics,2005,4:1122-1133.
[22]Sabehat A,Lurie S,Weiss D.Expression of small heat shock proteins at low temperatures-A possible role in protecting against chilling injuries[J].Plant Physiol,1998,117:651-658.
[23]Sung D Y,Vierling E,Guy C L.Comprehensive expression profile analysis of the Arabidopsis Hsp70 gene family[J].Plant Physiol,2001,129:789-800.
[24]Tsvetkova N.Small heat-shock proteins regulate membrane lipid polymorphism[J].Proc Natl Acad Sci,2002,99:13504-13509.
[25]Yan Zhao.Identification of proteins associated with water-deficit tolerance in C4 perennial grass species,Cynodon dactylon× Cynodon transvaalensis and Cynodon dactylon[J].Physiologia Plantarum,2010,141:40-55.
[26]Jiang Yuanqing.Comparative proteomic analysis of NaCl stress-responsive proteins in Arabidopsis roots[J].Journal of Experimental Botany,2007,58:3591-3607.
[27]Xiao X,Yang F,Zhang S,et al.Physiological and proteomic responses of two contrasting Populus cathayana populations to drought stress[J].Physiol Plant,2009,136:150-168.

