SD大鼠阿霉素慢性心力衰竭模型的建立与评价
吴运香,张 野,谢春林,张书杰,解 翔,姜 凡,陈志武
(安徽医科大学第二附属医院1.麻醉科、2.超声诊断科,安徽合肥 230601;3.安徽医科大学药理学教研室,安徽合肥 230032)
慢性心力衰竭是各种心血管疾病发展的终末阶段,近年来呈上升趋势,严重威胁人类的健康。用于心力衰竭研究的动物模型较多[1],如压力超负荷模型[2],药物所致的心肌病等。阿霉素(adriamycin,ADR)是临床常用的蒽环类抗肿瘤药物,因其与心脏组织的高亲和力而具有明显的心脏毒性[3-6]。国外很早就有关于阿霉素心肌病的研究[3-4],但目前对于阿霉素心力衰竭的动物模型说法不一[5-6,9-11],动物死亡率相对较高;本实验通过长期多次静脉给予阿霉素成功建立了一种非缺血性慢性心力衰竭模型,操作简单,可重复性高,为慢性心力衰竭相关研究提供了良好的模型。
1 材料与方法
1.1实验动物成年♂SD大鼠28只,体质量(235±15)g,由安徽医科大学实验动物中心提供[动物合格证号:SCXK(皖)2005-001]。
1.2主要药品试剂与仪器盐酸阿霉素,批号:9QL1038,购自Prizer Italia S.r.l;Hema TGL-16R 冷冻高速离心机,珠海黑马仪器有限公司;Vivid 7.0彩色超声仪,美国GE公司;血浆脑利钠肽(BNP,brain natriuretic peptide)酶联免疫试剂盒,批号:201001118,上海森雄生物有限公司;SPECTRA MAX 190酶标分析仪,美国Sigma公司。
1.3方法
1.3.1动物模型制备及分组参照文献[1]方法并加以改进,所有大鼠随机分为两组:正常对照组(CON,n=8)和阿霉素心力衰竭组(ADR,n=20)。将ADR组大鼠置于自制大鼠固定器中,37~45℃温水浸泡1 min,酒精擦拭后用24G套管针尾静脉注射阿霉素2 mg·kg-1,药物浓度稀释至0.5 g·L-1,每周1 次,共 6 周,累积总量达 12 mg·kg-1,末次注射完成2周后测定心功能和形态学指标;CON组大鼠给予相同体积的0.9%氯化钠溶液,周期同ADR组。
1.3.2超声心动图CON组与ADR组8周后存活的大鼠,行超声心动图检测。腹腔注射戊巴比妥25 mg·kg-1行全身麻醉[7],固定后左前胸备皮,并用体积分数为0.7的乙醇消毒。采用GE Vivid 7.0超声仪12L探头,频率13MHz经胸高频超声检查,在二维超声引导下用M型超声经胸骨左心长轴切面测量左心室舒张末内径(LVEDD),左心室收缩末内径(LVESD),求3个心动周期的平均值,并按照Teichholtz公式;LVEF=[(100-Y)×0.15]+Y;Y=[(LVEDD2-LVESD2)]×100/LVEDD2;LVFS=(LVEDD-LVESD)×100/LVEDD,计算左心室射血分数(LVEF)及左室短轴缩短率(LVFS)。
1.3.3BNP的测定颈动脉取血1.0 ml,冷冻高速离心机3 000 r·min-1离心8 min,取上清,-20℃保存待测。ELISA法测定BNP水平,具体操作按照试剂盒说明。
1.3.4心肌组织形态学观察大鼠取血后取其心脏,置生理盐水中冲洗残血。取心室肌组织,10%多聚甲醛固定,常规石蜡包埋切片,进行HE染色和VG染色,显微镜观察并摄片,JEOR 801D形态学图像分析系统(Version 6.0)测量并参照文献[8]所述方法计算心肌间质胶原容积分数(CVF,collagen volume fraction)及心肌血管周围胶原面积(PCVA,perivascular circumferential collagen area)。CVF(%)=胶原面积/总面积,其中胶原面积不包括血管周围胶原面积;PCVA(%)=心室内小动脉管腔周围胶原面积/动脉管腔面积。
1.4统计学处理全部数据采用SPSS13.0统计软件进行分析,计量资料采用±s表示,采用两样本均数的t检验。
2 结果
2.1一般情况与存活率ADR组大鼠在造模过程中陆续出现精神萎靡,进食减少,体重增长缓慢或下降,活动量下降,口唇及足趾发绀等慢性心力衰竭的症状。ADR组大鼠存活20只,死亡12只,存活率为62.5%。CON组大鼠均存活。
2.2超声心动图心功能比较造模8周末超声心动图测定两组大鼠心功能。ADR组大鼠心室腔扩大,心室壁厚度增加,LVEDD,LVESD增加,但仅LVESD与CON组比较差异有统计学意义(P<0.01);LVEF及 LVFS明显降低(P<0.01),显示有左室收缩功能障碍。CON组大鼠超声心动图检查未见明显心功能异常,见Fig 1,Tab 1。
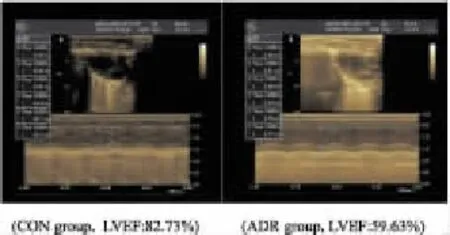
Fig 1 Comparison of left ventricular function by echocardiography between CON and ADR groups after 8 weeks
2.3血浆脑利钠肽(BNP)水平的测定与CON组相比,ADR组大鼠血浆BNP水平明显升高(P<0.01),见Tab 2。
2.4心肌组织形态学改变HE染色可见,CON组大鼠心肌细胞排列整齐,心肌间隙正常,无炎性渗出;ADR组心肌细胞排列紊乱,胞质呈溶解状态,核深染;可见心肌纤维溶解断裂,心肌细胞间隙明显增宽,或有红细胞沉积,中性粒细胞、单核细胞及淋巴细胞浸润,见Fig 2A-B。VG染色显示心肌细胞呈黄色,胶原纤维呈红色,见Fig 2C-F。心肌胶原含量半定量分析显示,与CON组相比,ADR组心肌间质CVF和血管周围 PCVA明显增高,差异有统计学意义(P<0.01),见 Fig 2G-H。
Tab 1 Comparison of body weight and left ventricular function by echocardiography between CON and ADR groups after 8 weeks(±s)

Tab 1 Comparison of body weight and left ventricular function by echocardiography between CON and ADR groups after 8 weeks(±s)
HR:heart rate;BW:body weight;LVEDD:left ventricular end-diastolic diameter;LVESD:left ventricular end-systolic diameter;LVFS:left ventricular fractional shortening;LVEF:left ventricular ejection fraction.*P <0.05,**P <0.01 vs CON group
Group BW/g HR/bpm LVEDD/mm LVESD/mm LVFS/% LVEF/%CON(n=8)371 ±13 402 ±18 6.80 ±0.48 3.20 ±0.34 53.86 ±2.0081.89 ±1.56 ADR(n=20)282±25* 394±16 7.10±0.36 4.90 ±0.26** 30.19±1.40** 58.56 ±1.68**
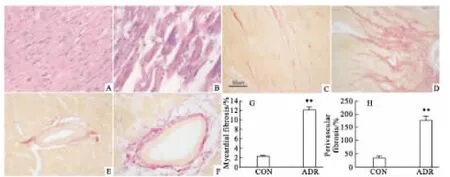
Fig 2 Comparison of pathological changes and collagen content at the end of eighth week by HE and VG stain(HE ×400,A-B)(VG ×400,CF)HE staining×400 A:CON group;B:ADR group;VG staining×400 Myocardial interstitial fibrosis,C:CON group;D:ADR group;Perivascular fibrosis E:CON group;F:ADR group G:Statistic results of myocardial interstitial fibrosis;H:Statistic results of perivascular fibrosis.**P <0.01 vs CON group
Tab 2 Comparison of the level of brain natriuretic peptide(BNP)by ELISA between CON and ADR groups after 8 weeks(±s)

Tab 2 Comparison of the level of brain natriuretic peptide(BNP)by ELISA between CON and ADR groups after 8 weeks(±s)
**P<0.01 vs CON group
Group BNP/ng·L -1 CON(n=8)38.4 ±4.8 ADR(n=20)104.9 ±7.4**
3 讨论
本研究选取可致心肌毒性的阿霉素[2-3]制作慢性心力衰竭模型。阿霉素致心力衰竭主要是由于心肌组织自由基的生成引起膜脂质过氧化,损害了细胞膜的完整性[9]。单次[11]或多次[5,10]给药后长期观察,可建立阿霉素慢性心肌毒性模型,动物出现心肌病后,损害进一步加重则可演变成为心力衰竭[1];阿霉素心脏损害的发生率及程度与其在体内的蓄积量有直接关系[4],具有时间累积效应。目前国内外制作慢性阿霉素心肌病模型的方法很多,但药物剂量和给药方式各不相同。在预实验中,参照Lu等[8-10]的方法以总量15 mg·kg-1于2周内腹腔注射阿霉素6次或是总量24 mg·kg-1以4 mg·kg-1每周 1 次腹腔给药等方法,模型死亡率高,可重复性差。可能是由于药物效价不同或动物种属的差异;且腹腔注射会导致腹部皮肤局部坏死,大量药物局部刺激腹腔,胃肠道毒性更明显;实验者最终选定2 mg·kg-1尾静脉给药,为确保给药量和延长给药时间,选择静脉留置针注射;注药结束后用少量生理盐水冲洗,减少药物残留和对局部血管壁的刺激。使用大鼠固定器实现了对大鼠清醒状态的静脉注药,避免了多次麻醉对大鼠的影响;每周1次的给药间隔制作大鼠心力衰竭模型,操作简单且较稳定。
目前实验研究常用的判断心力衰竭模型的方法[2,13]有心重/体重,有创的心功能的测定,观察心肌组织形态学的改变,均需处死大鼠;本实验通过超声心动图测定尾静脉注射阿霉素8周末大鼠的心功能,即通过一种无创的方式判定大鼠心力衰竭与否;与CON组相比,ADR组大鼠心功能明显降低,与Schwarz等[5]所述相一致。众多的临床实验和研究[12-13]已证实,BNP水平与左心室舒张末压呈正相关,与左心室功能呈负相关;心力衰竭时BNP水平明显升高,与心力衰竭程度呈正相关;可用于诊断心力衰竭并依据其水平判断心力衰竭的程度和预后,并可结合超声心动图指标和心血管危险因素提高BNP诊断心力衰竭的敏感性和特异性。本实验中通过观察大鼠一般情况,超声心动图测定其心功能,HE染色和VG染色观察其组织形态学的改变,均说明ADR组大鼠心力衰竭模型是成功的;ADR组大鼠血浆BNP水平升高进一步证实这一点。
考虑到麻醉对心功能,特别是心力衰竭大鼠心功能[14]的影响,参照Stein[7]等的方法采用腹腔注射小剂量戊巴比妥,不仅能够达到与大鼠清醒状态相似的左心室结构和功能参数,而且使测量更容易且精准。
综上所述,多次尾静脉注射阿霉素可以建立稳定可靠的慢性心力衰竭模型,且可通过超声心动图进行无创的判定,操作简单,可重复性高;可用于慢性心力衰竭的相关研究,也可为在此基础上进行进一步的心脏保护策略的研究奠定了基础。
[1]熊维生,陈 修,金祝秋,等.心功能不全实验法[M]//徐叔云,卞如濂,陈 修,主编.药理实验方法学.第3版.北京:人民卫生出版社,2002:1079-96.
[1]Xiong W S,Chen X,Jin Z Q,et al.Cardiac Insufficiency Experimental Method//Xu S Y,Bian R L,Chen X,chief ed.Methodology of pharmacological experiment.3rd ed.Beijing:People’s Medical Publishing House,2002:1079 -96.
[2]邢晓倩,徐 健,吕雄文,等.氯沙坦和辛伐他汀对逆转压力负荷心力衰竭大鼠心室心肌纤维化的作用[J].中国药理学通报,2009,25(10):1376 -9.
[2]Xing X Q,Xu J,Lü X W,et al.Combination of simvastain and losartan attenuates left ventricular myocardial fibrosis after pressure overload state in rats[J].Chin Pharmacol Bull,2009,25(10):1376-9.
[3]Singal P K,Deally C M,Weinberg L E.Subcellular effects of adriamycin in the heart:a concise review[J].J Mol Cell Cardiol,1987,19(8):817-28.
[4]Lefrak E A,Pitha J,Rosenheim S,Gottlieb J A.A clinicopathologic analysis of adriamycin cardiotoxicity[J].Cancer,1973,32(2):302-14.
[5]Schwarz E R,Pollick C,Dow J,et al.A small animal model of nonischemic cardiomyopathy and its evaluation by transthoracic echocardiography[J].Cardiovasc Res,1998,39(1):216 - 23.
[6]Ibrahim M A,Ashour O M,Ibrahim Y F,et al.Angiotensin-converting enzyme inhibition and angiotensin AT(1)-receptor antagonism equally improve doxorubicin-induced cardiotoxicity and nephrotoxicity[J].Pharmacol Res,2009,60(5):373 - 81.
[7]Stein A B,Tiwari S,Thomas P,et al.Effects of anesthesia on echocardiographic assessment of left ventricular structure and function in rats[J].Basic Res Cardiol,2007,102(1):28 -41.
[8]Gao S,Long C L,Wang R H,Wang H.K(ATP)activation prevents progression of cardiac hypertrophy to failure induced by pressure overload via protecting endothelial function[J].Cadiovasc Res,2009,83(3):444 -56.
[9]Lu L H,Wu W K,Yan J Y,et al.Adriamycin-induced autophagic cardiomyocyte death plays a pathogenic role in a rat model of heart failure[J].Int J Cardiol,2009,134(1):82 -90.
[10]李玉玲,杨建业,唐俊明,等.阿霉素诱导大鼠心衰模型不同方案的比较[J].中国比较医学杂志,2006,16(2):93 -6.
[10]Li Y L,Yang J Y,Tang J M,et al.Comparison of heart failure models induced by different adriamycin administration regimens in rats[J].Chin J Comp Med,2006,16(2):93 -6.
[11]Li L,Takemura G,Li Y,et al.Granulocyte colony-stimulating factor improves left ventricular function of doxorubicin-induced cardiomyopathy[J].Lab Invest,2007,87(5):440 - 55.
[12]Parekh N,Maisel A S.Utility of B-natriuretic peptide in the evaluation of left ventricular diastolic function and diastolic heart failure[J].Curr Opin Cardiol,2009,24(2):155 - 60.
[13]任亚丽,徐济良,虞 珏,等.苯那普利与厄贝沙坦对心衰大鼠心室重构过程中AngⅡ受体及ACE2的影响[J].中国药理学通报,2008,24(12):1582 -6.
[13]Ren Y L,Xu J L,Yu J,et al.Effect of benazepril and irbesartan on angiotensinⅡreceptor and ACE2 in chronic heart failure rats during cardiac remodeling[J].Chin Pharmacol Bull,2008,24(12):1582-6.
[14]Berry C J,Thedens D R,Light-McGroary K A,et al.Effects of deep sedation or general anesthesia on cardiac function in mice undergoing cardiovascular magnetic resonance[J].J Cardiovasc Magn Reson,2009,11(1):16 -22.

