山药多糖提取工艺响应面法优化
诸爱士,成 忠
(浙江科技学院生物与化学工程学院,杭州310023)
山药多糖是目前公认的山药重要活性成分之一,其具有许多优越的生理功能[1-3],如免疫调节、增强免疫功能、抗肿瘤、调节血糖、抗细菌、降血脂和抗氧化等。
王刚等[4]采用水提法、许本波等[5]采用微波辅助水提法、李金忠等[6]采用超声辅助水提法、张元等[7]采用酶法等确定了山药多糖提取的最佳工艺条件。但均未考虑预处理时间对得率的影响,也没有考虑溶剂回收。因此,笔者在前文[8]考察了提取过程的温度、时间、水物比(去离子水与预处理过的山药质量比,全文同)、提取次数等因素及预处理时间、溶剂回收再利用等对得率影响的基础上,将响应面法应用于提取山药多糖的优化工艺中,建立多糖提取条件与得率之间的模型,以期获得最优的工艺参数,提高多糖的得率。
1 材料与方法
1.1 主要原料、试剂及仪器
1.1.1 实验原料
山药饮片,产地河南,安徽德昌药业饮片有限公司生产。
1.1.2 实验试剂
无水乙醇、无水乙醚、丙酮、甲醇、正丁醇、硫酸、苯酚、三氯甲烷、葡萄糖,均为AR。
1.1.3 实验仪器
722E型可见分光光度计(上海光谱仪器有限公司),DK-S24型电热恒温水浴锅(上海精宏实验设备有限公司),BS124S型电子天平(北京塞多利斯仪器系统有限公司),RE52CS旋转蒸发仪(上海亚龙生化仪器厂),800B离心机(上海安亭科学仪器厂),DHG-9123A型电热恒温鼓风干燥箱(上海精密实验设备有限公司)。
1.2 实验步骤
1.2.1 山药饮片的预处理
使用前恒温50℃烘干4 h,再粉碎至粉末干燥待用。
1.2.2 山药多糖的提取
山药的预处理和水提方法同文献[9]。
1.2.3 葡萄糖质量浓度测定及提取得率计算
含量测定采用苯酚-硫酸法。经作工作曲线,将吸光度与质量浓度拟合得关系式如下:

其中:X—葡萄糖质量浓度,g/L;Y-485 nm处的吸光度;山药多糖的质量浓度以葡萄糖计[9],山药多糖的得率按以下公式计算:
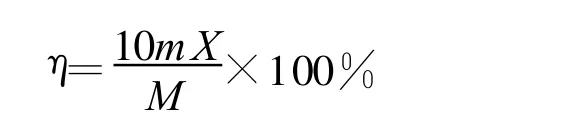
其中:η—山药多糖的得率,%;m—提取出的山药多糖的质量,g;X—由吸光光度法测得的山药多糖的质量浓度,g/L;M—原料山药质量,g。
2 结果与分析
单因素考察实验结果表明,提取温度、提取时间和水物比三因素对多糖的提取得率影响较大,其较佳值分别为60 ℃、2 h、20。现采用Box-Behnken设计[10],以山药多糖得率为目标,乙醇预处理(2+2)h,提取1次,以提取温度、提取时间和水物比分别对应独立变量X1、X2和X3。试验因素与水平编码见表1,模型选用二次方程:


表1 试验因素与水平编码Table 1 Codes and levels of factors chosen
2.1 响应值结果及其拟合模型
由Box-Behnken设计方案所得结果见表2。
通过试验设计软件Design-Expert[11]将表2的结果对模型(1)进行了拟合,得到了拟合方程:

试验的方差分析见表3。

表2 试验设计及结果Table 2 Experimental design and results
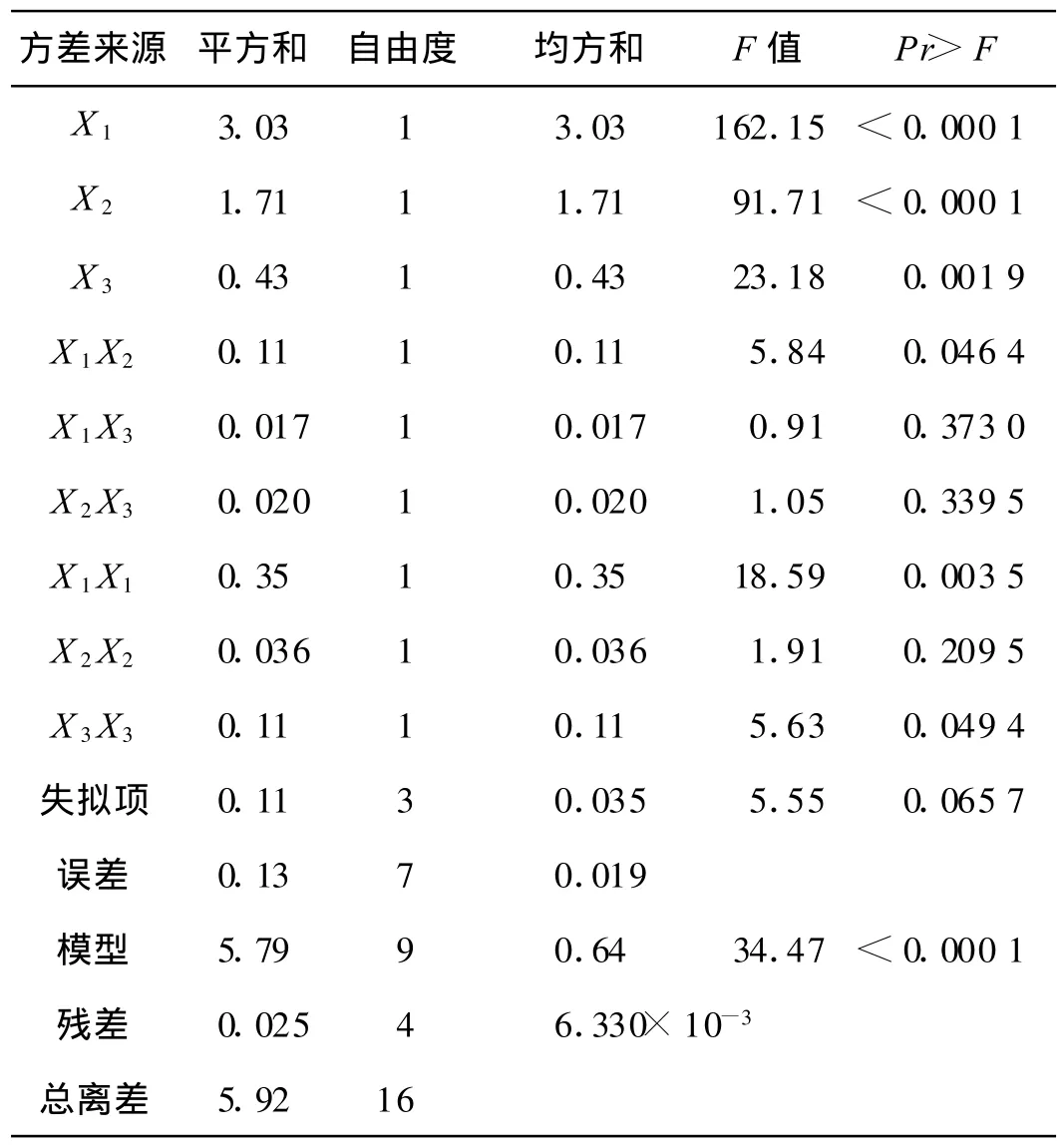
表3 回归模型方差分析Table 3 Analysis of variance for regression equation
表3显示,模型的F值为34.47,F>f0.01(9,4)=14.66,说明因变量和自变量之间的线性关系显著;各试验因子对响应值的影响不是简单的线性关系;模型的失拟项很小,表明该模型对试验拟合情况好。
将回归模型通过SAS软件岭脊分析[12]预测得到山药多糖提取的最佳工艺条件为:提取温度71.1℃,提取时间4.12 h,水物比23.3,在此条件下,山药多糖理论得率6.846%。
2.2 等高线图和响应曲面图分析
保持其他因素不变,可获得某两个因素及其交互作用对得率影响的二元二次方程如下:

由此就可以得到一组响应曲面图及其等高线图,从而可观察某两个因素及其交互作用同时对得率的影响,并为因素的最佳水平确定给出了范围。
回归优化响应面曲面图及等高线图见图1。
由图1a可知,在水物比20固定时,由提取温度55~65℃、提取时间1.5~2.5 h所形成的区域中,随着提取温度的升高与提取时间的增加,得率有所增加,但其增幅有减缓的趋势;当提取温度65℃、提取时间2.5 h时,提取得率最大。

图1 不同因素组合影响多糖得率的曲面图及其等高线Fig.1 Response surface plots and contour plots of yield of yam polysaccharide as function of different conditions
由图1b可知,在提取时间2 h固定时,由提取温度55~65℃、水物比15~25所形成的区域中,随着提取温度的升高与物水比的增加,得率有所增加,但其增幅同样有减缓的趋势;当提取温度65℃、水物比25时,提取得率最大。
由图1c可知,在提取温度60℃时,由提取时间1.5~2.5 h、水物比15~25所形成的区域中,随着提取时间的增加与物水比的增加,得率有所增加,但其增幅依然有减缓的趋势;当提取时间2.5 h、水物比25时,提取得率最大。
2.3 模型的验证
为检验RSM 法的可靠性,采用最优提取条件进行山药多糖的提取实验,在提取温度71.1℃、提取时间4.12 h、水物比23.3、提取次数1次条件下进行3次平行实验,实际测得的多糖得率平均值为6.75%,与理论预测值的相对误差为1.40%。
3 结 语
应用响应面分析法优化得到的山药多糖提取最优条件为:提取温度71.1℃,提取时间4.12 h,水物比23.3,山药多糖得率理论值6.846%,验证实验实际得率为6.75%,误差为1.40%。该法直观有效,并可减少工艺条件选择的盲目性。
山药多糖提取条件优化的回归模型为:
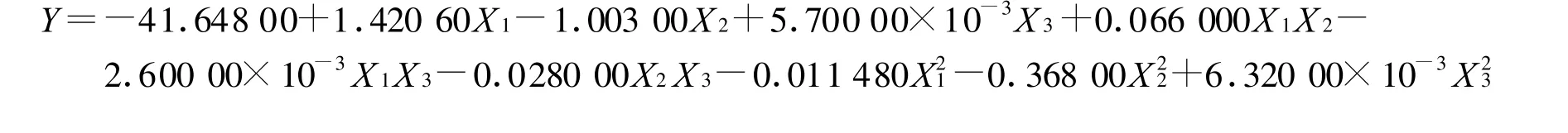
[1] SA UTOUR M,MITAINE-OFFER A C,MIYAMOTO T,et al.A new phenanthrene glycoside and other constituents from dioscorea opposite[J].Chem Pharm Bull,2004,52(10):1235-1237.
[2] 赵国华,李志孝,陈宗道,等.山药多糖的免疫调节作用[J].营养学报,2002,24(2):187-188.
[3] IWU M M,OKUNJI C O,AKAH P,et al.Dioscoretine:the hypoglycemic principle of dioscorea dumetorum[J].Planta Med,1990,56(1):119-120.
[4] 王刚,杜士明,肖淼生,等.山药多糖的提取分离及山药总多糖的含量测定[J].中国医院药学杂志,2007,7(10):1414-1416.
[5] 许本波,张世俊,江洪波.微波辅助法提取山药多糖的研究[J].安徽农学通报,2007,13(12):34-35,60.
[6] 李金忠,马海乐,吴沿友.山药多糖的超声辅助提取技术研究[J].食品研究与开发,2005,26(4):72-75.
[7] 张元,林强,魏静娜,等.酶法提取山药中多糖的工艺研究[J].中国中药杂志,2008,33(4):374-377.
[8] 周垠辉,诸爱士,冯晟.山药多糖提取工艺研究[J].浙江科技学院学报,2009,21(4):323-326.
[9] 梁亦龙,阎光凡,舒坤贤,等.山药水溶性多糖的提取及抗氧化性研究[J].食品研究与开发,2007,28(11):1-3.
[10] 王章存,王雷,董吉林,等.酶法预处理对花生蛋白提取效果的影响[J].农业工程学报,2009,25(3):287-290.
[11] 李大婧,宋江峰,刘春泉,等.超声波辅助提取黑豆皮色素工艺优化[J].农业工程学报,2009,25(2):273-279.
[12] 黄燕,吴平.SAS统计分析及应用[M].北京:机械工业出版社,2006:255-258.

